參附注射液對大鼠膽道缺血再灌注后損傷的保護作用
1.甘肅中醫藥大學基礎醫學院病理教研室,甘肅 蘭州 730000;2.甘肅省中醫院麻醉科,甘肅 蘭州 730050
臨床研究顯示,膽道并發癥作為影響肝移植術后遠期療效的重要并發癥,其發病率為7%~25%,且更容易發生在活體和心腦死亡供體肝移植術后,是影響患者術后長期生存率和移植肝臟無功能的主要原因[1-3],如何避免或減輕供肝缺血再灌注后的膽道損傷已成為研究熱點。參附注射液源自中醫古方參附湯,由人參、附子制備而成,主要成分為人參皂甙和烏頭類生物堿,因其抗自由基、抗Ca2+超載,改善微循環等“多靶效應”廣泛應用于臨床,尤其是在心、肺、肝等臟器缺血再灌注損傷方面,具有明顯的保護作用[4-8],但目前對膽道系統缺血再灌注損傷的作用效應及其機制尚不十分清楚。本實驗通過建立大鼠的膽道缺血再灌注模型,觀察并探討參附注射液對其可能的保護機制。
1 材料與方法
1.1 試驗藥物 參附注射液(每支10 mL,每毫升含生藥紅參100 mg、附子100 mg,批號:Z51020664,三九制藥有限公司),依達拉奉注射液(批號:080511,南京先聲東元制藥有限公司)。
1.2 動物 清潔級健康雄性SD大鼠60只,體重(260±20)g,飼養環境溫度(22±2)℃,自由進食,飲水,由甘肅中醫藥大學實驗動物中心提供,合格證號:0001478。
1.3 試劑 TNF-a、Fas免疫組化試劑盒,SP試劑盒均購自武漢博士德公司,TNF-a和Fas稀釋濃度均為1:150。超氧化物歧化酶(SOD)測試盒、丙二醛(MDA)測試盒購自南京建成生物研究所。
1.4 儀器 全自動生化分析儀(奧林巴斯),病理切片機和醫學顯微照相系統為德國萊卡。
1.5 方法 參照Peralta 等[9]建立大鼠肝臟缺血再灌注損傷模型。 采用乙醚麻醉,取上腹正中切口,分離并暴露肝門部,無損傷血管夾鉗夾閉肝左、中門靜脈及肝動脈分支,造成70%的熱缺血,60min后松開血管鉗恢復血流即行再灌注,于再灌注4 h后抽取腹主動脈血標本。取左肝固定部位組織,大小適中,一塊置于-70℃冰箱保存,用于組織MDA、SOD的統一測定;另一塊用10%中性甲醛固定,用于組織形態學觀察和免疫組化染色。
1.5.1 分組 60只大鼠隨機分為假手術組、缺血再灌注組、依達拉奉組、參附注射液15 mL/kg組、參附注射液10 mL/kg和參附注射液5 mL/kg組,每組10只。假手術組:僅游離肝臟,不阻斷血流。IR組:行肝門阻斷。參附注射液組:在行缺血再灌注術前,每天腹腔注射15 mL/kg、10 mL/kg、5 mL/kg不同劑量的參附注射液,連續3天,第3天于術前30 min給藥。依達拉奉組和IR組大鼠同樣方法分別給予依達拉奉10 mL/kg及生理鹽水15 mL/kg,除假手術組(Sham)外,其它5組均與第3天手術,給藥期間常規喂養。
1.5.2 血清谷丙轉氨酶( ALT)、堿性磷酸酶( ALP)、總膽紅素( TBIL) 濃度測定 使用全自動生化分析儀測定不同時間點血清ALT、ALP及TBIL 濃度,作為肝缺血再灌注術后膽道損傷的標志。
1.5.3 膽管組織TNF-α、Fas的檢測 選用SP免疫組化試劑盒,TNF-α、Fas稀釋度均為1∶150,具體步驟按說明書操作,TNF-α、Fas主要表達于細胞漿,呈棕色。應用Laica圖像分析系統,光鏡放大400倍攝取圖像,輸入圖像分析系統。每張切片隨機選取5個區域,計算每張切片的平均光度,陽性單位。
1.5.4 肝組織SOD和MDA的測定 準確稱取冰凍肝臟組織100 mg,按說明書操作,手工勻漿制成10%的組織勻漿,低溫3000 r/min離心12 min上清液,采用化學比色法測定組織勻漿上清液SOD活性、MDA含量。
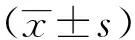
2 結果
2.1 血清酶學指標 與假手術組相比,缺血再灌注組的血清ALT、ALP、TBIL水平均顯著升高,表明造模成功;與缺血再灌注組比較,參附注射液15 mL/kg組、10 mL/kg、 5 mL/kg組和依達拉奉組可明顯減低血清ALT、ALP及TBIL的水平,參附注射液15 mL/kg組的ALT、ALP水平明顯下降,詳見表1。


組別劑量/mL/kgALT/IU/LALP/IU/LTBIL/μmol/L假手術組 50.41±2.88** 69.23±4.51**0.62±0.25**參附注射液51008.42±4.44*372.61±20.904.62±2.44參附注射液10 930.23±15.77**331.83±6.54**3.54±0.41**參附注射液15 880.41±11.51**316.24±9.31**3.21±0.15**依達拉奉組10 928.73±20.14** 339.52±16.14**3.13±0.28**
注:與缺血再灌注組比較,*P<0.05,**P<0.01。
2.2 SOD活力、MDA濃度水平 與假手術組比較,缺血再灌注組大鼠膽管組織中SOD活力明顯降低,MDA含量明顯升高;與缺血再灌注組比較,參附注射液15 mL/kg組、10 mL/kg組、5 mL/kg組和依達拉奉組大鼠膽管組織中SOD活力顯著升高, MDA含量顯著降低,表明參附注射液對膽管缺血再灌注損傷具有明顯的保護作用,詳見表2。


組別劑量/mL/kgSOD/U/mgMDAμmol/g假手術組160.11±4.28**1.52±0.35**缺血再灌注組79.42±10.175.04±0.90參附注射液590.33±13.41*4.58±1.16參附注射液10119.71±6.54** 2.92±2.51**參附注射液15125.32±6.71** 2.89±1.02**依達拉奉組10108.44±13.27** 3.14±0.60**
注:與缺血再灌注組比較,*P<0.05,**P<0.01。
2.3 組織病理學觀察
2.3.1 病理學觀察 光鏡下假手術組膽管上皮細胞形態正常,排列整齊,無炎細胞聚集;缺血再灌注組膽管可見上皮細胞明顯腫脹變性,有灶狀或片狀壞死脫落,大量中性粒細胞浸潤;參附注射液5 mL/kg組可見膽管上皮細胞水腫、灶狀壞死脫落雖較缺血再灌注組減輕,但上皮連續不完整,有較多中性粒細胞浸潤;參附注射液15 mL/kg組、10 mL/kg組和依達拉奉組病理改變明顯減輕,膽管上皮連續尚完整,僅見少量中性粒細胞浸潤。
2.3.2 膽管上皮細胞中TNF-α、Fas的表達 TNF-α、Fas主要表達于膽管上皮細胞胞漿中。假手術組膽管上皮細胞形態正常,細胞核藍染,背景染色淺,無明顯非特異性染色;缺血再灌注組膽管上皮細胞胞漿可見多量棕黃色粗顆粒,呈彌漫性分布;參附注射液5 mL/kg組可見一定量淡/棕黃色顆粒,散在分布;參附注射液15 mL/kg組、10 mL/kg組和依達拉奉組膽管上皮細胞胞漿可見少量淡黃色細顆粒,程度較其他組減輕,但比假手術組明顯,見圖1、表3。

表3 各組大鼠膽管組織TNF-α、Fas蛋白表達(OD值)
注:與缺血再灌注組比較,*P<0.05,**P<0.01。


3 討論
缺血再灌注損傷是移植肝膽管必然經歷的病理生理過程,肝動脈和膽道系統的完整性、通暢性與膽道并發癥的發生有著重要關系。肝動脈終末分支-膽管周圍毛細血管叢是肝內膽管唯一血供,長時間的缺氧會導致血管內皮細胞損傷、腫脹明顯,再灌注時導致血液再灌流減少;膽管上皮細胞極易活化,活化的膽管細胞可迅速產生釋放大量的毒性氧自由基,導致內源性抗氧化劑SOD、谷胱甘肽含量明顯減少[10],并分泌大量炎癥介質和肽類物質,如TNF-α、NO、IL-1等,促進中性粒細胞、血小板粘附聚集,加重毛細血管狹窄,阻塞血液灌流,引起膽管微循環障礙,又進一步加重血管內皮細胞和膽管上皮細胞的損傷,形成惡性循環,進而引起膽汁淤積、高膽紅素血癥,甚至移植肝功能喪失等后果。此外,游離的大鼠膽管上皮細胞在缺氧4 h,再灌注60或120 min后發現大量細胞凋亡[11],提示膽管上皮細胞凋亡也是缺血再灌注損傷的特征性改變。
TNF-α主要由激活的單核巨噬細胞系統分泌,參與免疫反應和炎癥反應。在缺血再灌注過程中,TNF-α濃度迅速增加,并表現出比其他細胞因子更高的靈敏度,因此TNF-α表達水平可反映機體損傷程度,被視為炎癥指標;在TNF-α的刺激下,細胞粘附分子(ICAM-1)表達增高,促進白細胞和血管內皮細胞的粘附,加重動脈粥樣硬化的進程[12]。
TNF-α和Fas還是細胞凋亡過程中關鍵性的因子,TNF-α與其受體TNF-R1結合、Fas與其配體Fas L結合后,生成相關的死亡結構域簇集TRADD 、FADD,與Caspase-8前體N末端的死亡效應域相作用,激活Caspase-8,啟動Caspase蛋白酶級聯反應誘導細胞凋亡發生。Chen等[13]肝缺血再灌注損傷研究中發現參附注射液通過下調TNF-α,從而減少肝實質細胞凋亡。Kumar A等[14]在甲亢誘導大鼠肝細胞凋亡的研究中也證實,TNF-α和Fas水平明顯升高,且TNF-α可上調Fas表達。本實驗結果顯示,與缺血再灌注組比較,參附注射液5 mL/kg組、參附注射液10 mL/kg和參附注射液15 mL/kg組膽管上皮細胞TNF-α、Fas表達量和表達強度明顯減弱;參附注射液15 mL/kg組肝門部膽管上皮細胞中TNF-α、Fas陽性表達率分別為24.8%、22.4%,較同一時相缺血再灌注組(36.7%、32.6%)明顯下降(P<0.05);匯管區膽管上皮細胞中TNF-α、Fas的陽性表達率,參附注射液15 mL/kg組分別是20.1%、17.3%,較缺血再灌注組(31.2%、25.9%)也明顯減少(P<0.01)。Zhu等[15]的研究表明參附注射液能顯著誘導血管內皮依賴性舒張,有效保護血管內皮細胞。Yan等[16]在大鼠心衰模型研究中發現參附注射液可降低心衰細胞的陽性率,抑制Caspase-3的表達和細胞凋亡。由此可以推測,參附注射液可改善微循環,并通過干預調節TNF-α、Fas/FasL死亡信號通路而抗膽管上皮細胞的凋亡,發揮膽道保護作用。
丙二醛(MDA)是脂質過氧化反應的終產物,當組織抗氧化劑耗盡時,會引起細胞損傷及細胞膜的破裂;超氧化物歧化酶(SOD)是一種金屬酶,能催化O2-到O2和H2O2的歧化,直接滅活氧自由基,抑制白細胞的粘附和Na+內流,修復組織損傷。本實驗中,缺血再灌注組大鼠血清ALT、ALP及TBIL持續升高,血漿SOD活力明顯減弱,MDA含量顯著增高;應用不同劑量的參附注射液處理后,ALT、ALP及TBIL顯著降低,血漿SOD活力增強,MDA含量明顯下降,均較缺血再灌注組明顯改善。研究表明,參附注射液能穩定細胞膜,減少心肌酶的釋放,保護缺血的心肌細胞;還可滅活黃嘌呤氧化酶,清除氧自由基,抑制細胞脂質過氧化反應,通過抑制NF-κB活性,降低肝臟Kupffer 細胞激活,減少TNF-α、IL-1等促炎因子的釋放,保護肝細胞的活性[17-20]。實驗中,我們還發現參附注射液15 mL/kg組、10 mL/kg組效果尤為明顯(P<0.01),并呈現劑量依賴關系,提示參附注射液可干預調節炎癥反應,降低膽管細胞氧耗,加速自由基的排泄,減輕脂質過氧化損傷,在維護機體氧化與抗氧化之間的平衡方面作用顯著。
綜上所述,參附注射液可以通過抑制TNF-a/TNF-R1→Fas/ Fas-L死亡信號轉導途徑,減輕膽管上皮細胞的凋亡,從而有效保護膽管功能,減輕肝移植缺血再灌注后膽道并發癥的發生,為臨床治療提供一條可行性思路。

