堿性成纖維細胞因子對SD大鼠表皮干細胞分化為神經干細胞的影響
許正偉,賀寶榮,劉團江,郭華,郝定均
中樞神經系統損傷會導致神經元的壞死或變性,這些受損的神經元由于無法再生和修復,會給病人留下偏癱或者截癱的嚴重生理后遺癥,為病人家庭和社會帶來了沉重的負擔。神經干細胞因其獨特的優勢,在神經系統損傷性疾病的基因或細胞治療中具有廣闊的臨床應用前景。作為來源于皮膚的表皮干細胞,由于其材料來源豐富且獲取方便,合適培養體系下在體外還能夠實現快速增殖、長期存活且與機體具有良好的相容性,亦不存在違反倫理道德的問題,成為治療神經系統疾病的優良材料[1]。
堿性成纖維細胞生長因子(basic fibroblast growth factor,bFGF)是一種廣譜的微量活性蛋白[2],具有廣泛的生物學作用,在皮膚創傷治療、神經組織的發育和血管的形成受損以及組織的修復與再生過程中具有十分重要的作用[3]。bFGF作為一種能夠促進有絲分裂活性的蛋白,可誘導神經分化[3],對神經元具有促進增殖的活性[4]。此外,bFGF對于表皮創傷的愈合以及上皮的形成也具有重要調節作用[5]。研究表明,bFGF可以促進表皮細胞的多向分化,在創傷面的修復過程中促進“層次性”分化[6]。那么,bFGF是否也影響了表皮干細胞向神經細胞分化的行為過程?為此,本研究自2015年11月至2016年11月分離、培養獲得SD大鼠背部表皮干細胞,在不同密度的表皮干細胞實驗組中加入bFGF作為誘導劑,通過觀察細胞分化的形態、數目變化以及免疫組化鑒定,探究bFGF對表皮干細胞向神經細胞分化的影響作用。
1 資料與方法
1.1實驗動物與材料出生后生長1~3 d的清潔級SD大鼠10只,雌雄不限[源自西安交通大學實驗動物中心,許可證號:SYXK(陜)2015-002]。本研究中對于大鼠的處理符合動物倫理學標準。
K-FSM培養基、大鼠來源Ⅳ型膠原、胰酶(0.25%)、中性蛋白酶(0.15%)大豆蛋白和堿性成纖維細胞生長因子(bFGF)購自GIBCO公司; Nestin抗體(兔抗大鼠,多抗)和NSE抗體(兔抗大鼠,多抗)購自Abcam公司;HE染色試劑盒和PBS緩沖液購自北京索萊寶科技有限公司;D-hank′s緩沖液(Hyclone)購自成都君海生物科技有限公司。
1.2表皮干細胞的分離、培養與鑒定實驗前,將所需要的器械進行消毒處理,整個操作在無菌環境中進行。取出生3 d的SD大鼠,頸椎脫臼處死后取背部含毛囊皮膚,先后用含雙抗的D-Hank′s液和不含有雙抗的D-Hank′s液洗滌3遍,清洗后的組織再置于含有中性蛋白酶(0.15%)的消化液中于8 ℃的環境下過夜處理。第2天分離得到含毛囊皮膚的表皮,切碎后用0.25%的胰酶消化處理。10 min后加入等體積的大豆蛋白液(0.25%)終止消化。300目過濾、離心、棄上清,再懸浮于K-SFM培養基中洗滌一次重新懸浮。細胞計數,密度調成0.5×107/mL,再向六孔板(Ⅳ型膠原8 ℃過夜處理)沒空中個加入2 mL細胞懸浮液,37 ℃培養10 min。吸出培養液,用D-Hank′s液輕柔洗滌3次,再每孔加入2 mL K-SFM培養基,置于培養箱(37 ℃,5% CO2)中培養。
在倒置顯微鏡下,200倍視野下每日觀察細胞形態和數目變化。行常規HE染色,鑒定表皮細胞。
1.3bFGF對不同密度表皮干細胞的誘導以表皮干細胞的密度不同共分為4組,密度分別為0.1×107/mL、0.3×107/mL、0.5×107/mL、0.1×106/mL。每個濃度設置3個重復(3個六孔板),每孔中分別加入2 mL對應密度的細胞懸液。然后將培養板置于37 ℃的環境中溫育10 min,立即移除培養液,再用D-Hank′s液輕柔洗滌3遍。每孔中再加入2 mL含有bFGF(20 ng/mL)[6]的K-SFM培養基,于培養箱(37 ℃,5% CO2)中培養。
1.4誘導后細胞形態數目的變化統計4組不同濃度的表皮干細胞,各組每天隨機取6個孔在倒置顯微鏡下觀察細胞形態的變化,利用分割法計算視野內形態發生變化的細胞數量,并計算平均值。
1.5細胞免疫組織化學法鑒定待細胞培養到一周,且細胞融合達到80%后,取出蓋玻片,各組細胞行常規細胞免疫組織化學法鑒定,其中Nestin抗體最佳濃度為1∶250,NSE抗體最佳使用濃度為1∶500,每組實驗設置3個重復。
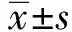
2 結果
2.1表皮干細胞的分離、培養與鑒定K-SFM培養基環境下,24 h內大多數細胞出現向四周伸展生長的現象,細胞多呈圓形或者多角形,但未發生形變,且均勻分布,貼壁細胞少(圖1A)。在第3~4天,大部分細胞開始呈現克隆樣生長、變大,約在第5天細胞出現80%融合,細胞形態變大且清晰,呈現長圓形,胞核較大,核質比例大,視野內細胞成“鋪路石樣”形態(圖1B)。HE染色,細胞呈橢圓形或多角形,細胞著色均勻,細胞質染成紅色,細胞核為藍色;細胞密度較大,整體呈現“鋪路石樣”形態(圖1C)。

注:A為表皮干細胞生長24 h時的形態(×400);B為表皮干細胞生長5 d時的形態(×200);C為HE染色鑒定(×400)
圖1K-SFM培養基培養的表皮干細胞形態觀察
2.2誘導后細胞形態變化bFGF誘導后,0.3×107/mL組(圖2A)和0.1×107/mL組(圖2B)的表皮干細胞形態發生很大變化。在第3天即可以看到細胞開始發生伸展性生長,呈多角形或短棒狀形態,且分布較均勻。在第7天左右,可以觀察到細胞生長均勻,大小一致,體積小,且呈克隆生長,細胞形態大部分呈多角形或者橢圓形,形態發生雙極或多級改變的細胞數目隨著培養時間逐漸增多,呈神經細胞形態,且細胞分布均勻。0.5×107/mL組在第3天時,形態發生雙極或多極變化的表皮干細胞數量出現高峰,然后逐漸減少直到消失;0.1×106/mL組的表皮干細胞一直未出現形態改變的現象,也未發現細胞進行了伸展生長。

注:A為0.1×107/mL組;B為0.3×107/mL組
圖2bFGF誘導后細胞形態變化(×200)
2.3誘導后細胞形態數目的變化加入bFGF誘導后,每天觀察表皮干細胞發生形態變化的細胞數量,持續觀察1周。結果顯示,在bFGF誘導作用下,0.1×107/mL組和0.3×107/mL組的表皮干細胞發生雙極或多極形態改變的細胞數量增多,且隨著培養時間的延長而增多;0.5×107/mL組表皮干細胞在第3天時,發生雙極或多極形態變化的細胞數量達到最大值,然后逐漸減少直至消失。0.1×106/mL組表皮干細胞未發現有形態改變的現象(圖3)。
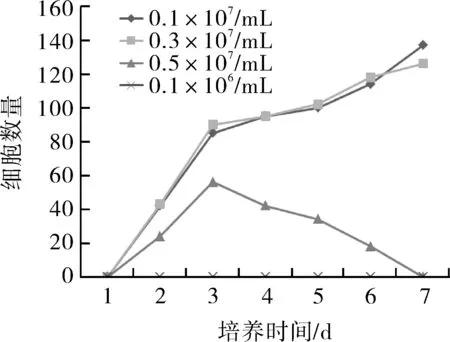
圖3 bFGF誘導后不同密度表皮干細胞形態變化趨勢
2.4細胞免疫組織化學法鑒定bFGF誘導后,表皮干細胞發生向神經細胞分化現象,細胞體積變大,部分細胞的形態呈現出梭形,另有部分細胞形態出現雙極或多極化形態變化,而巢蛋白(Nestin)染色細胞質呈顯棕黃色,神經元特異性烯醇化酶(NSE)染色細胞質呈顯棕黃色,兩種標志物的免疫組化染色結果均呈陽性(圖4)。
圖4 細胞免疫組織化學鑒定Nestin和NSE顯陽性(×200)
3 討論
皮膚干細胞是一類具有高度增殖、多向分化潛能,且自我更新能力和修復能力強的一種成體干細胞,也是目前研究比較多的一類成體干細胞[7]。目前,對于皮膚干細胞的定位、種類和數量的研究并不明確,在已發現的6種皮膚干細胞中,有表皮干細胞(Epidermal Stem Cells,ESCs)和毛囊干細胞(Follilar Stem Cells,FSCs)的研究報道相對較多[8-9]。普遍認為表皮干細胞主要存在于表皮基底層和毛囊隆突區這兩個生理區域,本研究中,我們取SD大鼠背部含毛囊皮膚,利用快速貼壁法[10],成功消化、分離得到表皮細胞,這些細胞胞核較大,核質比例大,且在培養中有大量克隆形成。表皮干細胞在維持上皮的再生與平衡方面起著重要作用,在損傷皮膚的修復與治療、腫瘤和炎癥反應中都具有巨大的臨床應用價值[11-12]。而表皮干細胞能夠誘導分化形成神經細胞的研究,也可能為治療中樞神經系統損傷疾病帶來福音。代學良等[13]通過慢病毒介導Ngn2基因轉染SD大鼠皮膚源性前體細胞,成功制備出再程序化的皮膚來源神經干細胞。Hu等[14]將表皮干細胞移植入挫傷脊髓神經,結果顯示植入的表皮干細胞有助于促進感覺神經的連接和觸覺神經的修復。對于表皮干細胞向神經系分化所涉及到的信號通路和關鍵因子,已成為當前的研究熱門。
bFGF是構成成纖維細胞生長因子(fibroblast growth factor,FGF)家族的主要成單元之一[15-16],廣泛分布于人體組織中,是一種廣譜的微量活性蛋白[2]。bFGF具有廣泛的生物學作用,其靶細胞有神經元、成纖維細胞、內皮細胞和表皮細胞等,在皮膚創傷治療、神經組織的發育和血管的形成受損以及組織的修復與再生過程中具有十分重要的作用[3,17]。bFGF誘導所涉及的信號途徑是絕大多數正常細胞發育所必須的,目前的研究表明,bFGF與受體結合后主要是通過四種信號通路發揮作用,蛋白激酶C途徑(PKC),Ras/Raf/MEK/ERK途徑,蛋白酪氨酸激酶/信號轉導子及轉錄激活子途徑(JAK/STAT)和磷脂酰肌醇-3-激酶途徑(PI3K)[18-19]。bFGF作為一種能夠促進有絲分裂活性的蛋白,可誘導神經分化[3],對神經元具有促進增殖的活性[4]。Yang等[20]的研究發現bFGF能夠顯著促進人類的胚胎干細胞分化形成多巴胺能神經元。Duobles等[21]發現大鼠坐骨神經損壞后,鈣離子結合蛋白(S100beta)能夠通過促進受損傷神經周邊的細胞大量分泌bFGF,從而達到自我修復受損神經的目的。此外,bFGF對于表皮創傷的愈合以及上皮的形成也具有重要調節作用[5]。研究表明,bFGF可以促進表皮細胞的多向分化,在創傷面的修復過程中能夠促進“層次性”分化[6]。同時,有研究認為,bFGF的作用存在濃度決定作用效果的情況,較低濃度的bFGF有利于骨髓間充質干細胞向神經前體細胞的分化。本研究中,bFGF的濃度為20 ng/mL時,有助于表皮干細胞向神經細胞的分化[22],在第3天即可以看到細胞開始發生伸展性生長,細胞呈雙極或多極形態改變。
本研究中,我們選取新生SD大鼠作為實驗材料,取其背部含毛囊皮膚,利用快速貼壁法成功消化、分離得到表皮細胞。在濃度為20 ng/mL的bFGF誘導下,0.3×107/mL組和0.1×107/mL組的表皮干細胞形態發生很大變化,在第3天即可以看到細胞開始發生伸展性生長,在第7天左右,可以觀察到細胞生長均勻,細胞形態基本一致,體積小且呈克隆生長,而且細胞形態大多呈多角形或者橢圓形,形態發生雙極或多級改變的細胞數目隨著培養時間逐漸增多,呈神經細胞形態,且細胞分布均勻。這初步說明,在bFGF的誘導下,表皮干細胞開始向神經細胞發生分化。通過調節表皮干細胞的密度進行誘導實驗發現,0.1×107/mL組和0.3×107/mL組的表皮干細胞發生雙極或多極形態變化的細胞數量隨著培養時間的延長而增多。NSE[23]和Nestin[24]作為神經元樣細胞的生物標志物已經被廣泛的研究和應用。本研究中,0.1×107/mL組和0.3×107/mL組實驗細胞免疫組織化學鑒定結果顯示NSE和Nestin顯陽性,初步分析為神經元樣細胞。細胞密度改變所引起的分化異同,可能是由于細胞接觸距離的不同導致0.1×107/mL組和0.3×107/mL組細胞啟動了與表皮干細胞的分化相關的Notch信號轉導通路,進而導致激發了表皮干細胞的定向分化潛能,發生向神經細胞分化的現象。
作為來源于哺乳動物皮膚的表皮干細胞,由于其材料來源豐富且獲取方便,合適培養體系下在體外還能夠實現快速增殖、長期存活且與機體具有良好的相容性,亦不存在違反倫理道德的問題,因此為神經系統疾病的細胞和基因治療帶來了新的希望。本研究結果顯示,在SD大鼠中bFGF能夠促進表皮干細胞分化為神經細胞,這為后續解析SD大鼠表皮干細胞向神經細胞分化的機制提供了一定的理論參考。

