miR-21降解PTEN影響香煙提取物誘導的PASMCs的增殖與遷移
金光軍 周冰之 張建成
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)發病過程中會伴隨血管痙攣、肺血管重塑及肺血栓等癥狀,從而導致肺血管阻力加強產生肺動脈高壓(pulmonary artery hypertension,PAH)[1]。研究表明,在PAH的發病過程中,肺血管內皮細胞、平滑肌細胞的過度增殖引起的血管重塑是肺動脈高壓疾病發病的重要緣由[2]。
近年來研究表明吸煙可導致肺血管重構,其主要機制可能是吸煙產生的煙霧促使人的肺動脈平滑肌細胞(human pulmonary artery smooth muscle cells,HPASMCs)的狀態發生改變后產生異樣增殖并向內膜遷移[3~5]。微小RNA (microRNA,miRNA)是一種非編碼RNA約為22~28個核苷酸長,在真核生物中廣泛存在[6]。miRNA的異常表達與平滑肌的生理狀態及PAH有著緊密的關聯[7~9]。已有研究發現,miRNA-21可通過負調控PTEN(gene of phosphate and tension homology deleted on chromsome ten)的表達量,影響PASMCs的增殖和凋亡[10]。PTEN作為抑癌基因,可以使磷脂酰肌醇(3,4,5)-三磷酸[phosphatidylinositol(3,4,5)-t risphosphate, PIP3]去磷酸化來抑制PI3K/AKT 通路[11~14]。筆者初步研究發現,香煙提取物(cigarette smoke extract,CSE)誘導PASMCs的增殖和遷移增加,miR-21表達增加,抑制miR-21表達能抑制香煙提取物誘導的PASMCs增殖和遷移。本研究通過過表達和敲降miR-21看其在CSE誘導的PASMCs 是否通過影響PTEN/PI3K/AKT通路而影響了PASMCs 細胞的增殖,遷移的能力。
材料與方法
1.材料:健康SD大鼠,體質量200±20g;武漢卷煙廠生產紅雙喜牌過濾嘴香煙,每支含尼古丁 1.0mg、焦油15mg;DMEM美國購于Hyclone公司;胎牛血清(fetal bovine serum,FBS) Lipofectamine 2000轉染試劑、Trizol、 Opti-MEM 培養基均來自美國 Invitrogen 公司;All-in-OneTMmiRNAQ- PCR Detection Kit購于上海伯易生物有限公司;miR-21引物和U6 siRNA 引物由上海生工公司合成;α-平滑肌肌動蛋白(α-SMA)單克隆抗體、PCNA、Bcl-2、AKT、P-AKT、PTEN、caspase-3以及β-actin單克隆抗體購自美國Santa Cruz 公司;四甲基偶氮唑鹽(MTT)粉末來自美國Sigma公司;Transwell小室購于美國 Costar 公司。
2.分離原代鼠肺動脈平滑肌細胞培養及鑒定:參照文獻[15]并稍做修改,超凈臺內用纖維器械在無菌PBS中將肺動脈3 級以下的分支取下,取下后刮除血管內外膜,放入含有膠原酶Ⅰ的離心管中進行消化,在CO2培養箱中消化2~4h,分離得到PASMCs。消化所得細胞用含10%FBS的DMEM培養液,置于37℃、CO2含量5%的培養箱中培養,并對所得細胞進行細胞形態學和α-SMA IF及免疫細胞化學(1∶1000)進行鑒定。原代培養到3~6代的PASMCs可用于實驗。
3.CSE 制備及干預:CSE制備參照文獻[16]并做適當修改。將去除過濾嘴的香煙點燃,負壓將煙霧吸入到含有DMEM培養基的封閉的玻璃瓶,輕輕晃動它解散,用氫氧化鈉將溶液pH值調至7.4,經 0.22μm微孔濾膜過濾得到 100%的 CSE原液。CSE原液用完全培養基稀釋成10%用于后續實驗。
4.miRNA轉染PASMCs:將miR-NC、miR-21、anti-miR-NC、anti-miR-21干粉離心后用125μl RNase-free H2O 配制成20μmol/L的儲存液。轉染步驟如下:接種2×105細胞到24孔板中,用無雙抗培養基培養過夜后,棄原培養液,PBS清洗兩邊后換成400μl在37℃ 溫育的opti-MEM培養基。 準備A、B兩個EP管,A管中加入47.5μl opti-MEM后加25μl濃度為20μmol/L的miR-21,B管中將2μl 轉染試劑(Lipo2000)加入到48μl轉染培養基optiMEM,A、B管輕輕混合后室溫孵育5 min;將B管液體加入到A管中輕輕混勻室溫放置20min后,將混合液加入24孔板,充分混合;37℃,培養6h;加入1ml正常生長液含雙倍血清,不移除轉染混合物孵育24h;換成正常培養基培養24h后分別提取RNA和蛋白進行檢測。
5.Real-time PCR檢測miRNA-21表達:Trizol提取4組實驗細胞總RNA,加入等體積的異丙醇沉淀RNA,DEPC水溶解后,測定RNA 的純度,測定后取部分RNA跑瓊脂糖凝聚電泳進行質檢。取2μl總RNA,應用All-in-OneTMmiRNAQ- PCR Detection Kit進行RT- PCR 檢測,每樣品測3 次,實時定量檢測。miRNA-21引物序列為:5′-TAGCTTATCAGACTGATGTTGAAAA-3′。Real-time分析采用2-△△CT方法。
6.Western blot法檢測相關蛋白的表達量變化:取對數生長期的PASMCs懸液接種在6孔板,進行實驗干預后提取總蛋白。用BCA法進行蛋白定量,定量后跑膠,轉膜。轉完膜后室溫用TBST配制5%BSA 封閉將膜放入其中搖床封閉1h,一抗4℃搖床孵育過夜。次日,回收一抗,TBST溶液洗滌3次,每次5min,室溫二抗搖床孵育1h,二抗回收后再次用TBST溶液洗3次,洗完后膜用Odyssey掃膜儀掃膜,保存結果用軟件進行灰度分析。
7.MTT檢測細胞增殖:胰酶消化轉染4組miRNA后的細胞,終止后離心收集,制成細胞懸液,調整細胞濃度為1×104/孔,輕輕混勻,加入到96孔板中,在相應刺激下培養48h后, 拿出96孔板,每孔加用無酚紅培養基配制的MTT 10μl(5mg/ml,即0.5%MTT)。在37℃孵育4h,將150μl二甲基亞砜溶液加入到各孔。孵育15min。微孔板每孔吸光度在570nm,空白為0。
8.劃痕實驗檢測PASMCs的遷移能力:先在6孔板背后劃線,然后分別消化轉染4種miRNA的細胞,并以5×105個細胞數量加入到6孔板中,當細胞融合到約90%時,單層培養細胞沿培養基的底部放置,并用滴管槍頭作為0h的時間點,在顯微鏡下記錄劃痕區域的寬度。除去培養液,用含10%CSE的10%胎牛血清培養基在劃痕后繼續培養至24h。利用Image J 軟件統計計算,并記錄。
9.Transwell實驗檢測PASMCs的遷移能力:制備處于生長對數期的原代細胞懸液,24孔板中每孔加0.5ml,對細胞進行轉染,轉染后將4組細胞用胰酶消化后細胞計數板計數,用只含10%CSE的DMEM培養液重懸并將細胞濃度調整為2×108/L,上室每孔加0.1ml制備好的的細胞懸液,下室每孔中加0.5ml完全培養液。10%CSE刺激24h后,用甲醛固定30min后風干,將細胞用0.1%結晶紫染色20min,棉簽輕輕擦去小室上層細胞后,400倍顯微鏡下隨機挑選5個視野進行統計分析計算細胞數量。
結 果
1.RT-PCR 檢測 miR-21 mRNA 表達:如圖1所示,過表達miR-21組的miR-21含量明顯高于轉染miR-NC組(P=0.000)。而轉染anti-miR-21組miR-21的表達量明顯低于轉染anti-miR-NC組(P=0.000)。
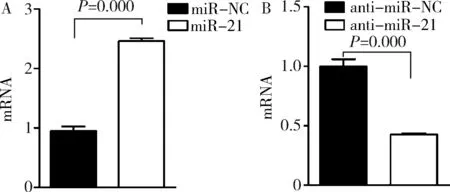
圖1 RT-PCR檢測miR-21 mRNA結果A.過表達miR-21;B.敲降miR-21
2.Western blot法檢測miR-21對CSE誘導的PASMCs中PTEN/PI3K/AKT 信號轉導通路的影響:如圖2所示,10%CSE 處理后轉染miR-21和轉染miR-NC的PASMCs相比,PTEN蛋白表達量下降,從而P-AKT顯著上升,同時與增殖相關的PCNA及Bcl-2的表達量增加,而凋亡相關蛋白caspase-3的表達量下降。而轉染anti-miR-21組與轉染anti-miR-NC組相比,PTEN表達量上升,P-AKT顯著下降,從而使PCNA和Bcl-2的表達量下降而caspase-3表達量上升。
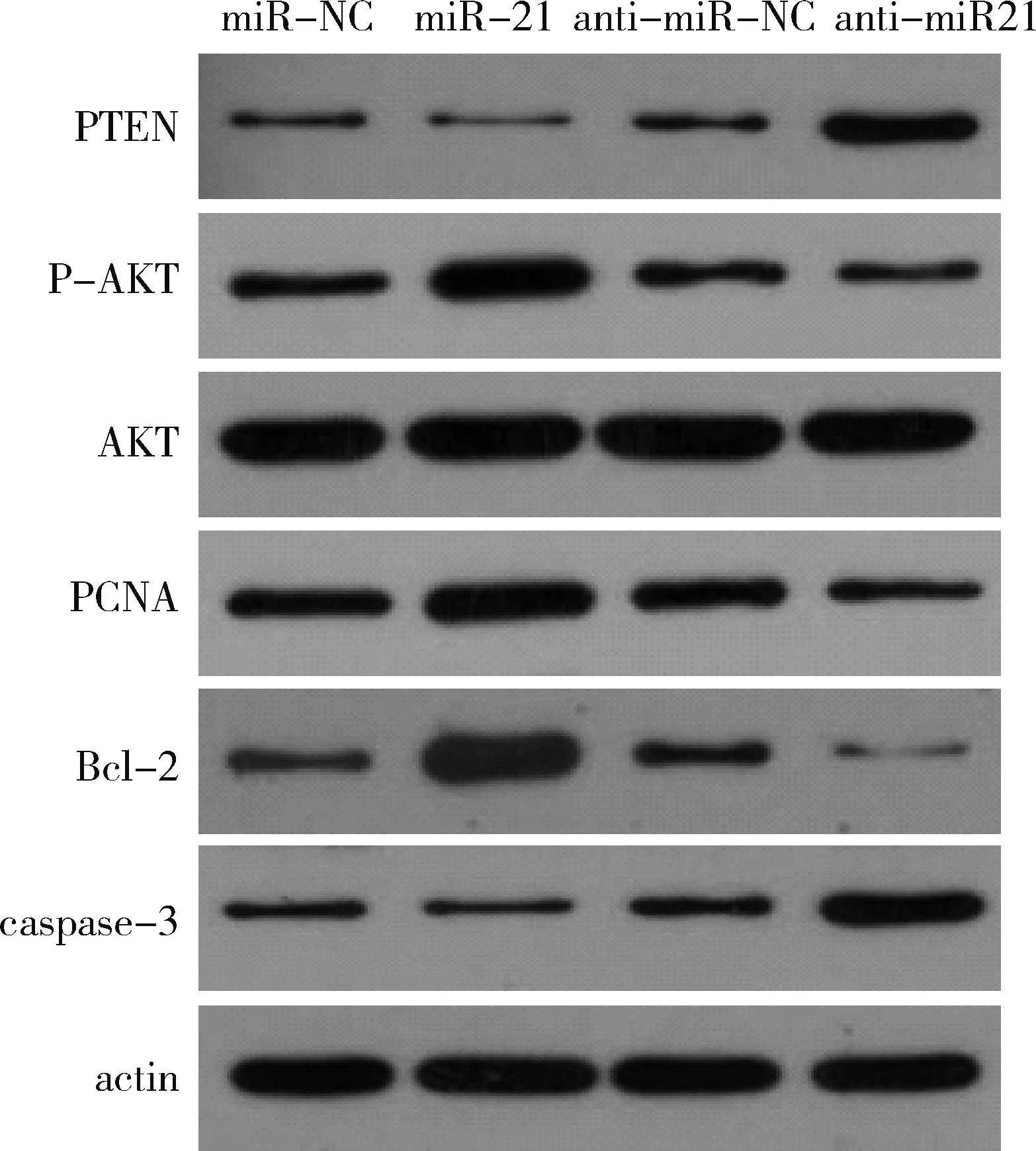
圖2 miR-21對CSE 誘導的PASMCs 中PTEN/PI3K/AKT信號轉導通路中蛋白表達量的影響
3.miR-21對 CSE 誘導的細胞增殖的影響:如圖3所示,與對照組比較,轉染miR-21后MTT檢測A值升高(P<0.01),而轉染anti-miR-21組與對照組比較,MTT檢測A值降低(P<0.01)。
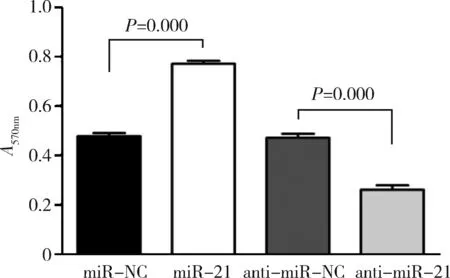
圖3 miR-21對 CSE 誘導的細胞增殖的影響
4.miR-21對 CSE 誘導的細胞遷移的影響:如圖4所示,轉染了miR-21的細胞經24h培養后其劃痕愈合速度較快,劃痕愈合情況明顯優于miR-NC組(P<0.01), 而轉染了anti-miR-21組的細胞劃痕愈合速度較轉染anti-miR-NC 組相比較慢(P<0.01)。圖5可見miR-21 轉染組的細胞穿膜數量明顯多于 miR-NC組(P<0.05),而轉染anti-miR-21組的細胞穿膜數量明顯少于anti-miR-NC組(P<0.05)。
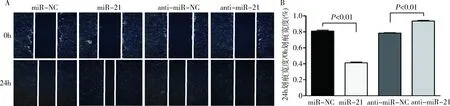
圖4 細胞劃痕實驗結果A.細胞劃痕實驗照片(×200);B.細胞劃痕實驗量化圖
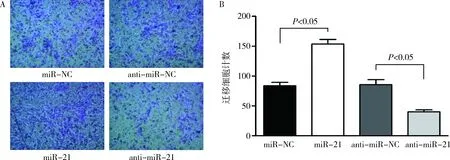
圖5 transwell實驗結果A.轉染miR-21/miR-NC和轉染anti-miR-21/anti-miR-NC 細胞培養36h后transwell小室下層細胞結晶紫染色觀察(×200);B.Transwell 實驗量化圖
討 論
COPD在發病的過程中,往往伴隨著并發癥PAH,而PAH形成的病理學基礎是血管重構。PASMCs的異常增殖、分化和遷移在肺血管重構中發揮著重要作用[17]。各種相關因子的平衡失調導致PASMCs的異常增殖或遷移,最終導致肺血管中層增厚,管腔狹窄或閉塞,形成PAH[18,19]。Wright 等報道,長期暴露于香煙煙霧的豚鼠出現肺動脈管壁增厚現象,PASMCs增殖并向內膜遷移,肺小動脈的肌化是造成肺血管結構改變的重要機制[20]。microRNA作為一種非編碼RNA,其作用是通過堿基互補配對的原則和mRNA的3′UTR區域發生不同程度的互補結合,從而使目標mRNA翻譯受抑制或降解,進而影響細胞的生物學功能。研究發現,miRNA在受傷的血管平滑肌中上調,參與了血管重構的過程。而在目前miRNA的研究過程中,關于miR-21的研究較多,大量實驗證實miR-21是唯一一個幾乎在所有實體癌(甲狀腺乳頭狀癌、結腸癌細胞、肝癌細胞等)中過表達的miRNA[21~23]。
實驗表明,在血管損傷導致的再狹窄中miRNA-21異常高表達,同時,有研究發現miRNA-21可通過對PTEN的負調控來提高PASMCs的增殖能力并抑制其凋亡。同時在頸動脈損傷中miR-21上調,導致PETN表達下降,促進了PASMCs的增殖[12]。2011年,美國學者認為miR-21與PTEN的mRNA的3′-UTR存在的結合位點[22]。在結腸癌患者中,miR-21與PTEN結合后使PTEN的表達量改變而影響細胞的增殖遷移。PTEN作為一種抑癌基因參與并影響了PI3K磷脂酰肌醇-3激酶(phosphatidylinositol-3′kinase,PI3K)/AKT(又稱protein kinase B,PKB)信號通路的活化。PTEN與PI3K的產物PIP3結合從而去磷酸化PIP3,使PIP3處于低活化狀態從而抑制AKT的活化,來降低PI3K/AKT信路通路活化水平。該通路被稱為PTEN/PI3K/AKT 信號轉導通路[24,25]。該通路不只和腫瘤的發生、發展有著緊密的聯系,同時很大程度的影響了PASMCs的增殖遷移。在PASMCs中,香煙提取物致使PTEN 失活從而活化PI3K/AKT通路,活化的AKT可以促使眾多蛋白發生磷酸化修飾,從而促進細胞的增殖,遷移侵襲,抑制凋亡。因此筆者推測miR-21能通過負調控PTEN而活化PI3K/AKT通路促進PASMCs的增殖遷移從而參與PAH的形成。
本研究用通過在PASMCs中成功過表達和敲降miR-21并用10%CSE處理后通過WB檢驗發現在過表達miR-21后,PTEN蛋白含量減少,使AKT的磷酸化水平提高,而提高了增殖相關蛋白PCNA的表達量和Bcl-2的蛋白含量,而凋亡相關蛋白caspase-3的表達量明顯下降。而在轉染anti-miR-21后,與轉染anti-miR-NC比較,PTEN蛋白表達量上升從抑制了AKT的磷酸化導致了PCNA和Bcl-2的表達量下降,而使caspase-3的表達量有所提升。同時,過表達miR-21組細胞的MMT值明顯上升,細胞的增殖速度加快,遷移能力增強。而敲降miR-21后MMT值比對照組下降,細胞的增殖速度變慢,遷移能力減弱。
綜上所述,在CSE刺激的PASMCs中,miR-21可以通過負向調控PTEN的表達量從而使PI3K/AKT通路活化,正向調控了香煙煙霧誘導的PASMCs的增殖和遷移。本研究為闡明吸煙致肺動脈高壓的機制, 尋找新的治療手段提供了實驗依據。

