基于“逆流挽舟”法探索人參敗毒散對潰瘍性結腸炎模型大鼠胃腸功能的影響及作用機制*
陳 嵐,賈 波,鄧懷涵,賈志超,李 純
成都中醫藥大學(成都610075)
潰瘍性結腸炎(Ulcerative colitis,UC)是一種病因尚不明確的直腸結腸慢性非特異性炎癥性疾病,屬于炎癥性腸病中的一種。主要局限于大腸黏膜及黏膜下層,以腹痛、腹瀉、黏液樣膿血便、里急后重等為主要癥狀[1]。潰瘍性結腸炎具有病程長、遷延難愈、復發率高等特點,存在一定癌變風險,治療難度大,被世界衛生組織列為現代難治病之一[2]。現代醫學治療本病多采用氨基水楊酸類、糖皮質激素類和免疫抑制劑等藥物,必要時采取手術,但總體療效不如意[3]。近年文獻報道,腸黏膜屏障功能損傷被認為是潰瘍性結腸炎發病機制中的主要因素,成為關注焦點[4]。腸黏膜緊密連接蛋白維持腸黏膜屏障的結構和功能,緊密連接蛋白參與內皮細胞遷移、維持血管功能以及調控細胞間通透性,在UC發病機制中起重要作用。中醫雖UC病名,就其臨床特點而言,歸屬于中醫學“痢疾”、“泄瀉”等范疇[5],清·喻嘉言首創“逆流挽舟”之名,將此法明確為治痢大法,推崇人參敗毒散為“逆流挽舟”法代表方。人參敗毒散具有升陽舉陷、勝濕止瀉、扶正祛邪之功效。因此本實驗擬通過對UC大鼠胃腸功能指標及腸黏膜緊密連接蛋白表達,探討人參敗毒散對潰瘍性結腸炎的作用機制。
材料與方法
1 動 物 SPF級健康雄性SD大鼠60只,體重(200±20)g,購于成都達碩動物實驗有限公司,合格證號SCXK(川)2015-030。飼養于成都中醫藥大學基礎醫學院實驗北樓實驗室動物房。
2 藥物及試劑 人參敗毒散(據明《奇效良方》按現代劑量換算為柴胡12 g,川芎9 g,前胡、甘草、人參、桔梗、羌活、獨活、茯苓、枳殼各6 g,薄荷、生姜各3 g,共75 g),均購于成都中醫藥大學附屬醫院中藥房,為四川新荷花中藥飲片股份有限公司產品。TNBS(美國Thermo Fisher公司,貨號28997 批號SC246522),無水乙醇(成都市科龍化工有限公司,批號20160607),水合氯醛(成都市科龍化工有限公司,批號20170316),柳氮磺胺吡啶(SASP批號09170313,上海信誼天平藥業有限公司),連接黏附分子(JAM)抗體(美國Abcam公司,貨號ab180821),GAPDH(美國Abcam公司,貨號ab181602)。營養性半固體糊備制:參考文獻[6],羧甲基纖維素鈉10 g,溶于250 ml 蒸餾水中,全溶解后,加入奶粉16 g,淀粉8 g,蔗糖8 g和活性炭粉末2 g,攪拌均勻,配制成1 ml/g的黑色半固體糊狀物,冰箱冷藏備用,使用時恒溫水浴鍋溫至常溫。
3 儀 器 PPT-A+100型電子天平(美國康州HZ電子科技有限公司),BA400 Digital型數碼三目攝像顯微鏡(麥克奧迪實業集團有限公司),AC8型洗板機(美國ThermoLabsystems公司),GNP-9080型恒溫培養箱(上海精宏實驗設備有限公司),移液器(吉爾森P型移液器公司),ABI-7300型Real-time檢測儀(英國ABI公司),K30型旋渦振蕩器(青浦瀘西儀器廠),PRO200型電動勻漿機(德國FLUKO公司),Tanon-5200型成像系統(上海天能科技有限公司)。
4 方 法
4.1 造模方法:參照Morris等[7]方法制作TNBS誘導的UC 大鼠模型。大鼠造模前禁食不禁水24 h,用10%水合氯醛0. 2 ml/100g 腹腔注射麻醉,用內徑1.5 mm無菌灌腸硅膠管輕輕從大鼠肛門插入6~8 cm,推入TNBS溶液(100 mg/kgTNBS+50%乙醇0.25 ml),捏緊肛門,提尾倒立3~5 min后,放回籠中自然蘇醒,常規飼養。正常組大鼠用相同體積的0.9% 氯化鈉注射液灌腸,其余均與TNBS組相同。
4.2 分組與給藥:動物適應性飼養1周后,采用隨機分組法將60只SD大鼠分為6組,分別為正常組、模型組、西藥組(柳氮磺胺吡啶)、人參敗毒散高、中、低劑量組。造模24 h后,除正常組和模型組外,其余各組灌胃給藥,人參敗毒散高、中、低劑量組生藥依據體表面積換算法進行換算(31.2、15.6、7.8 g/kg,西藥組0.5 g/kg。空白組從實驗開始至結束正常飲水喂食,模型組按10 ml/kg 灌胃生理鹽水7 d,其余4組每次灌胃量為10 ml /kg,連續給予相應藥物7 d。
4.3 取材、指標觀察:各組動物最后一次灌胃給藥后,禁食不禁水24 h后,各組大鼠灌胃給予營養性半固體糊 2 ml,30 min后頸椎脫臼法處死大鼠,迅速剖開腹腔,分別結扎大鼠胃賁門、幽門部兩端及直腸末端,清洗胃表面血漬、黏液,稱取胃總質量(W1),沿胃大彎剪開胃體,洗凈胃內殘留物,濾紙吸干水分,稱取胃凈質量(W2),計算胃殘留率。然后取出幽門至回盲部的腸段,在無張力情況下用直尺測量其長度,即小腸總長度(L1);然后再測出半固體營養糊標記物長度,即幽門到半固體黑色營養糊在腸道內推進的長度(L2),計算小腸推進率。再迅速沿腸系膜緣剖開腹部,取肛門上約4~10 cm至盲腸部分的腸段,并沿縱軸剪開,用預冷PBS液沖洗結腸段,去除結腸黏膜表面的糞便、分泌物及血液。取1~2 g結腸段,置于1.5 ml EP管中,迅速置于液氮冷卻保存,再轉入-80 ℃冰箱保存,留于結腸組織JAM蛋白表達檢測。


4.4 Real-time PCR檢測結腸組織中JAMmRNA的表達:稱取大鼠結腸組織約30 mg,采用Trizol法提取總RNA,按照RNA逆轉錄試劑盒說明書逆轉錄RNA,測定RNA的質量和濃度。根據反轉錄試劑盒說明反轉錄,合成cDNA。JAM和內參基因GAPDH檢測引物序列如下: JAM(248bp)上游:5'CCCTCCCTCCTTTCCTTACC 3',下游:5' CAGCCCATCTTCCTCCAGTC 3';內參GAPDH(181bp)上游:5' GTCGGTGTGAACGGATTTG 3',下游:5' TCCCATTCTCAGCCTTGAC 3'。按Real-time PCR試劑盒進行PCR擴增,反應程序為95℃預變性10min;95℃,變性15 s,60℃退火45 s后采集信號,重復40個循環。數據采用儀器自帶軟件(ABI Prism 7300 SDS Software)分析PCR過程各檢測樣本Ct(threshold cycle)值。根據內參及各指標Ct值,使用相對定量法2-△△Ct法計算個mRNA的相對表達量。
4.5 蛋白質免疫印跡(Western Blot)法檢測JAM的蛋白表達:在冰上將大鼠結腸組織剪成細小的碎片,按每20 mg組織加入150250μl裂解液的比例加入裂解液,勻漿器勻漿直至完全裂解。裂解后的樣品4℃ 12000×g 離心15 min,取上清,進行蛋白質定量后貯存于-80℃冰箱備用。采用Western Blotif法檢測各腸組織JAM的蛋白表達。通過Image J軟件分析Western blot結果,以公式(蛋白表達量=樣本蛋白灰度值/同一樣本GAPDH蛋白灰度值)計算JAM蛋白表達水平。
4.6 統計學方法:采用SPSS17.0統計學軟件分析數據,以均數±標準差表示,多組間比較采用One-Way ANOVA方差分析,在方差齊性的情況下,組間兩兩比較采用LSD-t檢驗;在方差不齊性的情況下,采用不等方差假設項下的Tamhane’s T2檢驗。以P<0.05為差異具有統計學意義。
結 果
1 對UC大鼠一般狀態的影響 造模前,SD大鼠活動性較好,動作靈活、反應靈敏,皮毛光澤、干凈,食欲佳,自由攝食、飲水,糞便呈顆粒狀、灰褐色,無稀溏便、無膿血,肛門無黏液,呼吸平穩均勻,腹部柔軟。造模2 h后,SD大鼠自然蘇醒,各組大鼠均無死亡,但精神欠佳,動作緩慢、反應遲鈍,呼吸緩慢,出現扭動軀體或蜷縮腹部情況,有些大鼠醒后自由飲水、取食,肛門部出現橘紅色的黏液分泌物。
模型組與正常組大鼠比較,自主活動性明顯降低,攝食量減少,精神萎靡,有弓背蜷腹現象,皮毛枯槁稀松,大便以黏液、膿血便為主,體重減輕。西藥組治療治療第3天開始,大鼠活動度增加,精神開始變好,食量有一定增加。黏液膿血便減少,大便偏稀軟。情況優于模型組。人參敗毒散各組治療第2天開始,精神慢慢轉佳,食欲逐漸增加,大便由稀溏慢慢轉干,膿血便減少。治療第7天,大鼠精神狀態、活動度均有所改善,皮毛色澤由暗轉亮,無膿血便,肛周分泌黏液減少或無分泌,肛周逐漸變干燥。其中中劑量組狀態改善明顯。
2 對UC大鼠體重的影響 治療前,大鼠體重模型組與高劑量組比較有顯著性差異(P<0.05)。治療后,模型組、西藥組和人參敗毒散高中低劑量組與正常組比較有顯著性差異(P<0.05),人參敗毒散中、低劑量組與模型組比較有統計學差異(P<0.05)。治療前后大鼠體重變化結果見表1。

表1 人參敗毒散對各組UC大鼠治療前后體重變化的影響
注:造模后因各組大鼠死亡數量不等,統計數量按模型組最低數量(6只)進行。與正常組比較,*P<0.05;與模型組比較,#P<0.05
3 對UC大鼠胃殘留率、小腸推進率的影響 與正常組比較,模型組、西藥組、人參敗毒散高中低組胃殘留率升高,有顯著性差異(P<0.05),小腸推進率降低,其中模型組、西藥組、人參敗毒散高劑量組有顯著性差異(P<0.05);與模型組比較,西藥組、人參敗毒散高中低組胃殘留率降低,有統計學差異(P<0.05),小腸推進率升高,有統計學差異(P<0.05)。見表2。
4 對UC大鼠腸黏膜組織中JAMmRNA表達及JAM蛋白表達的影響 與正常組比較,模型組、西藥組和人參敗毒散各組UC大鼠腸黏膜JAMmRNA表達顯著性降低(P<0.05);與模型組比較,西藥組和人參敗毒散各組JAMmRNA表達顯著升高,有統計學意義(P<0.05)。見表3。與空白組比較,模型組、人參敗毒散高 、中劑量組UC大鼠腸黏膜組織中JAM蛋白表達明顯降低(P<0.05);與模型組比較,西藥組、人參敗毒散各組JAM蛋白表達明顯升高,具有顯著性差異(P<0.05)。

表2 人參敗毒散對UC大鼠胃殘留率、小腸推進率的影響
注:與空白組比較,*P<0.05;與模型組比較,#P<0.05
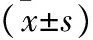
表3 人參敗毒散對UC大鼠腸黏膜組織中JAMmRNA表達及JAM蛋白表達的影響
注:與空白組比較,*P<0.05;與模型組比較,#P<0.05

圖1 人參敗毒散對UC大鼠腸黏膜組織中JAM蛋白表達的影響
UC是一種主要累及直腸、結腸黏膜的慢性非特異性炎性反應,易反復發作、治愈難度大,其發病機制尚不清楚,認為主要與腸黏膜局部免疫系統紊亂、基因因素、環境因素有關[8]。因UC多發生在結腸黏膜層,以潰瘍糜爛為主[9],研究表明UC的發病機制可能與腸道黏膜屏障功能降低有關。UC發病時黏膜屏障功能異常,腸黏膜通透性升高,腸腔內抗原物質向腸黏膜固有層移位,導致腸道促炎因子釋放,進一步損傷腸道上皮細胞,破壞腸黏膜屏障[10]。緊密連接(Tight junction,TJ)對于維持腸黏膜屏障功能有重要作用。腸上皮細胞緊密連接存在于靠近頂側(腸腔側)的細胞側面,是一個動態變化的、由多種蛋白質及分子組成、具有多種功能的復合體[11]。連接黏附分子(Junctional adhesion molecule,JAM)是一種整合膜蛋白,屬于免疫球蛋白超家族成員。JAM 家族分子廣泛表達于淋巴組織和腦內皮細胞以及多種上皮細胞中,參與內皮細胞遷移、維持血管功能以及調控細胞間 TJ 的通透性等[12]。JAM蛋白分子結構和功能發生改變時,腸上皮凋亡率上調2~3倍,腸黏膜通透性增加,細菌、脂質多糖和內毒素等大分子物質能透過損傷的腸黏膜而進入組織而引發或加重炎癥,誘發腸黏膜糜爛或潰瘍性病變等[13]。同時,腸黏膜的炎癥也影響胃腸功能。胃腸動力異常與多種消化系統疾病以及其并發癥密切相關。胃殘留率和小腸推進率是檢測胃腸動力正常與否的重要指標。觀察中藥對胃排空和腸推進的影響也一直作為研究中藥對胃腸動力作用的常規方法[14]。當胃腸動力降低時,表現為胃殘留率升高和(或)小腸推進率降低,提示胃及小腸的蠕動功能和消化功能降低,當胃腸功能逐漸恢復時,表現為胃殘留率逐漸降低和(或)小腸推進率升高[15]。
中醫雖無UC病名,就其癥狀而言,歸為“痢疾”、“滯下”、“腸澼”等范疇。痢疾之成,多因濕熱疫毒,壅滯腸道,其病勢向內向下,郁而成毒,敗腐血絡而下膿血。脾虛濕滯、正虛邪戀為UC的主要病機之一。治宜因勢利導,化濕導滯,調氣和血,此乃治痢之常法[16]。清·俞嘉言首創“逆流挽舟”法為治痢大法,人參敗毒散為其代表方。本法所治之痢,由表邪內陷于里,腸道壅滯,氣血失調而成。而導致腸道壅滯的根本原因在于表邪內陷,病勢向內向下。故“逆流挽舟”法治痢乃逆其病勢、逆其常法也,猶如水中挽舟楫逆流而上,使內陷之邪從表而解[17]。
人參敗毒散出自宋代朱肱的《傷寒類證活人書》,方中羌活、獨活,辛苦性溫,共為君藥,二藥兼能祛濕除痛;柴胡,引清氣上行,升下陷之少陽,前胡,性陰而降,功專下氣,二者一升一降、推陳致新,調達氣機,則少陽之氣不致下陷;枳殼行氣、寬腸胃,桔梗升浮,宣通氣血,為諸藥舟楫,載藥入胸,二藥宣降肺氣、調暢氣機;川芎活血止痛,助清陽而開諸郁,與柴枳桔合用,即“行血則便膿自愈,調氣則后重自除”;茯苓健脾滲濕,利氣中之濕,甘草補土和中,調和諸藥,參、苓、草三者并用,補益脾土,脾土得健,則可升其清陽,脾陽一升,木得土而達,少陽之氣隨之亦升;生姜、薄荷辛溫發散,開泄皮毛,外解表寒。縱觀本方,解表與扶正同施,寓養于透,使正氣恢復,力能舉內陷之邪外透。可見運用“逆流挽舟”法治療潰瘍性結腸炎具有獨特之處,人參敗毒散具有祛風勝濕、升陽舉陷、調氣活血、扶正祛邪之功效,對于改善潰瘍性結腸炎胃腸功能及腸黏膜屏障的通透性等方面有一定療效。
本研究實驗發現,人參敗毒散能改善UC大鼠胃腸功能,具有促進胃排空和腸推進的作用。結腸組織中JAMmRNA的表達和蛋白水平,模型組明顯低于正常組,而人參敗毒散組與模型組比較有不同程度的升高,表明人參敗毒散對UC腸黏膜屏障有一定的改善作用且與腸上皮細胞緊密連接密切相關。

