顱內前后循環缺血性卒中危險因素、卒中機制和梗死模式的對比分析
林歡,王健,呂志宇,陳秀
顱內動脈粥樣硬化性狹窄(intracranial atherosclerotic stenosis,ICAS)是我國缺血性卒中(ischemic stroke,IS)的主要病因之一,占所有IS的30%~50%[1-2]。顱內血管根據來源不同,分為前循環和后循環。前后循環動脈存在管徑、血流速度、剪切力、代償機制等不同,即便在相同損害因子作用下,前后循環動脈受損程度、受損機制也可能存在差異[3-4]。既往研究多將ICAS作為一個整體,進行IS病因、機制、模式等的探討[5-6]。對于顱內前后循環動脈粥樣硬化性狹窄致IS的特點及差異,目前國外研究較多但結論不一致[7-8]。國內Wang等[5,9]對顱內動脈粥樣硬化性狹窄的研究逐步完善了中國ICAS的理論體系,但并未詳細探討顱內前后循環動脈粥樣硬化性狹窄致IS的差異。本研究旨在探討顱內前后循環動脈粥樣硬化性狹窄致IS危險因素、卒中機制和梗死模式的差異,為進一步診療及防治提供更多參考依據。
1 對象與方法
1.1 研究對象 選取2014年12月—2017年12月于西南醫科大學附屬醫院神經內科住院治療的ICAS導致IS的患者257例。納入標準:(1)年齡≥18歲,病程<7 d。(2)依據中國急性缺血性腦卒中診治指南(2014年)診斷為IS,并完善頭顱MRI,包含彌散加權成像(DWI),證實有急性缺血灶。(3)完善全腦數字減影血管造影(DSA)證實存在ICAS。排除標準:(1)DWI顯示的急性梗死病灶與臨床癥狀不符合;梗死灶不在責任動脈供血區;前后循環均有梗死灶或前循環雙側病變者。(2)DSA顯示無腦血管狹窄;顱外或顱內外動脈同時狹窄;單側前循環或后循環多血管病變者;升主動脈或主動脈弓近端動脈粥樣硬化。(3)短暫性腦缺血發作、各種原因導致的出血性腦血管病。(4)心源性栓塞相關的卒中;小動脈閉塞導致的皮質下病灶直徑<15 mm者;各種腔隙綜合征患者;其他病因及不明病因者。(5)進行溶栓或其他血管內介入治療者,應用調脂藥物治療>1個月者。
1.2 方法
1.2.1 血管狹窄部位及狹窄程度的評估 DSA可清晰顯示血管的大小、形態、狹窄部位及程度,是目前評價顱內血管狹窄或閉塞的金標準。根據造影結果顯示責任血管的部位,將患者分為前循環組和后循環組。前循環:頸內動脈顱內段(包括海綿竇段和巖骨段)、大腦中動脈、大腦前動脈。后循環:大腦后動脈、基底動脈、椎動脈顱內段(包括硬膜內V4段)[10]。采用華法林與阿司匹林治療癥狀性顱內疾病試驗(WASID)的標準[11],計算患者的狹窄率(%)=(1-狹窄直徑/正常直徑)×100%,只有狹窄≥50%或閉塞的顱內動脈才納入研究。
1.2.2 卒中機制與梗死模式的判定 DWI可早期確定缺血性病灶的大小、部位與時間,對早期發現梗死灶較標準MRI更敏感,故用于卒中機制、梗死模式的評估[12]。根據患者的臨床特征及影像學檢查結果,將卒中機制分為:動脈-動脈栓塞(病灶位于同一血管支配區域內的多發性梗死或單發皮質梗死);低灌注(位于2條血管交界區的病灶;伴或不伴有皮層或穿支動脈閉塞);穿支動脈閉塞(病灶位于穿支動脈供血區);原位血栓形成(病灶位于血管支配的全部或大部分區域,由于側支循環的存在通常不伴有交界區的梗死灶);混合機制[7]。根據文獻[13-14]公布的模板,將梗死模式分為:(1)單發病灶,包括單發皮質梗死、單發皮質-皮質下梗死、單發皮質下梗死(直徑>15 mm)。(2)彌散病灶,指單血管供血區域的彌散病灶,包括<15 mm的彌散性病灶或>15 mm的融合性病灶伴另外病灶。(3)多發病灶,指單側前循環或后循環2個以上獨立的DWI病灶。見圖1。由2位神經內科醫師獨立閱片并確定患者的卒中機制和梗死模式,如閱片結果不一致,由第3位醫師介入并討論后確定。
1.2.3 臨床資料收集 詳細記錄患者的一般臨床資料,包括年齡及性別、高血壓史、糖尿病史、高脂血癥、卒中史、冠心病史、吸煙史、飲酒史、腦血管病家族史及實驗室指標,包括總膽固醇(TC)、三酰甘油(TG)、高密度脂蛋白膽固醇(HDLC)、低密度脂蛋白膽固醇(LDL-C)、同型半胱氨酸(Hcy)、尿酸(UA)、糖化血紅蛋白(HbA1c)、白細胞計數(WBC)、纖維蛋白原(FIB)。
1.3 統計學方法 應用SPSS 17.0進行統計分析。正態分布的定量資料以均數±標準差(±s)表示,組間比較采用t檢驗;偏態分布的定量資料用M(P25,P75)表示,組間比較采用Wilcoxon秩和檢驗;計數資料以例(%)表示,組間比較采用χ2檢驗。影響因素分析應用二分類Logistic回歸分析,以P<0.05為差異有統計學意義。
2 結果
2.1 2組患者一般臨床資料比較 前循環組、后循環組患者年齡、高脂血癥、卒中史、冠心病史、飲酒史、家族史、TC、TG、HDL-C、LDL-C、Hcy、UA、WBC、FIB差異無統計學意義。前循環組男性和有吸煙史比例高于后循環組,而高血壓史和糖尿病史比例、HbA1c低于后循環組,差異有統計學意義(均P<0.05),見表1。
2.2 顱內后循環動脈粥樣硬化性狹窄致IS的影響因素分析 將責任血管的部位作為因變量(前循環組=0,后循環組=1),以男性(否=0,是=1)、高血壓(無=0,有=1)、糖尿病(無=0,有=1)、吸煙史(無=0,有=1)、HbA1c為自變量進行二分類Logistic回歸分析。結果顯示高血壓、糖尿病、高HbA1c水平是顱內后循環動脈粥樣硬化狹窄致IS的獨立危險因素,見表2。
2.3 2組患者卒中機制的分布比較 前循環組患者卒中機制的分布以動脈-動脈栓塞最多見,后循環組患者以穿支動脈閉塞最常見。2組患者動脈-動脈栓塞、原位血栓形成構成比比較,差異無統計學意義。前循環組低灌注、混合機制構成比高于后循環組,而穿支動脈閉塞構成比低于后循環組,差異均有統計學意義(P<0.05),見表3。
2.4 2組患者梗死模式的分布比較 前循環組患者梗死模式的分布以多發病灶最常見,而后循環組患者多為單發皮質下梗死。2組患者單發皮質梗死、彌散病灶、多發病灶構成比比較,差異無統計學意義(P>0.05)。前循環組單發皮質-皮質下梗死構成比高于后循環組,而單發皮質下梗死低于后循環組,差異均有統計學意義(P<0.05),見表4。
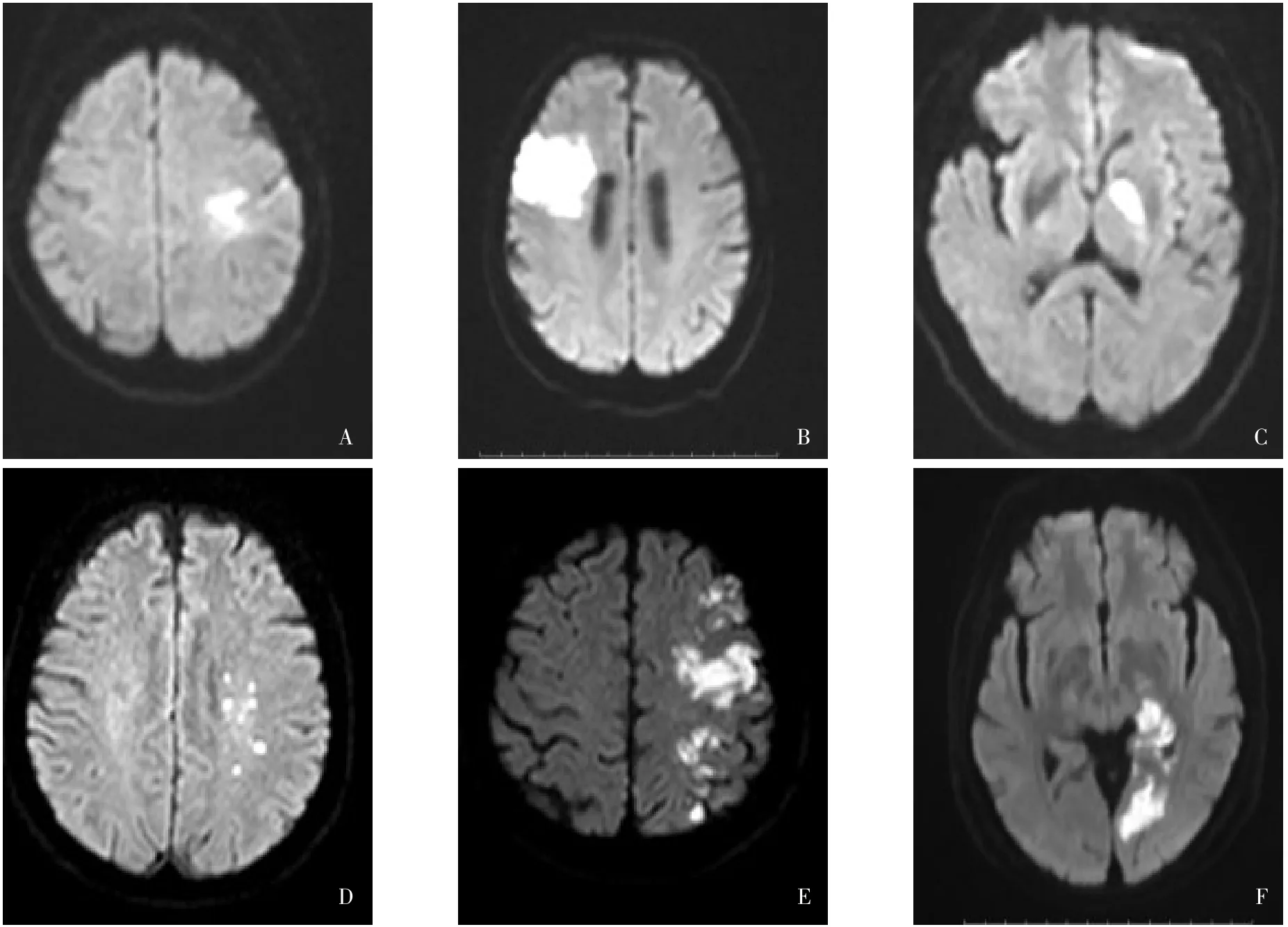
Fig.1 Different lesion patterns of IS caused by ICAS圖1 ICAS致IS的不同梗死模式
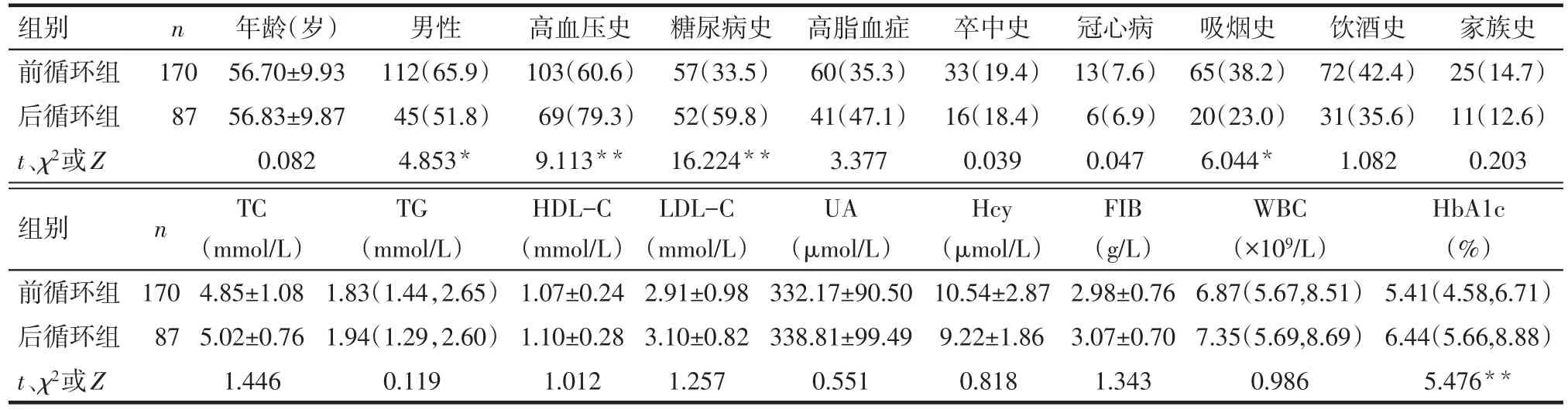
Tab.1 Comparison of basic clinical characteristics between the two groups表1 2組患者一般臨床資料比較

Tab.2 Binary Logistic regression analysis of the influencing factors of IS patients caused by intracranial posterior circulatory atherosclerotic stenosis表2 顱內后循環動脈粥樣硬化性狹窄致IS的影響因素二分類Logistic回歸分析

Tab.3 Comparison of the distribution of stroke mechanisms between the two groups表3 2組患者卒中機制分布的比較 例(%)
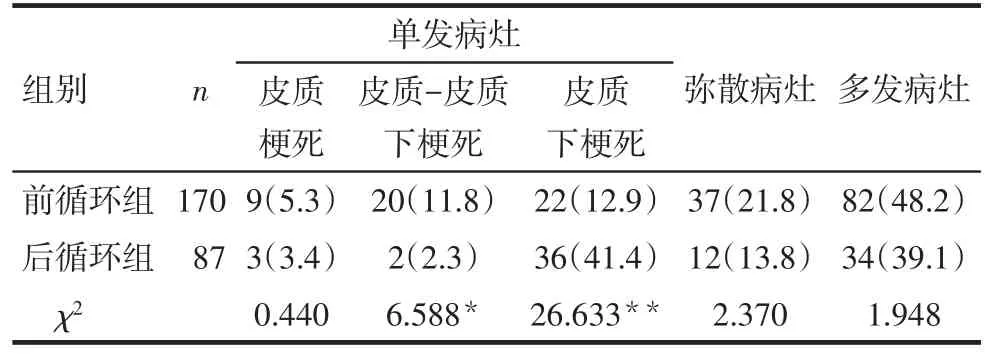
Tab.4 Comparison of the distribution of infarct patterns between the two groups表4 2組患者梗死模式分布的比較 例(%)
3 討論
顱內前后循環動脈粥樣硬化性狹窄致IS患者的危險因素、卒中機制等已有報道,但由于種族、地域、血管檢查方法、腦動脈狹窄的診斷標準、卒中機制及梗死模式的定義等的不同,致使研究結果存在較大分歧,缺乏準確性及可靠性[13,15]。因此,本研究全部患者統一行DSA檢查,嚴格按照WASID標準判定顱內動脈狹窄;根據DWI評價卒中機制和梗死模式,探討顱內前后循環動脈粥樣硬化性狹窄致IS患者危險因素、卒中機制、梗死模式的臨床特點及差異。
本研究發現男性、高血壓、糖尿病、吸煙史、HbA1c在顱內前后循環動脈粥樣硬化性狹窄致IS間存在差異,且高血壓、糖尿病、HbA1c升高是顱內后循環動脈粥樣硬化性狹窄致IS的獨立危險因素。此結果與Kim等[7]及Miyamoto等[16]報道基本一致,提示與顱內前循環動脈粥樣硬化性狹窄患者相比,后循環狹窄患者應嚴格控制血壓、血糖,以減少相關IS的發生。高血壓引起IS的原因可能為動脈粥樣硬化的基礎上長期的高血壓促進血管內皮細胞釋放血管活性物質,腦血管收縮張力增加,引起粥樣硬化斑塊破裂導致腦梗死的發生。糖尿病不僅作用于顱內大血管引起粥樣硬化性病變;同時也作用于小血管引起廣泛的微血管損害并促進血栓的形成,導致糖尿病腦梗死的發生[17]。HbA1c是臨床常用的評估血糖波動的重要指標,血糖波動大引起機體氧化應激反應等可導致血管內皮細胞凋亡增加及加重機體大血管粥樣硬化的程度,導致腦梗死的發生,HbA1c水平每增加1%,卒中的風險性增加17%[18]。但高血壓與血糖代謝異常易引起顱內后循環卒中的原因目前仍不清楚,可能與代謝綜合征有關[7]。
既往報道ICAS致IS的卒中機制以動脈-動脈栓塞最常見[19],但本研究并未發現其分布在顱內前循環和后循環卒中患者間存在差異,可能的原因是顱內不同部位的動脈在粥樣硬化性狹窄時產生的剪切力都易造成分叉、分支、轉折等處的潰瘍斑塊破裂,并將形成的栓子送至血管遠端,造成栓塞。本研究還發現顱內前循環粥樣硬化性狹窄致IS患者低灌注、混合機制的構成比高于顱內后循環卒中患者,而穿支動脈閉塞的構成比則低于后者,差異均有統計學意義。可能的原因是:(1)低灌注伴或不伴其他機制時,動脈狹窄基礎上發生血流動力學障礙,或影響遠端栓子清除障礙,都可導致梗死的發生,這可能與前循環血管解剖特點有關[20]。(2)與前循環相比,后循環短而小的穿支動脈確實更容易閉塞[21]。
梗死模式與卒中機制有相關性,探索IS前后循環梗死模式的特點,有利于明確發病機制及制定治療策略。本研究發現顱內前循環粥樣硬化性狹窄致IS單發皮質-皮質下梗死的構成比高于顱內后循環卒中患者,而單發皮質下梗死低于顱內后循環卒中患者,差異均有統計學意義。梗死模式不僅與梗死灶的血液供應變化有關,還與側支循環的代償有關[22]。結合患者的卒中機制,與顱內后循環血管相比,前循環血管更易在血管狹窄基礎上出現血流動力學障礙導致IS的發生,其治療策略更應關注腦血流灌注狀態的改善[20]。與穿支動脈閉塞的高構成比一致,單發皮質下梗死在顱內后循環卒中分布最廣,同樣與后循環穿支動脈的解剖特點有關,防治時應減少微栓子的形成。
本研究的局限性:(1)本研究為單中心研究,樣本量不大,且全為住院患者,可能存在選擇偏倚。(2)沒有進行微栓子檢測、病理組織檢查,對IS的卒中機制只能進行推測。(3)對多發機制、多發模式未進行深入的分類與探討。
總之,本研究表明顱內前后循環動脈粥樣硬化性狹窄致IS存在危險因素、卒中機制和梗死模式的差異。針對不同部位的血管制定不同的防治策略,可能有利于減少相關IS的發生,值得進一步探討。

