泡球蚴感染小鼠中Tim-3對Th1/Th2細胞因子平衡的影響作用研究①
張峰波 員 靜 朱玥潔 龐楠楠 安夢婷 閆 芳 丁劍冰
(新疆醫科大學基礎醫學院,烏魯木齊830011)
棘球蚴病(echinococcosis) 是一種經消化道感染棘球絳蟲的蟲卵以及幼蟲后導致的一種慢性寄生蟲病[1-3]。泡球蚴(E.multilocularis)主要寄生在人體的肝臟,其對肝組織的損害主要是機械性擠壓、毒素刺激反應以及對肝的直接侵蝕,對肝組織有嚴重的破壞性,且對肝組織的破壞范圍廣[4]。泡球蚴感染晚期可引起宿主肝衰竭、肝昏迷、門靜脈高壓并發消化道大出血甚至導致宿主死亡,對宿主危害極大[5]。E.multilocularis幼蟲在肝內像腫瘤一樣,以多泡性出芽方式浸潤生長,感染者出現癥狀已是晚期,常常無法手術治療,感染者病死率高達95%,因此泡球蚴病(Alveolar echinococcosis,AE)被認為是最致命的蠕蟲感染之一,又被稱為“蟲癌”[6]。
泡球蚴在感染人或動物后,在宿主體內長期生存,造成一系列免疫應答改變[7,8]。這需要主動的對宿主免疫系統進行調節,以逃避不利于其生存的免疫應答反應[9,10]。泡球蚴和宿主之間能夠互相識別對方的免疫調節信號。一方面宿主會針對泡球蚴釋出的大量蛋白產生免疫應答,來限制泡球蚴的生長。另一方面泡球蚴也會通過一系列的調節機制來逃避宿主對其有效的免疫應答,使之既不被宿主免疫系統清除,又能讓宿主的免疫病理反應降到最低的程度,在這些調節機制中免疫調節占據重要地位[11]。
Tim-3(T cell immunoglobulin and mucin domain containing molecule 3,Tim-3)是Tim家族激活誘導的抑制性受體,主要表達在分化成熟的Th1細胞上[12]。近期發現在血吸蟲感染中,Tim-3高表達于Th1細胞,可導致Th1細胞凋亡,負性調節Th1/Th2細胞,導致血吸蟲長期寄生于宿主[13,14]。近年來,研究人員同樣發現,瘧疾的慢性化也與Tim-3密切相關[15]。
本課題組前期研究發現,Tim-3在細粒棘球蚴感染患者中高表達[16,17],但是Tim-3在泡球蚴感染免疫中的作用還不是太清楚,在泡球蚴感染中尚未見相關報道。因此本研究建立了泡球蚴感染動物模型,檢測Tim-3 與Th1、Th2相關細胞因子為泡球蚴感染后機體的免疫狀態及相關機制研究提供一定的理論基礎。
1 材料與方法
1.1材料
1.1.1實驗動物 選取30只SPF級BALB/c小鼠,所有小鼠均為6周齡雌性小鼠、體重約(20±2)g,購于新疆醫科大學動物中心,動物模型制作及飼養在新疆醫科大學第一附屬醫院實驗動物科學研究部。本研究所涉及的所有實驗內容均已通過新疆醫科大學第一附屬醫院倫理委員會審查(20160222-11)。
1.1.2試劑 流式抗體抗鼠CD3-PE-Cy7、抗鼠CD4-PE-Cy5和抗鼠Tim-3-PE抗體、淋巴細胞分離液購自Solarbio公司。RPMI1640培養液購自Thermo Fishers公司。CBA試劑盒購自BD公司。
1.2方法
1.2.1泡球蚴感染動物模型的建立 泡球蚴感染的長爪沙鼠感染90 d后,頸椎脫臼處死小鼠,用無菌鑷子剪刀開腹,分離泡球蚴組織,將泡球蚴組織剪碎,經篩網研磨過濾,用生理鹽水反復漂洗,直到洗液清亮,棄去上清取原頭蚴沉淀物,加入含雙抗的生理鹽水,顯微鏡下計數,調整原頭蚴懸液濃度至2 000個原頭蚴/ml懸液,用于注射動物。實驗組小鼠左下腹腔注射200 μl原頭蚴懸液,對照組小鼠相同部位注射等量生理鹽水,接種后普通飼養。
1.2.2脾臟淋巴細胞分離 在無菌培養皿中加入RPMI1640約4 ml,將小鼠脾臟取出后用研磨棒充分研磨,用200目濾網過濾混懸液并收集到15 ml的離心管中;另一15 ml的離心管中加入3~4 ml淋巴細胞分離液(Ficoll),將上一15 ml離心管中的脾細胞懸液緩慢疊加于Ficoll上;水平離心機室溫離心,2 500 r/min,10 min;取出離心管觀察分層,用移液器緩慢吸出中間呈現白色云霧狀的淋巴細胞層(旋轉吸取)至新15 ml試管中,然后用無菌PBS液或RPMI1640稀釋至10 ml,將細胞懸起,洗滌,3 000 r/min,5 min,棄上清;加入1 ml PBS,重懸細胞后移至1.5 ml Ep管中;混勻后吸取2 μl細胞懸液加入98 μl PBS,計數儀計數,調整細胞濃度至1×107個/ml。
1.2.3流式細胞技術檢測Tim-3的表達水平 取100 μl 細胞懸液放入流式管中,加入抗CD3-PE-Cy7、抗CD4-PE-Cy5和抗Tim-3-PE抗體各5 μl,4℃避光 20 min;然后,加入2 ml PBS洗滌,1 000 r/min,5 min,棄上清;加入400 μl PBS重懸細胞,上機檢測。首先用前向角散射(Forward Scatter, FS)和側向角散射(Side Scatter,SS)分選淋巴細胞,然后用SS和CD3-PE-Cy7分選T淋巴細胞,最后標記CD4-PE-Cy5和Tim-3-PE選出CD4+Tim-3+T細胞,加入破膜劑,室溫下避光孵育15 min。加入Mouse-IFN-γ-APC抗體,Mouse-IL-4-FIFC抗體,并且設立Mouse-IgG-PE抗體作為同型對照管,用Flowjo軟件分析數據。
1.2.4CBA試劑盒血清樣本中細胞因子水平的檢測 制備細胞因子標準品:將標準品小球移到15 ml離心管中,并標記該管為最高濃度標準品;用2 ml實驗稀釋液重懸標準品,重懸后的標準品溶液需室溫下平衡15 min;取9根12×75 mm流式上樣管,梯度稀釋的倍數1∶2、1∶4、1∶8、1∶16、1∶32、1∶64、1∶128、1∶256;每管各加300 μl實驗稀釋液,從最高濃度標準品管取300 μl液體到1∶2 管吹打混勻,從1∶2 管取300 μl液體到1∶4管,依此類推,直到1∶256 管;僅可用槍吹打混勻,不可渦旋;混合捕獲微球,充分渦旋混勻,每個實驗管都加入50 μl;稀釋樣本,樣本管中每管加入50 μl待測樣本;標準品管中每管加入50 μl梯度稀釋好的標準品;所有實驗管中都加入50 μl人細胞因子PE檢測試劑,室溫避光孵育3 h;加入1 ml洗液,200 r/min離心5 min,小心吸去上清;加300 μl洗液,重懸微球,上機檢測。
1.3統計學處理 實驗數據采用SPSS17.0軟件進行統計學處理,以均數P表示,采用獨立樣本t檢驗、單因素方差分析和相關性分析對實驗數據進行比較分析,P<0.05表示差異有統計學意義。
2 結果
2.1泡球蚴感染小鼠血清IFN-γ和IL-4水平 為研究不同時期正常小鼠和泡球蚴感染小鼠血清IFN-γ水平的變化,本實驗通過制備細胞因子標準品,檢測小鼠樣本IFN-γ的濃度。結果顯示感染小鼠血清IFN-γ水平(9.81±2.17)pg/ml, 明顯高于正常對照組(2.51±0.76)pg/ml,差異具有統計學意義(P<0.01)。

圖1 各組血清中IFN-γ和IL-4水平及IFN-γ/IL-4比值

圖2 各組小鼠脾細胞CD4+Tim-3+T細胞的水平
同樣的方法檢測泡球蚴感染小鼠血清中IL-4水平,正常對照組IL-4水平為(2.27±0.81)pg/ml,泡球蚴感染小鼠血清IL-4水平為(28.44±7.45)pg/ml。泡球蚴感染小鼠血清中IL-4水平高于對照組,差異具有統計學意義(P<0.01),見圖1。
2.2FCM檢測Tim-3在泡球蚴感染小鼠脾臟中表達 脾細胞懸液經勻漿,密度梯度法分離出單個核細胞,用FCM檢測,先在FS、SS設門選出淋巴細胞,再以SS和CD3陽性設門選出T淋巴細胞,進一步選擇CD4+Tim-3+T細胞,分析CD4+Tim-3+T細胞百分率。FCM結果顯示:泡球蚴感染小鼠脾CD4+Tim-3+T細胞水平為(40.19±6.31)%,對照組為(2.52±0.77)%。泡球蚴感染小鼠脾CD4+Tim-3+T細胞水平明顯高于對照組,差異具有統計學意義,見圖2。泡球蚴感染小鼠脾中Th1細胞Tim-3的表達水平高于正常對照組,差異具有統計學意義,與正常對照組相比,泡球蚴感染小鼠脾中Th2細胞Tim-3的表達水平差異無統計學意義,見圖3。

圖3 各組小鼠脾細胞Tim-3+Th1、Tim-3+Th2細胞的水平
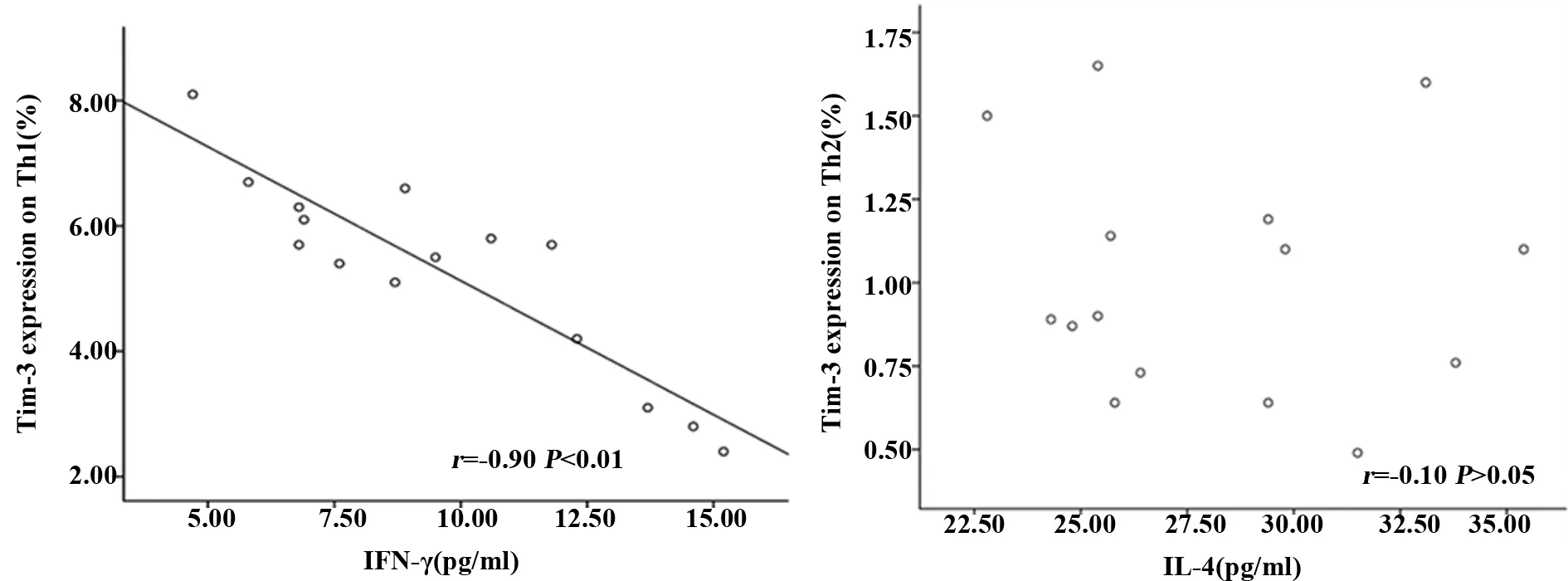
圖4 Th1和Th2細胞上表達Tim-3在與IFN-γ和IL-4相關性分析
2.3泡球蚴感染小鼠脾臟Tim-3對Th1和Th2細胞功能的影響 為了發現Th1和Th2細胞上Tim-3對Th1和Th2細胞功能的關系,本研究進一步對Th1和Th2細胞上Tim-3與IFN-γ、IL-4進行了相關分析。研究發現,Th1細胞上Tim-3與IL-4呈負相關,而Th2細胞上Tim-3表達量極低,并且與IL-4不相關。見圖5。
3 討論
泡球蚴在宿主體內的發育、繁殖和長期生存均有賴于有效的免疫逃避機制[18]。本研究發現泡球蚴感染小鼠IL-4水平明顯增加。泡球蚴感染小鼠脾臟淋巴細胞Tim-3水平明顯增高,并與IFN-γ呈現負相關,與IL-4成正相關。
泡球蚴感染小鼠IL-4水平明顯增加,IFN-γ輕度增加。IL-4對于B細胞、T細胞、肥大細胞、巨噬細胞和造血細胞都有免疫調節作用[19]。IL-4是T細胞自身分泌的生長因子,如HT-2細胞系是一種IL-2依賴細胞系,IL-4可單獨維持Th2細胞的增殖,同時伴有CTL、NK和LAK功能的降低。可抑制IFN-γ mRNA的轉錄和抑制IFN-γ誘導B細胞產生IgG2a[20]。本研究發現泡球蚴感染小鼠IFN-γ/IL-4下降,表明泡球蚴感染導致了Th1/Th2免疫平衡的改變,而Th1/Th2平衡改變可能與泡球蚴的免疫逃避有關。
泡球蚴感染小鼠脾臟淋巴細胞Tim-3水平明顯增高。最近在MS患者的研究中發現[21],通過體外實驗用Tim-3 siRNA來降低CD4+T細胞Tim-3的表達,可以促使IFN-γ產生,表明Tim-3的表達可以下調IFN-γ的水平,證實了人Th細胞Tim-3的表達可以調控IFN-γ的分泌。近年來一些寄生蟲感染的研究發現Tim-3/Galectin-9參與其中的免疫調控。血吸蟲感染的小鼠中檢測到大量的Tim-3+T細胞,且Tim-3+T細胞的數量與瘧原蟲在宿主體內的蟲荷呈正相關。隨著體內寄生蟲的清除,Tim-3+T細胞的數量出現相應減少,提示Tim-3在血吸蟲感染引起的宿主病理改變中有很重要的作用。為了探討Tim-3蛋白是否與泡球蚴病發病相關,本研究檢測了Tim-3蛋白在正常小鼠和泡球蚴感染小鼠脾臟淋巴細胞的表達,發現泡球蚴感染組Tim-3表達水平明顯增高,提示Tim-3在泡球蚴感染的發生發展中起著至關重要的作用。
為了探討Tim-3 與Th1和Th2的關系,本研究檢測了Th1和Th2細胞表面Tim-3的表達,同時檢測小鼠外周血IFN-γ和IL-4水平,同時進行了Th1、Th2細胞表面Tim-3表達分別與IFN-γ和IL-4的Pearson相關分析。開展Th1和Th2細胞表面Tim-3的表達與相關細胞因子分析,發現Th1上Tim-3表達與IFN-γ具有更好的負性相關性,而Th2細胞表面Tim-3與IL-4不相關。據此推測,在泡球蚴感染過程中,Tim-3可能參與了Th1/Th2平衡改變,這種平衡的改變可能是通過下調Th1免疫應答,影響Th1/Th2免疫應答平衡,抑制免疫應答,促使泡球蚴的免疫逃避。
綜上所述,本研究發現泡球蚴感染小鼠脾臟淋巴細胞Tim-3以及外周血IL-4水平增高,IFN-γ增高不明顯,可能是Tim-3參與Th1/Th2免疫失衡,促進了泡球蚴感染的發展,有效地控制Tim-3的水平可能成為治療泡球蚴感染的一個新靶點。