李斯特菌溶血素通過激活PI3K/Akt 信號通路促進呼吸道上皮細胞炎癥反應及MUC5AC表達
尹 芳 胡月圓 易 娟 李貴南
(湖南省兒童醫院新生兒二科,長沙410007)
單核細胞增生李斯特菌(Listeria monocyto-genes,LM)是一種常見的革蘭陽性致病菌,其主要以食物為媒介通過消化道傳播。感染人和動物可引起腦膜炎、敗血癥、流產等癥狀,病死率高達30%[1]。由于LM耐受性強、在輕度感染的情況下易被忽視等特點,使得LM成為目前世界范圍內感染最為嚴重的致病菌之一。目前研究發現LM入侵人體是否引起致病與菌體含量和宿主的年齡及免疫狀態有關。LM是一種胞內寄生的致病菌,宿主對其清除作用只能依靠細胞免疫功能[2]。因此,易感者以新生兒、孕婦以及免疫功能缺陷者為主。近年來,新生兒感染LM引發肺炎的病例逐年上升,其主要通過孕婦的胎盤傳播。LM感染后可使新生兒出現發熱、呼吸急促、呼吸困難、窒息等顯著的呼吸道癥狀。
李斯特菌溶血素(Listeriolysin O,LLO)是LM的關鍵毒力因子,主要由hly基因編碼,是膽固醇依賴性細胞溶素家族成員之一。研究發現hly基因敲除菌株并不具有體外溶血活性,對小鼠也不能產生感染癥狀[3]。LLO能與膽固醇共同作用于細胞膜,并在細胞膜上形成孔狀結構,進而使LM從液泡中釋放以逃避巨噬細胞的免疫攻擊。此外,LLO還能誘導T細胞發生凋亡從而減弱機體的免疫功能[4,5]。考慮到LLO的多種功能及其對于LM致病的重要性,深入研究LLO作用的分子機制對于預防控制LM感染意義重大。本研究通過探討LLO引起的宿主細胞炎癥反應以及MUC5AC表達與磷酯酰肌醇3激酶/蛋白激酶B(Phosphatidylinositol-3-kinsae/protein kinase B,PI3K/Akt)信號通路的關系,希望能為闡明LM致病的分子機制提供實驗依據。
1 材料與方法
1.1實驗材料 人呼吸道上皮細胞株(16-HEB)購自美國ATCC細胞庫國內代理商;LLO由本實驗室原核表達純化制備;RNA提取液、Trizol試劑盒購自北京奧維亞生物公司;cDNA逆轉錄試劑盒購自上海斯信生物科技有限公司;p-Akt抗體、Akt抗體、β-actin抗體購自美國Cell Signaling Technology公司;IL-6、IL-1β檢測試劑盒購自eBioscience公司;MUC5AC試劑盒購自武漢優爾生科技股份有限公司;RT-PCR引物設計合成均由上海生物工程有限公司完成;細胞培養試劑、耗材均購自Sigma公司。
1.2方法
1.2.1細胞培養及細胞處理 凍存的16-HEB細胞株37℃快速溶解后加入含10%胎牛血清的DMEM培養基(含1%的青霉素-鏈霉素混合液),于37℃、5%CO2的細胞培養箱中培養。待細胞密度達85%以上進行細胞傳代。將細胞按相應比例稀釋后置于24孔板或者新的細胞瓶中,分別用濃度為15、30、45 μg/ml的LLO刺激細胞,24 h后收集細胞及上清待用。用20、40 μmol/L的PI3K抑制劑LY294002預處理細胞后,再用45 μg/ml的LLO刺激細胞24 h后收集細胞及上清待用。
1.2.2qRT-PCR 將上述收集的細胞使用Trizol試劑盒提取總RNA,純化后按照逆轉錄試劑盒說明書使其逆轉錄為cDNA,隨后按照qRT-PCR反應體系進行引物擴增。擴增完畢后,使用2-ΔΔCt法計算IL-6、IL-1β以及MUC5AC mRNA的轉錄水平。PCR引物設計如下:MUC5AC上下游引物:5′-CCATAGTACAGTGGTCGATGC-3′、5′-GATCGATACATGGGTA-GACTT-3′;IL-6上下游引物:5′-GCCTTCGGTCCA-GTTGCC-3′、5′-GCGCAGAATGAGATGAGTTGTCATG-3′;IL-1β上下游引物:5′-ACTACAGCAAGGGCTT-ACAGG-3′、5′-TCTTTCAACACGCAGGACAG-3′。
1.2.3Western blot檢測 收集上述處理后的細胞,超聲破碎后得到細胞總蛋白。采用BCA法進行蛋白定量。將各樣本濃度調整一致后,按照Western blot說明書進行配膠、加樣、跑膠、轉膜,用5%脫脂奶粉室溫封閉2 h,隨后加入稀釋好的一抗4℃孵育過夜。第二天洗膜后再加入稀釋好的二抗室溫孵育2 h。最后將配制好的ECL發光液均勻滴加在膜上,置于顯影儀中顯影,隨后以β-actin為內參采用 Image J2X軟件進行灰度值掃描,計算相對表達量。
1.2.4ELISA檢測 收集上述處理后得到的細胞上清,采用雙抗體夾心ELISA法檢測IL-6、IL-1β以及MUC5AC,并于酶標儀450 nm處測定OD值。最后按照相應的ELISA檢測試劑盒說明書計算IL-6、IL-1β的含量以及MUC5AC的濃度。

2 結果
2.1LLO誘導MUC5AC表達 為了觀察LLO對MUC5AC表達的影響,我們采用濃度為15、30、45 μg/ml 的LLO刺激16-HEB細胞株24 h后,qRT-PCR以及ELISA檢測細胞內MUC5AC mRNA轉錄水平和細胞上清中MUC5AC濃度。結果如圖1所示,隨著LLO濃度的增加,MUC5AC mRNA轉錄水平以及MUC5AC濃度都呈遞增趨勢,且均顯著高于未處理的對照組(P<0.05),表明LLO能夠刺激16-HEB細胞株中的MUC5AC表達。
2.2LLO刺激產生IL-6與IL-1β 為了檢測LLO刺激產生炎癥反應的情況,我們采用濃度為15、30、45 μg/ml的LLO刺激16-HEB細胞株24 h后,qRT-PCR以及ELISA檢測細胞內炎性因子IL-6與IL-1β mRNA轉錄水平以及細胞上清中IL-6與IL-1β的含量。結果如圖2所示,隨著LLO濃度的增加,IL-6與IL-1β mRNA轉錄水平以及含量均顯著增加,且高于對照組(P<0.05),表明LLO能夠刺激16-HEB細胞株產生炎癥反應。通過Pearson直線相關性分析發現IL-6與IL-1β mRNA的相關系數為0.94,濃度相關系數為0.96,表明IL-6與IL-1β的產生具有顯著的相關性。
2.3LLO能夠激活PI3K/Akt信號通路 為了檢測LLO對PI3K/Akt信號通路的影響,我們按照上述處理后收集細胞提取總蛋白,Western blot檢測細胞中p-Akt的表達情況。結果顯示,p-Akt的表達隨LLO濃度的增加而遞增,且較對照組差異顯著(P<0.05),提示LLO能夠激活PI3K/Akt信號通路(圖3)。

圖1 不同濃度LLO對MUC5AC表達的影響
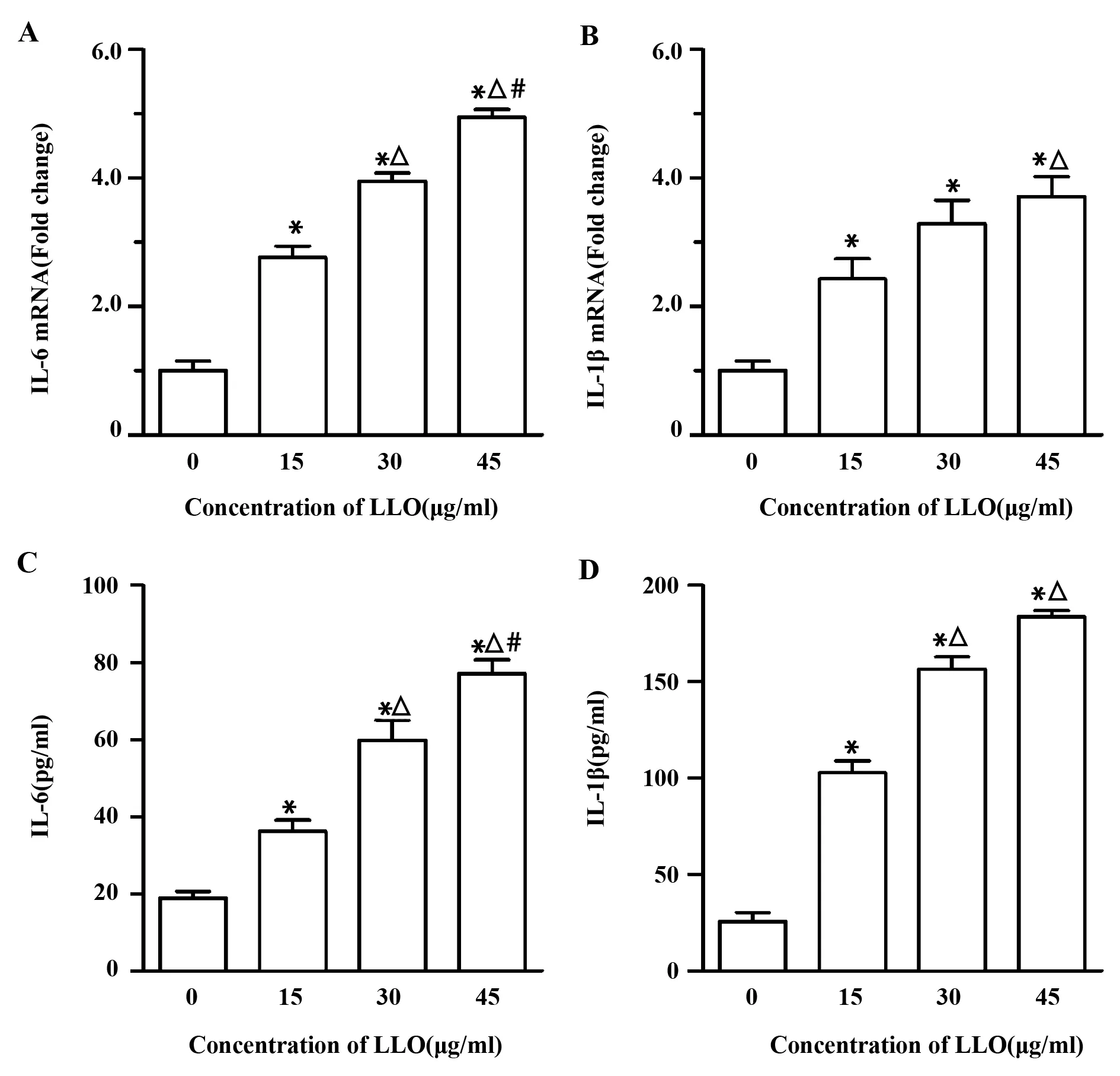
圖2 不同濃度LLO對IL-6與IL-1β產生的影響
2.4PI3K抑制劑LY294002抑制p-Akt的表達 為了檢測PI3K/Akt信號通路與LLO刺激細胞產生炎癥反應以及MUC5AC表達的關系,我們先用PI3K抑制劑LY294002處理細胞,并通過檢測p-Akt的表達情況來驗證對PI3K/Akt信號通路的抑制效果。結果顯示,不同濃度抑制劑LY294002均能有效抑制p-Akt的表達(P<0.05),但抑制劑濃度20 μmol/L與40 μmol/L對p-Akt表達的抑制作用并無顯著差異(圖4)。
2.5抑制PI3K/Akt信號通路對MUC5AC表達的影響 為了確定PI3K/Akt信號通路與MUC5AC表達的關系,我們使用抑制劑LY294002預處理細胞后再用45 μg/ml的LLO刺激細胞,并檢測細胞中MUC5AC的表達情況。結果如圖5所示,抑制p-Akt表達后能夠顯著降低細胞中MUC5AC mRNA轉錄水平以及MUC5AC濃度(P<0.05),提示抑制PI3K/Akt信號通路能夠降低LLO刺激引起的MUC5AC表達。
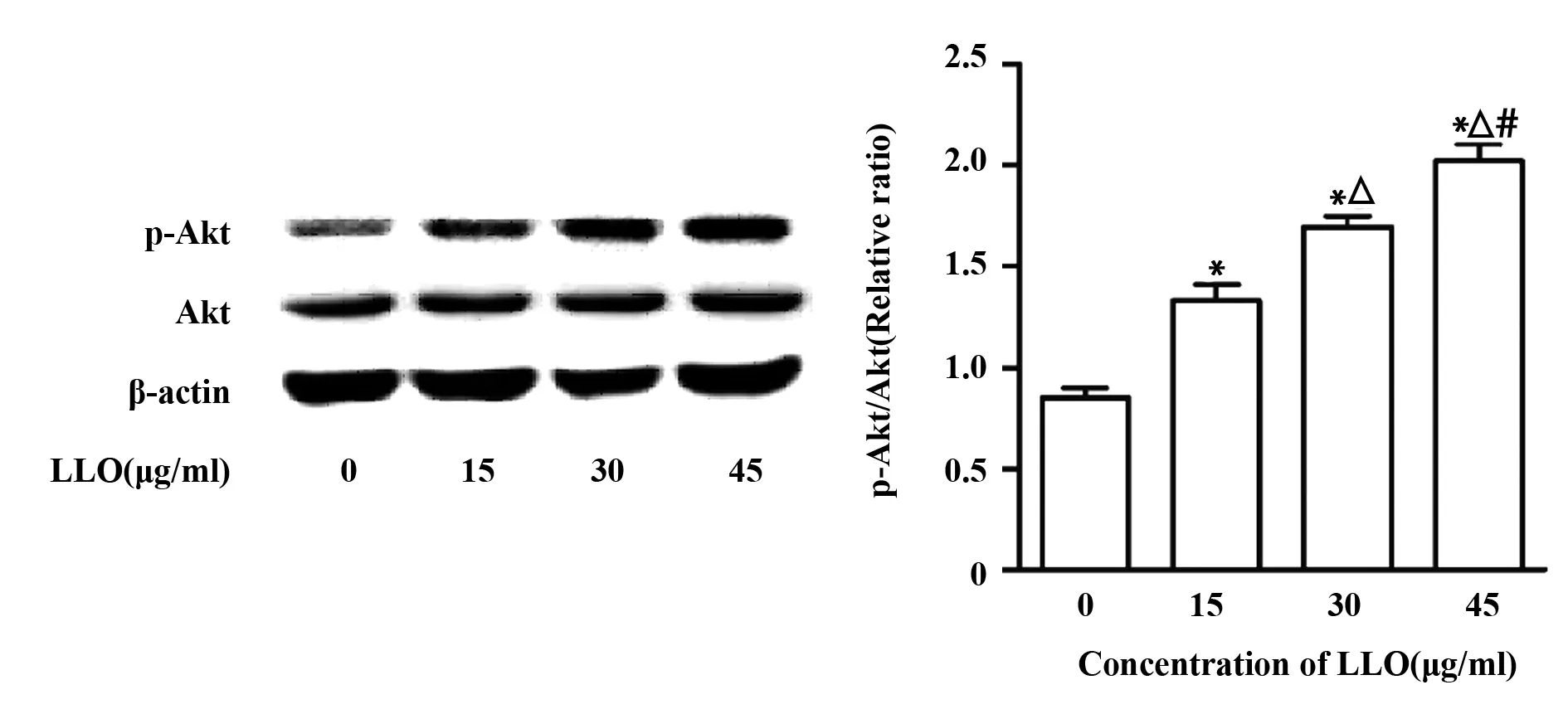
圖3 不同濃度LLO對p-Akt表達的影響
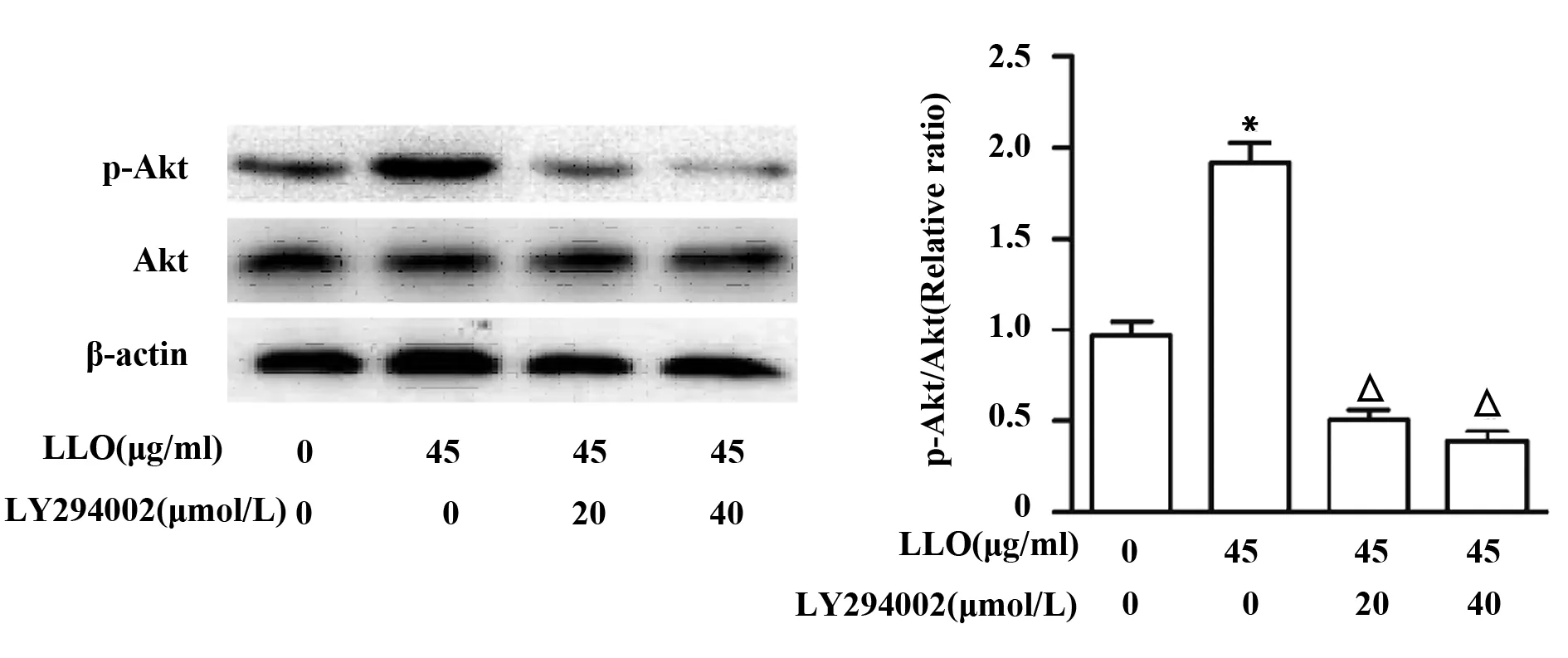
圖4 抑制劑LY294002對16-HEB細胞株中p-Akt表達的影響

圖5 抑制PI3K/Akt信號通路對細胞中MUC5AC表達的影響

圖6 抑制PI3K/Akt信號通路對細胞中炎性因子產生的影響
2.6抑制PI3K/Akt信號通路對IL-6、IL-1β產生的影響 為了確定PI3K/Akt信號通路與炎癥反應發生的關系,我們使用抑制劑LY294002預處理細胞后再用45 μg/ml的LLO刺激細胞,并檢測細胞中炎性因子IL-6、IL-1β的產生情況。結果如圖6所示,抑制p-Akt表達后能夠顯著降低細胞中IL-6、IL-1β mRNA的轉錄水平以及含量(P<0.05)。提示抑制PI3K/Akt信號通路能夠減輕LLO刺激引起的炎癥反應。
3 討論
LLO是由LM分泌的一種重要的成孔毒素,其能在LM感染的早期和晚期裂解吞噬泡,從而使LM在感染入侵宿主細胞時能夠逃避宿主靶細胞的清除[6]。盡管已有研究表明LLO是LM入侵宿主細胞的關鍵信號分子[7],能夠激活NF-κb、磷脂酰肌醇、鈣信號通路。但其是否能夠激活PI3K/Akt 信號通路,并通過PI3K/Akt信號通路的活化進一步引起致病作用,目前尚不清楚。本研究通過探討LLO刺激細胞產生炎癥反應以及MUC5AC表達與PI3K/Akt信號通路的關系,旨在進一步明確LLO致病的分子機制。
Akt是真核細胞中參與信號轉導的關鍵分子,它能夠參與調控細胞凋亡、細胞侵襲等多方面的功能。PI3K家族作為Akt激活過程中的關鍵環節,其在許多呼吸道以及肺組織炎癥反應中均發揮了至關重要的作用[8]。有研究表明,通過抑制PI3K/Akt信號通路來抑制蛋白激酶C-δ的表達,能夠減輕過敏性呼吸道炎癥反應[9]。此外,卵清蛋白引起的呼吸道過敏性反應可能也是通過激活PI3K/Akt信號通路引起的[10]。本研究通過Western blot檢測發現LLO能夠刺激16-HEB細胞株中p-Akt的表達,有效激活PI3K/Akt信號通路,提示其可能也與LLO引起的呼吸道炎癥反應有關。
黏蛋白主要是由呼吸道和消化道分泌的一類大分子糖蛋白,其在呼吸道中主要發揮清潔潤滑以及保護作用。目前人類已知的黏蛋白已達18種,MUC5AC作為其中一種重要的膠樣黏蛋白,其表達水平的變化能直接反映呼吸道感染與炎性病變的發生情況。當人體出現呼吸道的炎性疾病時,MUC5AC分泌會明顯增加,進而發揮相關的保護作用[11,12]。本研究通過采用不同濃度的LLO刺激16-HEB細胞株,發現MUC5AC的轉錄水平及濃度均顯著上升,表明LLO與LM引起的呼吸道病變密切相關,該結果與之前的報道相符。
有研究表明,MUC5AC在呼吸道炎癥反應中會出現過度分泌的情況,有效控制MUC5AC過度分泌對于開發相關的呼吸道感染藥物至關重要[13]。本研究采用PI3K抑制劑LY294002處理細胞后,先通過Western blot驗證抑制效果,再進一步檢測細胞中MUC5AC轉錄水平與濃度的變化情況,發現抑制PI3K/Akt信號通路能夠有效降低MUC5AC的表達,提示LLO刺激MUC5AC表達與PI3K/Akt信號通路有關。該結果也為尋求控制MUC5AC過度分泌的分子靶點提供了依據。
炎癥反應是機體常見的一種病理過程,其通常由促炎細胞因子所介導,主要包括IL-1β、TNF-α、IL-6、IL-8等[14]。促炎細胞因子是機體在炎癥早期分泌的一種細胞因子,它能夠直觀反映機體炎癥的發生情況。其中IL-6是由Th2細胞以及單核細胞等產生的一種重要的細胞因子,其致炎作用已經得到證實。IL-1β則是由內皮細胞、成纖維細胞等在應答感染時分泌的細胞因子,它能夠促進B細胞增殖分泌抗體,進而促進免疫調節[15]。本研究發現不同濃度的LLO均能有效刺激細胞產生IL-6、IL-1β,該結果進一步證實了LLO在呼吸道感染中的致炎作用。隨后我們采用抑制劑抑制PI3K/Akt信號通路后,同樣發現LLO刺激產生的IL-6、IL-1β顯著降低,提示LLO刺激產生的炎癥反應也與PI3K/Akt信號通路有關。
綜上所述,本研究通過初步探討LLO刺激16-HEB細胞株產生炎癥反應以及MUC5AC表達的分子機制。發現LLO能夠激活PI3K/Akt 信號通路進而誘導16-HEB細胞株產生炎性因子IL-6、IL-1β,并促進細胞中MUC5AC的表達。這為進一步明確LM的致病機制,開發有效的預防治療藥物奠定了實驗基礎。