利用常壓室溫等離子體誘變選育三孢布拉氏霉菌類胡蘿卜素產(chǎn)量差異菌株
謝錄翰,康春婷,孫菊鮮,侯 婕,葛 欣
(河北大學(xué)生命科學(xué)學(xué)院,河北保定 071002)
β-胡蘿卜素具有較強(qiáng)的抗氧化作用,廣泛應(yīng)用于生物、醫(yī)藥、食品、化妝品等多種領(lǐng)域[1]。三孢布拉氏霉菌(Blakeslea trispora)是目前已知的β-胡蘿卜素和番茄紅素高產(chǎn)菌株,用生物發(fā)酵手段生產(chǎn)的類胡蘿卜素較物理化學(xué)提取手段具有產(chǎn)量高、安全性強(qiáng)、生物活性完全和經(jīng)濟(jì)效益高等多種優(yōu)點(diǎn)。特別值得注意的是,在三孢布拉氏霉菌的代謝途徑中,番茄紅素是生產(chǎn)β-胡蘿卜素的前體物,番茄紅素的生物學(xué)和營(yíng)養(yǎng)學(xué)價(jià)值要更高于β-胡蘿卜素,其具有消除人體自由基、預(yù)防衰老、抗癌抗腫瘤等多種功效[2-3]。
三孢布拉氏霉菌是一種單細(xì)胞多核生物體,菌絲體和孢子在傳代和培養(yǎng)的過(guò)程中易退化。三孢布拉氏霉菌分為正(+)、負(fù)(-)2種單性菌株,負(fù)菌株是番茄紅素生產(chǎn)菌株,正菌株在負(fù)菌的生長(zhǎng)過(guò)程中主要提供三孢酸等性激素來(lái)刺激負(fù)菌株番茄紅素的積累[4]。在單獨(dú)培養(yǎng)正、負(fù)菌株時(shí),番茄紅素產(chǎn)量較低,絕大部分高產(chǎn)和低產(chǎn)菌株顏色差異不顯著,其在初篩過(guò)程中根據(jù)菌絲顏色判斷菌株產(chǎn)量差異較困難。因此,通過(guò)物理化學(xué)等誘變手段篩選產(chǎn)量差異菌株并建立一種較為高效的初篩手段對(duì)于三孢布拉氏霉菌菌株的選育具有重大意義。
目前,常規(guī)的誘變手段有紫外(UV)誘變、亞硝基胍(NTG)誘變、N+注入誘變和常壓室溫等離子體誘變(atmospheric and room temperature plasma,簡(jiǎn)稱ARTP)等,由于三孢布拉氏霉菌是單細(xì)胞多核生物體,不同的誘變手段對(duì)孢子的誘變效率千差萬(wàn)別。Rodriguez等利用紫外線、亞硝基胍和甲基磺酸乙酯(EMS)分別對(duì)B.trispora(+)和B.trispora(-)進(jìn)行復(fù)合誘變,誘變后的負(fù)菌株在添加三孢酸的平板上生長(zhǎng),菌落顏色差異顯著,以此作為番茄紅素產(chǎn)量差異菌株初篩標(biāo)準(zhǔn)[5]。Mehta等通過(guò)NTG處理B.trispora孢子,經(jīng)過(guò)接合培養(yǎng)方式培養(yǎng),獲得產(chǎn)量達(dá)39 mg/g的β-胡蘿卜素的兩性異核體以及番茄紅素環(huán)化酶缺陷型菌株[6]。王強(qiáng)利用N+注入、ARTP和NTG等多種誘變處理方式誘變B.trispora,篩選出了3株高產(chǎn)番茄紅素突變株,番茄紅素產(chǎn)量為0.97 g/L,其高產(chǎn)菌株的hmg R、car RA、car B基因的表達(dá)水平對(duì)比野生型菌株顯著提高[7]。
綜合比較眾多學(xué)者的多種誘變處理方式,發(fā)現(xiàn)ARTP和亞硝基胍的處理措施誘變效果最顯著。由于亞硝基胍對(duì)環(huán)境造成污染以及對(duì)試驗(yàn)人員有致癌威脅,因此,ARTP誘變是較為安全高效的誘變措施。ARTP技術(shù)是采用氦氣為工作氣體的常壓室溫等離子體源,其中含有多種化學(xué)活性粒子成分,如OH、氮分子二正系統(tǒng)、氮分子一負(fù)系統(tǒng)、激發(fā)態(tài)氦原子、氫原子和氧原子等,使三孢布拉氏霉菌成熟孢子的DNA遺傳物質(zhì)損傷,生物體通過(guò)高容錯(cuò)的修復(fù)機(jī)制產(chǎn)生豐富的錯(cuò)配位點(diǎn),進(jìn)而引起突變[8]。
眾多研究學(xué)者對(duì)三孢布拉氏霉菌誘變的研究都集中在篩選高產(chǎn)突變體,往往忽略了負(fù)突變菌株的價(jià)值。由于三孢布拉氏霉菌番茄紅素代謝調(diào)控復(fù)雜,負(fù)突變菌株也能從側(cè)面解析其代謝調(diào)控過(guò)程,所以,無(wú)論是正突變菌株還是負(fù)突變菌株,只要菌絲顏色與野生型存在差異均具有研究?jī)r(jià)值。
三孢布拉氏霉菌隸屬于毛霉目(Mucorales)笄霉科(Choanephoraceae)布拉氏霉菌屬(Blakeslea),其代謝途徑如圖1所示[9-11]。
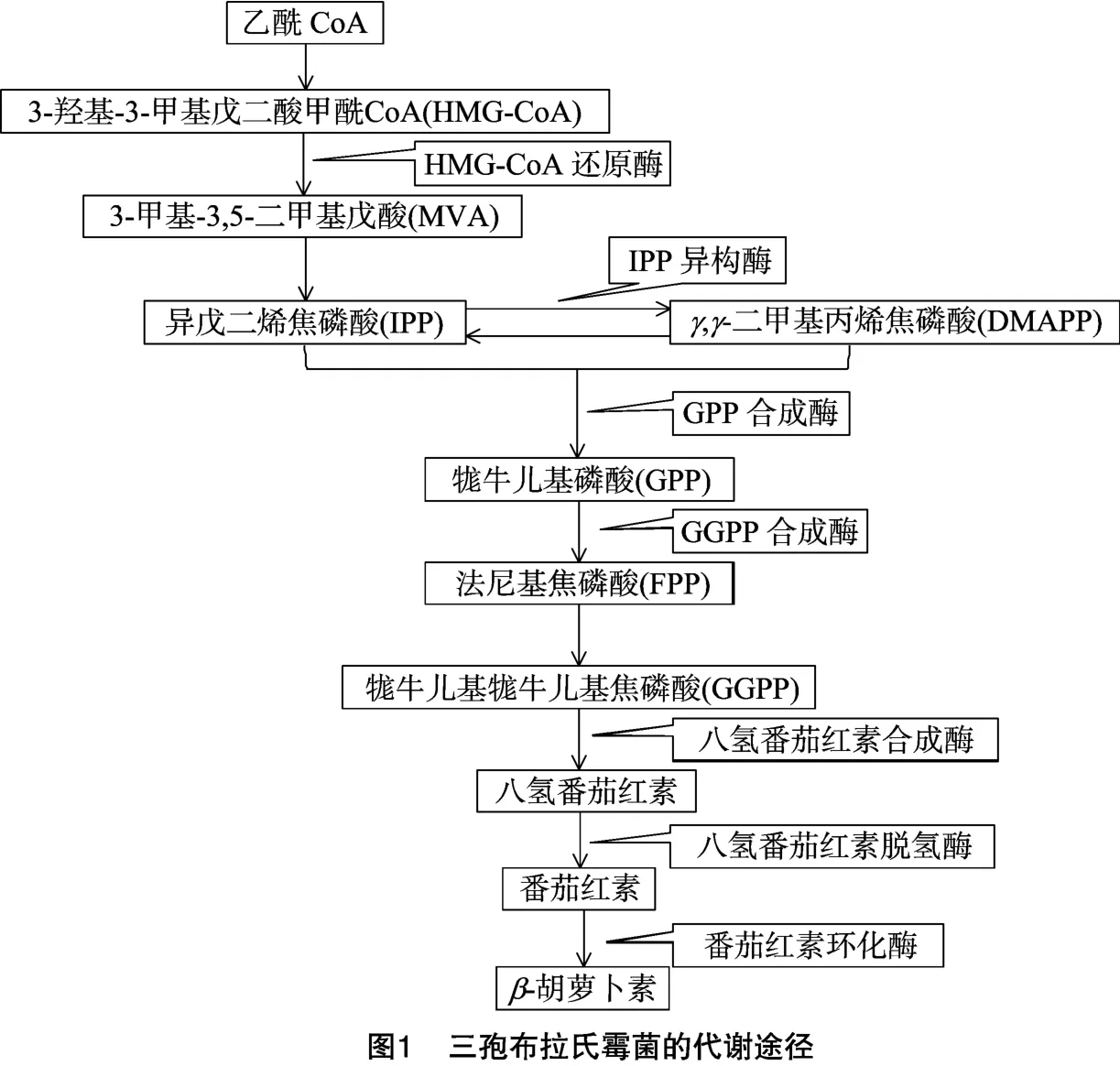
在其復(fù)雜的代謝途徑中,HMG-CoA還原酶是番茄紅素合成過(guò)程中的限速酶。洛伐他汀是一種降血脂藥物,可以抑制HMG-CoA還原酶的活性,從而降低膽固醇等的合成[12]。洛伐他汀平板能夠增加突變效率,形成HMG-CoA還原酶基因突變菌株或HMG-CoA還原酶過(guò)表達(dá)菌株[7]。脫氧膽酸鈉(SDC)可以抑制菌絲體的蔓延,易于突變菌株的計(jì)數(shù)和分離。因此,利用洛伐他汀和SDC的麥芽汁平板培養(yǎng)菌株,通過(guò)顏色差異即β-胡蘿卜素產(chǎn)量差異初篩表型差異菌株,即為β-胡蘿卜素產(chǎn)量差異菌株。
本研究旨在利用ARTP技術(shù)篩選菌絲顏色差異突變體,在洛伐他汀脅迫下篩選β-胡蘿卜素產(chǎn)量差異菌株,高產(chǎn)菌株在工業(yè)方面具有較大利用價(jià)值,高、低產(chǎn)差異性菌株對(duì)于研究其生物代謝途徑、探索色素合成的相關(guān)基因的表達(dá)調(diào)控具有潛在價(jià)值。
1 材料與方法
1.1 試驗(yàn)材料
1.1.1 菌種及藥品 三孢布拉氏霉菌NRRL 2896(-),由筆者所在實(shí)驗(yàn)室保存;洛伐他汀,購(gòu)自黑龍江肇東華富藥業(yè)有限責(zé)任公司;脫氧膽酸鈉,購(gòu)自生工生物工程(上海)股份有限公司。
1.1.2 儀器 ARTP誘變系統(tǒng),購(gòu)自北京思清源生物科技有限公司;SPX型生化培養(yǎng)箱,購(gòu)自寧波東南儀器有限公司。
1.1.3 培養(yǎng)基 產(chǎn)孢培養(yǎng)基(PDA):馬鈴薯200 g/L,葡萄糖20 g/L,瓊脂12 g/L,0.1% SDC。
誘變培養(yǎng)基:5°麥芽汁,12 g/L瓊脂,0.1% SDC。
篩選培養(yǎng)基:5°麥芽汁,12 g/L瓊脂,0.1% SDC,5 mg/L洛伐他汀。
1.2 試驗(yàn)方法
1.2.1 孢子懸液的制備與致死率的計(jì)算 將三孢布拉氏霉菌接種至產(chǎn)孢培養(yǎng)基,28℃培養(yǎng)3~4 d,收集孢子保藏并計(jì)數(shù)。將孢子懸液濃度調(diào)至106個(gè)/mL,取10μL孢子懸液涂于誘變的金屬片上,處理時(shí)間分別為0、40、80、120、160、200、240 s,處理距離為2 mm,氣體流量為10 L/min。將處理后的金屬片轉(zhuǎn)移至EP管中,加入1mL緩沖液,渦旋振蕩2min,充分混合金屬片中的孢子,吸取100μL涂布平板,每組重復(fù)2次。將涂布平板置于28℃培養(yǎng)箱培養(yǎng)2 d,觀察孢子萌發(fā)和菌落生長(zhǎng)狀況,計(jì)數(shù)并計(jì)算致死率,致死率=(對(duì)照菌落數(shù)-誘變菌落數(shù))/對(duì)照菌落數(shù)×100%,并確定ARTP誘變時(shí)間。
1.2.2 顏色差異菌株的初篩與表型性狀穩(wěn)定性的鑒定 誘變菌株在含有5 mg/L洛伐他汀的篩選培養(yǎng)基上生長(zhǎng)2 d,觀察菌絲顏色差異,初篩出與未處理組有較大差異的菌株,劃線篩選培養(yǎng)基平板,傳代并純化,收集孢子獲得傳代后的孢子液。將顏色差異菌株孢子和對(duì)照組涂布誘變培養(yǎng)基平板,生長(zhǎng)2 d,待菌絲長(zhǎng)出后同等條件下繼續(xù)生長(zhǎng)24~48 h,觀察菌絲顏色變化,驗(yàn)證顏色差異菌株表型性狀穩(wěn)定性。
1.2.3 三孢布拉氏霉菌色素的提取與全波長(zhǎng)掃描鑒定 色素提取方法參照文獻(xiàn)[13]并稍作改動(dòng)。接種三孢布拉氏霉菌置于含100 mL 5°麥芽汁的250 mL三角瓶中,在28℃培養(yǎng)箱以200 r/min轉(zhuǎn)速條件下發(fā)酵5 d,紗布過(guò)濾得到菌絲體,無(wú)菌水洗滌3次。將菌絲體置于干燥箱,40℃烘干至恒質(zhì)量,準(zhǔn)確稱取0.1 g菌絲于研缽中,加入0.5 g石英砂,在陰暗避光條件下,向研缽中加入乙酸乙酯充分研磨,將研磨破碎物轉(zhuǎn)移至離心管中,用乙酸乙酯定容至10 mL,充分萃取至菌絲無(wú)色。吸取乙酸乙酯提取的色素,離心取上清,用乙酸乙酯作對(duì)照,測(cè)定色素提取物的全波長(zhǎng)。
1.2.4 β-胡蘿卜素標(biāo)準(zhǔn)曲線的制備與不同突變株色素產(chǎn)量測(cè)定 準(zhǔn)確稱量β-胡蘿卜素10 mg,用少量三氯甲烷溶解,并用乙酸乙酯稀釋定容至10 mL,取此液1 mL,稀釋至100 mL,此時(shí)β-胡蘿卜素的濃度為10 mg/L,即β-胡蘿卜素標(biāo)準(zhǔn)液。吸取β-胡蘿卜素標(biāo)準(zhǔn)液0、1、2、3、4、5、6、7、8、9、10 mL,用乙酸乙酯定容至10 mL。在456 nm處測(cè)定吸光度,制備標(biāo)準(zhǔn)曲線。將發(fā)酵后的菌絲烘干,準(zhǔn)確稱取0.1 g菌絲體,充分研磨后用10 mL乙酸乙酯萃取,離心后吸取上清在456 nm處測(cè)定吸光度,根據(jù)標(biāo)準(zhǔn)曲線換算色素含量,色素含量定義為1 g干質(zhì)量菌絲所含色素的質(zhì)量(mg)。
2 結(jié)果與分析
2.1 誘變處理致死率
為了確定最優(yōu)的ARTP誘變時(shí)間,對(duì)三孢布拉氏霉菌的孢子在同等條件下不同處理時(shí)間進(jìn)行致死率計(jì)算,致死率曲線如圖2所示。隨著ARTP處理時(shí)間的延長(zhǎng),菌落存活數(shù)逐漸降低,致死率呈上升趨勢(shì),ARTP處理時(shí)間小于80 s時(shí),其致死率大幅上升,處理時(shí)間在80~240 s之間時(shí),致死率上升速度減緩,處理240 s時(shí),致死率達(dá)到96%以上。結(jié)果表明,三孢布拉氏霉菌孢子的誘變時(shí)間選擇在160~200 s最佳,此時(shí)致死率在90%左右,能夠滿足誘變條件,理論上可以獲得最佳的誘變菌株。

2.2 誘變處理平板結(jié)果
經(jīng)不同時(shí)間處理的孢子存活率存在差異,其誘變后生長(zhǎng)情況如圖3所示。經(jīng)ARTP誘變處理后,孢子存活率明顯下降,在處理時(shí)間為160~200 s時(shí),100μL涂布誘變孢子液,平板上生長(zhǎng)的菌落數(shù)較少。由于突變具有低概率性和偶然性,當(dāng)菌落數(shù)較少時(shí)不利于突變體的篩選。因此,可以在誘變時(shí)適當(dāng)增加涂布量以保證足夠的誘變孢子存活,從而能夠更好地滿足篩選條件,獲得更為理想的突變體。
2.3 顏色差異菌株性狀表型
根據(jù)以上試驗(yàn)條件確定誘變處理時(shí)間,選擇160、200 s 2個(gè)時(shí)間點(diǎn)作為誘變處理時(shí)間。突變體在含有洛伐他汀的平板上菌絲體呈現(xiàn)不同顏色,挑選的顏色差異突變株與野生型菌株置于同一平板上培養(yǎng),觀察菌絲顏色差異,其顏色差異情況如圖4所示。洛伐他汀擴(kuò)大了突變株的顏色差異,在含有洛伐他汀的誘變平板中,突變體大致呈現(xiàn)出4種顏色,分別為深黃色、黃色、淺黃色、白色;初篩的突變株在不含洛伐他汀的平板中,菌絲顏色與野生型菌株相比顏色差異明顯,表現(xiàn)為深黃色、黃色、淺黃色、白色。
2.4 顏色差異菌株傳代純化
突變體由于自身基因的非特異性改變,部分菌株不能維持原有的色素產(chǎn)量,直觀地表現(xiàn)為菌株顏色與篩選初期不一致。為保證突變菌株的穩(wěn)定性,挑選多株突變菌株傳代培養(yǎng),經(jīng)傳代后部分菌株表型性狀改變,挑選表型性狀穩(wěn)定菌株傳代5次,復(fù)篩突變體,部分表型性狀穩(wěn)定菌株傳代后如圖5所示,顏色差異各組經(jīng)純化和傳代后,菌落顏色差異明顯,顏色表現(xiàn)為深黃色、黃色、淺黃色和白色等4種類別,其中深黃色的正突變菌株和白色的負(fù)突變菌株顏色差異明顯。
2.5 顏色差異性菌株表型性狀穩(wěn)定性
為了驗(yàn)證顏色差異菌株表型性狀穩(wěn)定性,選取深黃色和白色2種類別菌株為代表進(jìn)行持續(xù)培養(yǎng),多時(shí)間段觀察其表型變化,其結(jié)果如圖6所示,A組為對(duì)照組,在平板上生長(zhǎng)2 d后,對(duì)照組菌絲顏色呈暗黃色,持續(xù)生長(zhǎng)24~48 h后顏色穩(wěn)定;B組為深黃色突變株,生長(zhǎng)2 d后菌絲顏色為深黃色,持續(xù)生長(zhǎng)24 h后菌絲顏色加深,持續(xù)生長(zhǎng)48 h后菌絲顏色與持續(xù)生長(zhǎng)較24 h后菌絲顏色無(wú)明顯差異;C組為白色菌株突變株,生長(zhǎng)2 d后菌絲顏色為白色,持續(xù)生長(zhǎng)24~48 h菌絲顏色仍為白色。


2.6 不同顏色突變株產(chǎn)孢能力差異性
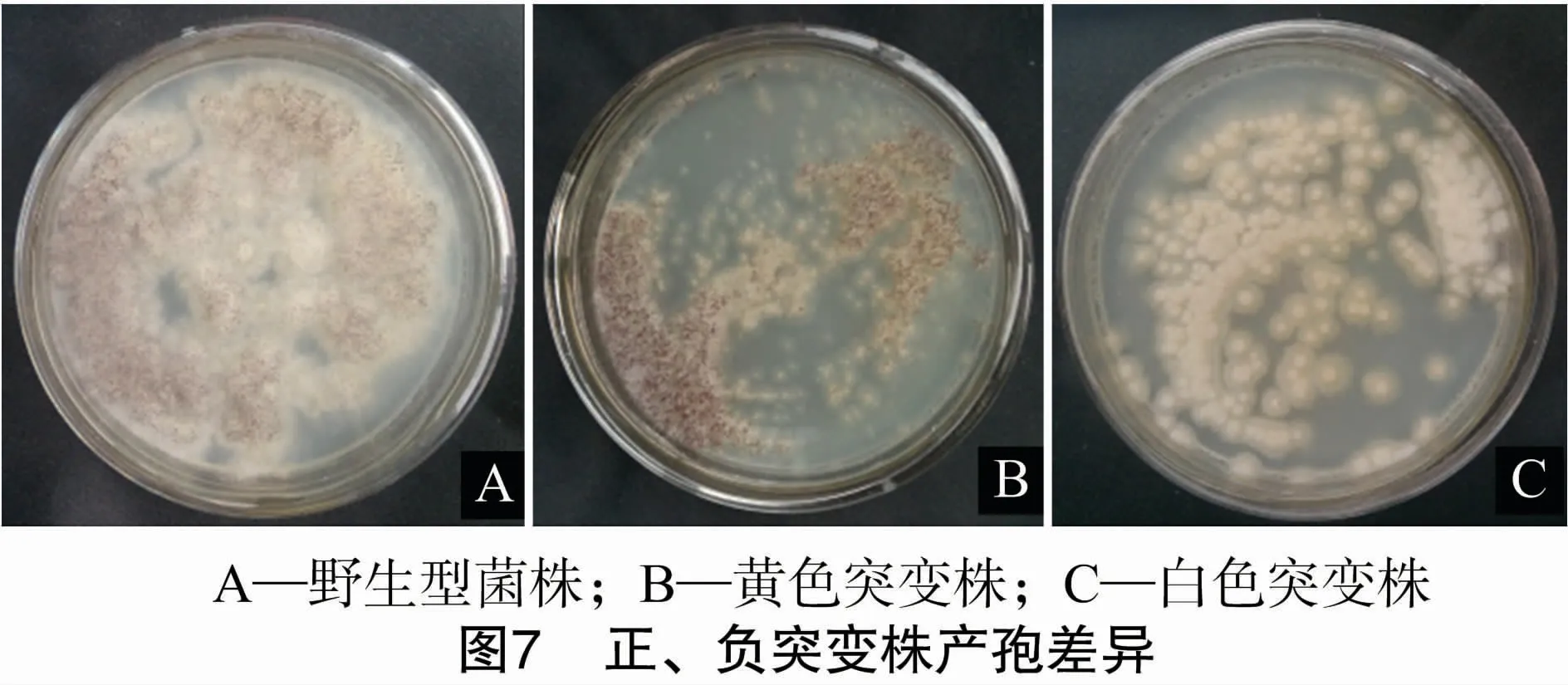
為保存顏色差異突變株,在PDA平板上培養(yǎng)菌體使其產(chǎn)孢,獲得可保存的孢子,不同顏色差異菌株的產(chǎn)孢情況如圖7所示,A組為對(duì)照組,經(jīng)產(chǎn)孢培養(yǎng)后孢子大量產(chǎn)生;B組為黃色突變株,產(chǎn)孢能力與對(duì)照組無(wú)明顯差別;C組為白色突變株,經(jīng)產(chǎn)孢培養(yǎng)后產(chǎn)孢能力明顯下降,幾乎不產(chǎn)孢。
2.7 三孢布拉氏霉菌色素全波長(zhǎng)掃描

為確定三孢布拉氏霉菌菌絲中色素的吸收波長(zhǎng),將菌絲研磨破碎,提取色素全波長(zhǎng)掃描,其全波長(zhǎng)掃描結(jié)果如圖8所示,色素在456 nm處具有最大吸光度,因此,此波長(zhǎng)下的吸光強(qiáng)度可以用于表征色素的特征吸收光譜,依據(jù)文獻(xiàn)[13-15]所述,于450 nm左右產(chǎn)生的吸光度主要由β-胡蘿卜素產(chǎn)生,可以用來(lái)表征該色素的濃度。
2.8 制備β-胡蘿卜素標(biāo)準(zhǔn)曲線
為通過(guò)吸光強(qiáng)度測(cè)定β-胡蘿卜素的產(chǎn)量,通過(guò)不同濃度色素的吸光度制備標(biāo)準(zhǔn)曲線,根據(jù)試驗(yàn)操作選取的β-胡蘿卜素濃度為0、1、2、3、4、5、6、7、8、9、10 mg/L,β-胡蘿卜素濃度(x)與吸光度(y)呈線性關(guān)系,其方程為y=0.072 5x-0.018 5,r2=0.997 9。通過(guò)標(biāo)準(zhǔn)曲線,結(jié)合本試驗(yàn)方法,其色素含量計(jì)算公式如下:
色素含量=[(D+0.018 5)÷0.072 5]×10÷1 000÷0.1。
其中:D為吸光度。
2.9 不同突變株色素產(chǎn)量
由于三孢布拉氏霉菌的菌絲色素成分是復(fù)雜的,在450 nm左右的吸光度主要由β-胡蘿卜素產(chǎn)生,所以可以通過(guò)β-胡蘿卜素的標(biāo)準(zhǔn)曲線測(cè)定菌絲中色素含量。根據(jù)上述試驗(yàn)步驟,其突變株在平板中存在顏色差異,挑選不同突變株對(duì)其菌體色素含量測(cè)定,根據(jù)β-胡蘿卜素標(biāo)準(zhǔn)曲線測(cè)定色素含量,其結(jié)果如表1所示,菌株1和菌株5的顏色與對(duì)照組相比為黃色,菌株10與對(duì)照組相比為白色。菌株1和菌株5為β-胡蘿卜素高產(chǎn)菌株,在未進(jìn)行任何培養(yǎng)條件優(yōu)化的前提下,β-胡蘿卜產(chǎn)量分別提高48.6%、40.4%;菌株10為負(fù)突變菌株,β-胡蘿卜產(chǎn)量下降16.5%。
3 討論
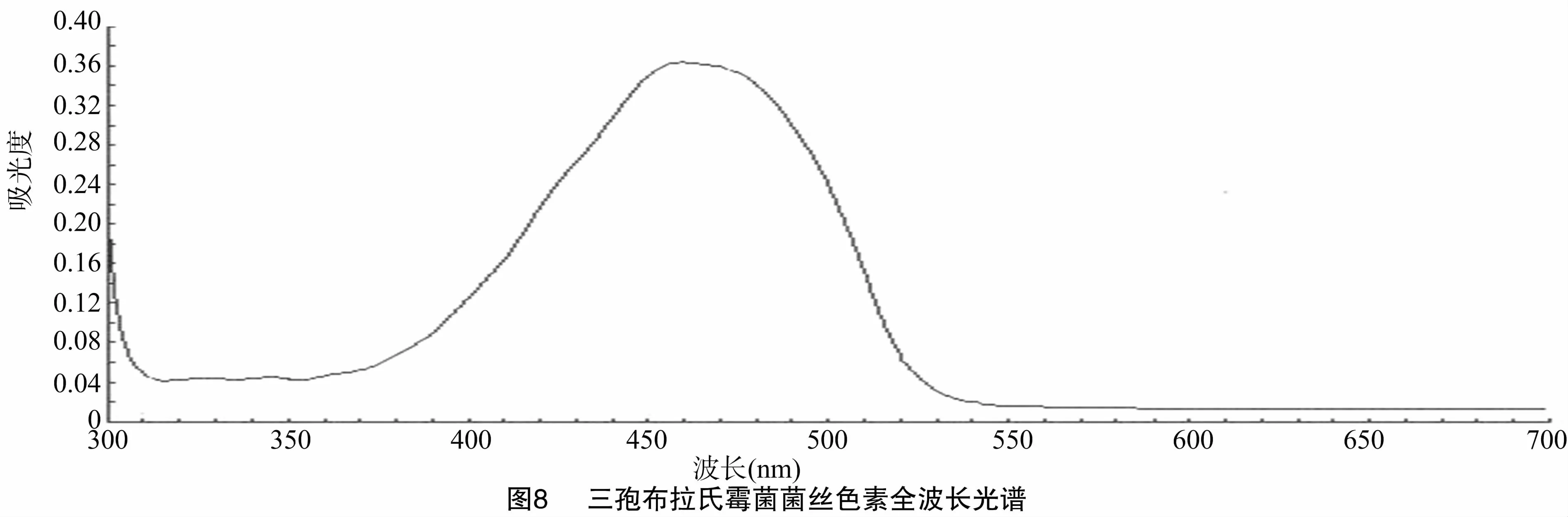
ARTP誘變系統(tǒng)處理三孢布拉氏霉菌孢子其致死率隨處理時(shí)間的延長(zhǎng)逐漸增加,這與王強(qiáng)所做的不同ARTP處理時(shí)間下三孢布拉氏霉菌存活率的結(jié)果[7]基本一致,在處理160~200 s時(shí),致死率在90%以上,正負(fù)突變株在平板上顏色明顯。洛伐他汀平板上生長(zhǎng)的對(duì)照組顯淺黃色,誘變處理的突變株在平板上表現(xiàn)出顏色差異,ARTP誘變后的洛伐他汀選擇壓力能夠使菌落產(chǎn)生較為明顯的顏色差異,與未誘變的對(duì)照組相比,將顏色差異菌株分為4等,分別為深黃色、黃色色、淺黃色和白色,且正突變效率高于負(fù)突變效率,可能的原因是洛伐他汀有助于篩選HMG-CoA還原酶過(guò)表達(dá)菌株,從而增強(qiáng)其代謝途徑,促進(jìn)正突變。純化后菌株顏色差異明顯,純化后的菌株在傳代過(guò)程中部分菌株表型性狀改變,主要表現(xiàn)在負(fù)突變菌株顏色加深回歸至野生型狀態(tài),部分菌株傳代后表型性狀穩(wěn)定性較強(qiáng),與原性狀保持一致,其顏色表型與色素產(chǎn)量吻合。三孢布拉氏霉菌的菌絲中色素經(jīng)乙酸乙酯萃取后,其最高吸收峰位于456 nm處,這和顧秋亞[13]、王洪波[14]、劉星等[15]測(cè)定的菌絲中β-胡蘿卜素含量的波長(zhǎng)基本一致,均在450 nm附近,此波長(zhǎng)下吸光度主要由β-胡蘿卜素產(chǎn)生,但由于菌絲中色素成分復(fù)雜,β-胡蘿卜素含量是高估的。在產(chǎn)孢培養(yǎng)過(guò)程中,正突變菌株產(chǎn)孢明顯,負(fù)突變菌株基本不產(chǎn)孢,可能是負(fù)突變菌株抗逆性增強(qiáng),其產(chǎn)孢差異原因還需深入研究。

表1 不同突變株色素產(chǎn)量及顏色表型
4 結(jié)論
建立了三孢布拉氏霉菌ARTP誘變顏色差異菌株篩選手段,在洛伐他汀脅迫下獲得了顏色差異明顯、遺傳性狀穩(wěn)定的突變株共10株,其中深黃4株、黃色3株、淺黃2株、白色1株,正突變株產(chǎn)量上升48.6%,負(fù)突變株產(chǎn)量下降16.5%。

