高質量酒曲的制備工藝及酒曲活力評價
張翠翠,郭 波,陳雅軒,余永強,周世水*
(1.華南理工大學生物科學與工程學院,廣東廣州 510006;2.廣東省石灣酒廠集團有限公司,廣東佛山 528200)
酒的質量很大程度上取決于酒曲質量。酒曲中含有多種微生物及其產生的復雜酶系,是中國白酒釀造必不可少的糖化劑、發酵劑和生香劑[1]。
酒曲作為糖化劑,具有豐富的淀粉酶。常見的淀粉酶可分為α-淀粉酶(也稱液化酶)、β-淀粉酶、葡萄糖淀粉酶(也稱γ-淀粉酶,簡稱糖化酶)和異淀粉酶等[2]。米根霉是大曲中的主要根霉,含有極為豐富的糖化型淀粉酶[3]。黑曲霉是產生葡萄糖淀粉酶的典型菌株,大多數黑曲霉的糖化酶能水解80%以上的淀粉[4]。黑曲霉和米根霉能將淀粉轉化為可發酵性糖,是糖化菌種。
根據制曲工藝不同,將酒曲可分為大曲、小曲、麩曲等。其中,麩曲因其制作周期短、出酒率高、節約糧食、成本低等優點而被廣泛應用,但用量一旦加大,麩皮本身帶有的澀感會影響蒸餾白酒的口感。筆者以黑曲霉和米根霉為菌種制曲,以提高酒曲質量為目的優化培曲條件,并用甜米酒和米酒相關指標來評價酒曲活力,以期為后續白酒生產提供建設性指導。
1 材料與方法
1.1材料
1.1.1菌種。釀酒酵母、黑曲霉和米根霉均由華南理工大學發酵工程實驗室保存;酒曲來自A酒廠和B酒廠。
1.1.2培養基。①酵母浸出粉胨葡萄糖培養基:葡萄糖 20 g/L,酵母浸膏 10 g/L,蛋白胨 20 g/L。②PDA培養基:用于黑曲霉和米根霉的培養。馬鈴薯200 g/L,葡萄糖 20 g/L,瓊脂 15~20 g/L。③米酒發酵培養基:稱取20 g糯米裝入250 mL高形燒杯中,加入50 mL水浸泡8 h,115 ℃下滅菌20 min。
1.1.3儀器與設備。TGL-18C高速臺式離心機,為上海安亭科學儀器廠產品;UV-2700紫外可見分光光度計,為島津儀器(蘇州)有限公司產品。
1.2方法
1.2.1酒曲制作和制曲條件優化。將制曲原料裝入250 mL三角瓶,0.1 MPa滅菌30 min,分別接入7.5×107CFU/mL的黑曲霉和米根霉孢子液后培養。以糖化酶酶活和液化酶酶活為指標,進行裝料量(6、10、14、18、22 g),培曲時間(1、2、3、4、5、6 d),原料組成(大米、大麥芽、麩皮,其中大米∶麩皮=1∶1,大米∶大麥芽=1∶1,大麥芽∶麩皮=1∶1,大米∶麩皮∶大麥芽=1∶1∶1)優化試驗。
1.2.2甜米酒生產工藝流程。甜米酒生產工藝流程如圖1所示。其中黑曲霉曲與米根霉曲按1∶5的比例混合,接種時酒曲添加量為1%(質量百分比)。

圖1 甜米酒生產工藝流程Fig.1 The production process of sweet rice wine
1.2.3米酒發酵。采用“1.2.2”方法將米酒糖化一段時間,接入釀酒酵母3%(v/v)發酵一段時間后測定酒精度。
1.2.4糖化發酵試驗。測定酒廠A和酒廠B的酒曲與該試驗酒曲的糖化酶和液化酶酶活大小,并在相同試驗條件下進行糖化發酵試驗,測定生成的總糖、還原糖含量和發酵后酒精度。
1.2.5酒曲活力評價。選取不同液化酶酶活的米根霉曲和不同糖化酶酶活的黑曲霉曲各5種,標記為1#~5#,不同酒曲組合發酵試驗,選取黑曲霉1#,分別混合米根霉曲1#~5#配制酒曲;同理選取米根霉曲1#,分別混合黑曲霉曲1#~5#配制酒曲。按照“1.2.2”方法進行甜米酒試驗,再按照“1.2.3”方法進行米酒發酵試驗。根據測得的糖化酶和液化酶酶活及總糖、還原糖含量、酒精度,綜合評價酒曲活力。
1.3測定項目與方法
1.3.1酶活。粗酶液的制備按照文獻[5]的方法進行。液化酶酶活的測定參照文獻[6]的方法;糖化酶酶活的測定參照文獻[7]的方法。
1.3.2總糖含量和酒精度。參照文獻[8]的方法測定總糖含量和酒精度。
1.3.3還原糖含量。參照文獻[9]的方法測定還原糖含量。
2 結果與分析
2.1糖化酶和液化酶酶活測定結果
2.1.1米根霉曲和黑曲霉曲產酶酶活比較。由圖2可知,黑曲霉曲的液化酶活性低,糖化酶活性高,而米根霉曲則相反。在以下試驗中用黑曲霉曲測定糖化酶酶活,用米根霉曲測定液化酶酶活。
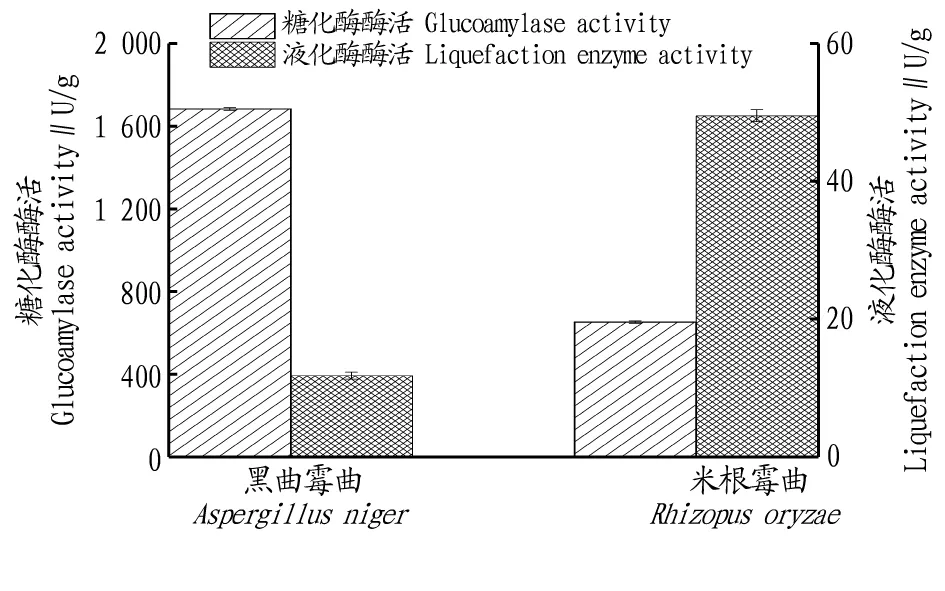
圖2 黑曲霉曲和米根霉曲產酶酶活的比較Fig.2 Comparison of enzyme activities between A.niger and R.oryzae
2.1.2裝料量對糖化酶和液化酶酶活的影響。米根霉曲和黑曲霉曲的生長環境需要一定的氧氣、溫度和濕度,三角瓶獨特的內部環境能保證曲菌生長所需條件。米根霉和黑曲霉生長繁殖需要足夠的空氣,而且酶的生成量也與空氣供給量有關。瓶內底層原料堆積高度也會影響曲菌與空氣的總接觸面積。由圖3可知,裝料量為10 g時對二者酶活的影響最大,其中米根霉曲液化酶酶活達到56 U/g,黑曲霉曲糖化酶酶活達到1 140 U/g。
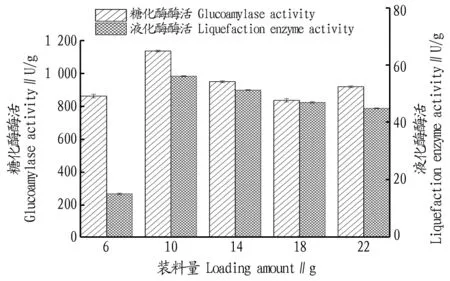
圖3 不同裝料量對液化酶和糖化酶酶活的影響Fig.3 The effects of different loading amount on the activities of liquefaction enzyme and glucoamylase
2.1.3酒曲培養時間對液化酶和糖化酶酶活的影響。 曲霉菌是一邊生長一邊產酶,曲霉培養的最終目的是使其酶活較高,以便獲得較高的起酵力。酒曲培養時間會影響米根霉和黑曲霉菌絲體和孢子的數量。若培養時間過長,曲霉的營養物質減少,不利于曲霉的生長和產酶。菌絲體較多而含孢子數較少的根霉曲產品由于具有較高的糖化酶活性,接種后有利于根霉孢子的萌發和菌絲體的前期生長[10]。由圖4可知,黑曲霉曲的最佳培養時間為5 d,米根霉曲的最佳培養時間為4 d。
2.1.4酒曲原料對液化酶和糖化酶酶活的影響。曲霉菌在生長過程所需的碳源以淀粉最佳,曲霉的菌體及其所含酶類是由蛋白質組成,制曲需要足夠的氮源[11]。制曲原料麩皮中含有豐富的淀粉、粗蛋白和灰分等營養物質,足以供制曲需要。麩皮還含有多種維生素和金屬離子,在發酵過程中既可為菌株生長提供碳源,又能提供氮源,其中還含有一定量的果膠,為糖化酶的產生起到一定的誘導作用[4];大米的主要營養物質為蛋白質、脂肪和淀粉,而大麥芽含有豐富的酶類,經高溫滅菌后可提供豐富的氮源。由圖5可知,黑曲霉曲糖化酶酶活最高的制曲原料為麩皮∶大麥芽(1∶1),米根霉曲液化酶酶活最高的制曲原料為麩皮。
2.2糖化發酵試驗結果
2.2.1甜米酒糖化試驗。采用“1.2.2”中甜米酒制作方法,每隔2 h測定甜米酒中總糖含量,繪制糖化曲線。米根霉和黑曲霉有邊生長邊產酶糖化的特點,產糖化型淀粉酶將糯米中淀粉最終轉變為可發酵性糖。由圖6可知,在糖化前期,因為酒曲液化酶酶活和糖化酶酶活較高,生成可發酵性糖的增長速度較快;在糖化中期,隨著糯米中淀粉濃度的下降和糖分提高,對曲霉生長產生抑制作用,糖化速度逐漸減慢,18 h總糖含量達到最大值,為17.5%;在糖化后期,米根霉和黑曲霉生長量達到最大值,在產糖化型淀粉酶的同時也能產酸,會將可發酵性糖轉變為酸類物質,導致總糖含量下降。如果進行先糖化后發酵試驗可在糖化18 h后接入釀酒酵母,以最大程度產生乙醇。
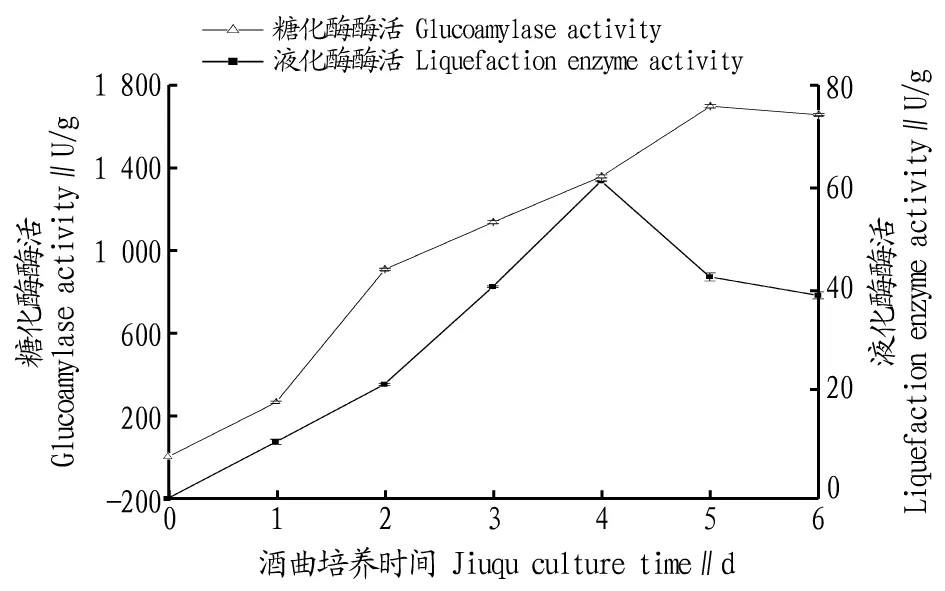
圖4 酒曲培養時間對液化酶和糖化酶酶活的影響Fig.4 The effects of culture time of jiuqu on the activities of liquefaction enzyme and glucoamylase
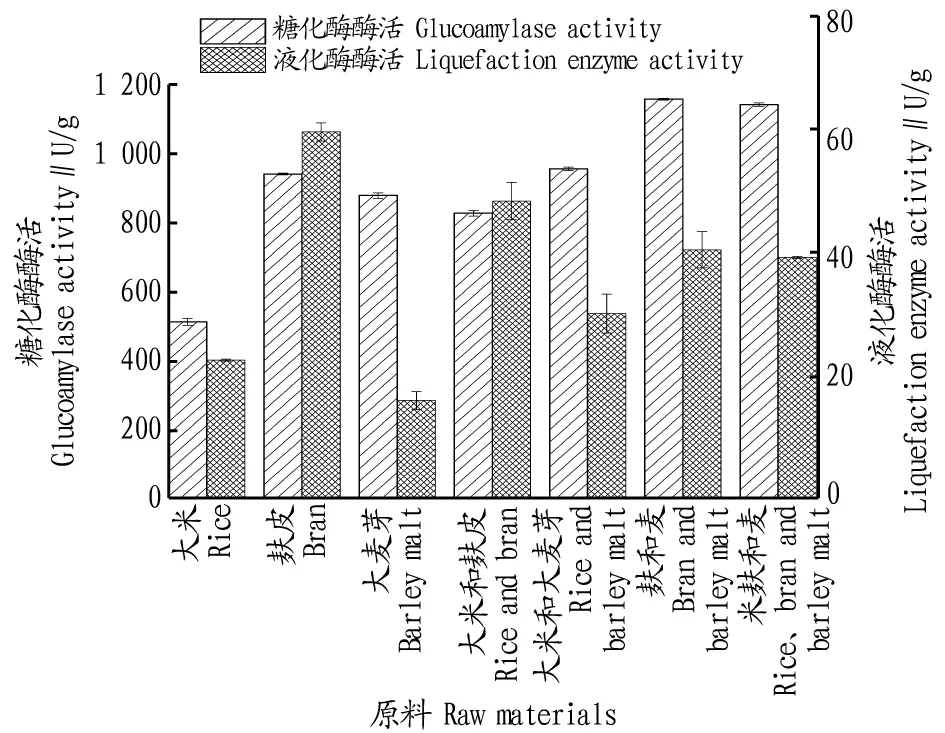
圖5 酒曲原料對液化酶和糖化酶酶活的影響Fig.5 The effects of jiuqu’s raw materials on activities of liquefaction enzyme and glucoamylase
2.2.2米酒發酵試驗結果。甜米酒糖化18 h后,接入釀酒酵母進行米酒發酵試驗,結果見圖7。曲霉菌除具有較強的糖化力外,還兼有一定的發酵力[12]。由圖7可知,在沒有釀酒酵母接入時也會產生少量的乙醇,酒精度在發酵3 d前增長速度快,此后增長速度趨慢。隨著發酵的推進,增加乙醇量會對釀酒酵母產生抑制作用,發酵體系也會利用分解乙醇產生酸或醛等其他代謝物質,酒精度增加一定量后會慢慢下降。
2.3不同酒曲對比試驗結果由圖8可知,米根霉曲液化酶酶活高于A廠和B廠酒曲。米根霉曲液化酶酶活比A廠酒曲高179.5%,比B廠酒曲高163.1%。
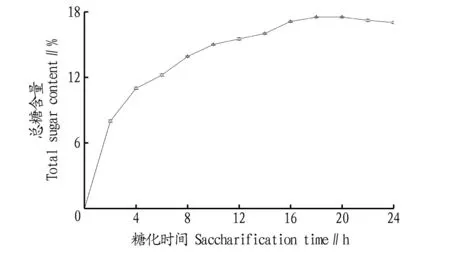
圖6 甜米酒糖化曲線Fig.6 The saccharification curve of sweet rice wine
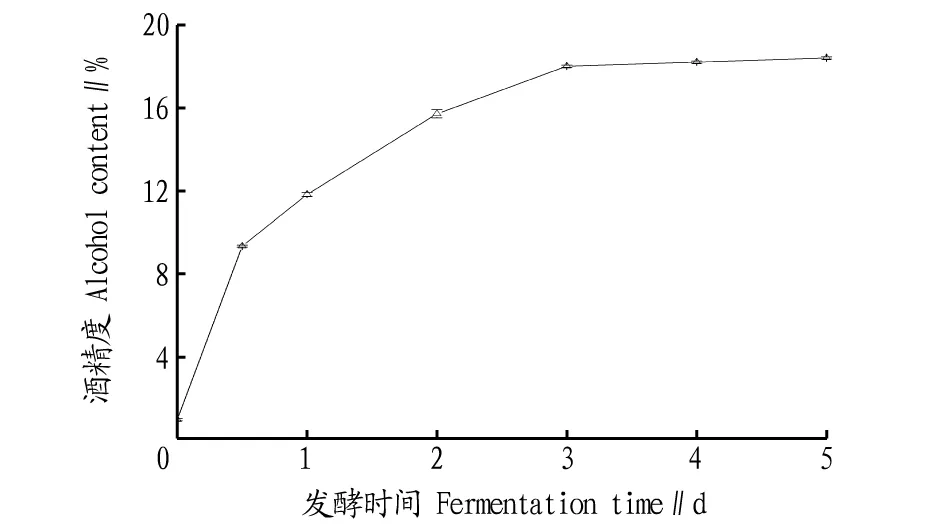
圖7 米酒發酵產酒精度的變化曲線Fig.7 The variation curve of alcohol content produced by rice wine fermentation
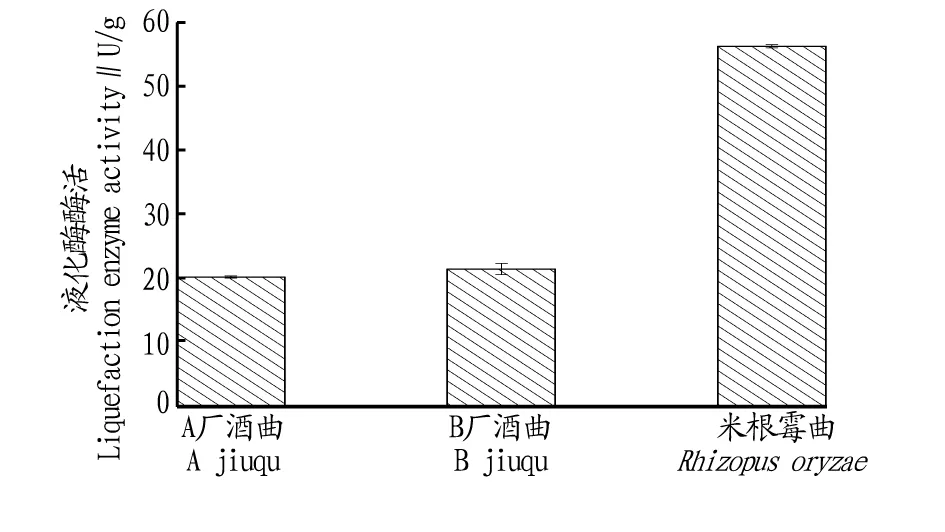
圖8 不同酒曲的液化酶酶活大小比較Fig.8 Comparison of liquefaction enzyme activities among different jiuqu
由圖9可知,黑曲霉曲糖化酶酶活高于A廠和B廠酒曲;黑曲霉曲糖化酶酶活比A廠酒曲高12.4%,比B廠酒曲高122.1%。
由圖10可知,在相同試驗條件下以該研究中酒曲為對照組進行糖化發酵試驗,糖化18 h后對照組還原糖含量最高,發酵3 d后對照組酒精度最高。其中該試驗酒曲產生的還原糖含量比添加A廠酒曲生成的還原糖含量高11.9%,比添加B廠酒曲生成的還原糖含量高169.2%;發酵酒精度比添加A廠酒曲生成的酒精度高6.4%,比添加B廠酒曲生成的酒精度高30.1%。
2.4糖化酶和液化酶酶活與總糖含量、還原糖含量、酒精度的關系分析在甜米酒糖化18 h接入釀酒酵母,按照“1.2.5”中試驗組合進行米酒發酵,3 d后蒸餾測定酒精度。由表1可知,在不同酒曲組合中,加入相同的黑曲霉曲使糖化酶酶活不變的情況下加入不同液化酶酶活的米根霉曲,結果發現起始液化酶酶活高的試驗組分解淀粉生成麥芽糖、糊精等物質的數量多,起始糖化酶酶活力相同的情況下最終轉變為可發酵性糖數量較多,從而米酒發酵產酒精度高。
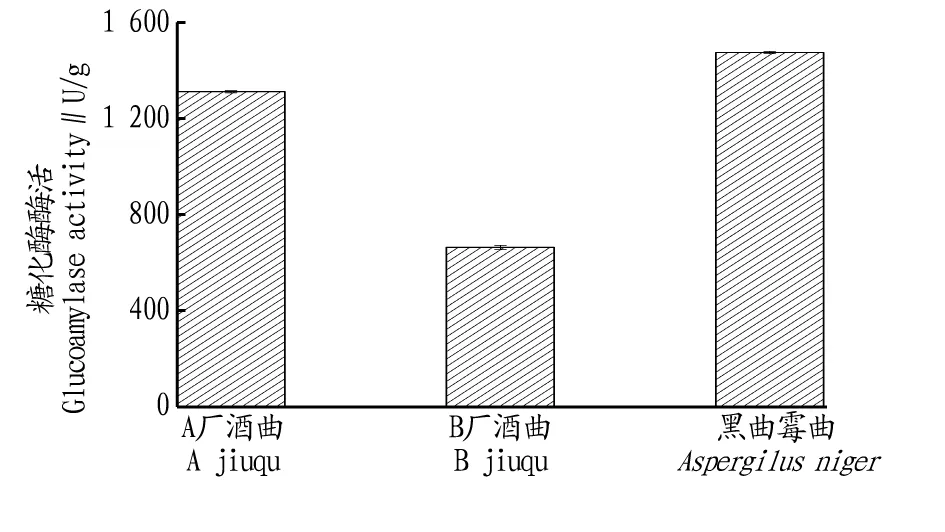
圖9 不同酒曲的糖化酶酶活比較Fig.9 Comparison of saccharification enzyme activities among different jiuqu
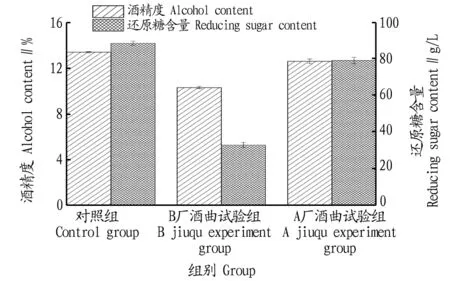
圖10 不同酒曲糖化發酵試驗結果的比較Fig.10 The comparison of saccharification and fermentation experiment results among different jiuqu
Table1Relationshipbetweenliquefactionenzymeactivityandtotalsugarcontent,reducingsugarcontentandalcoholcontent
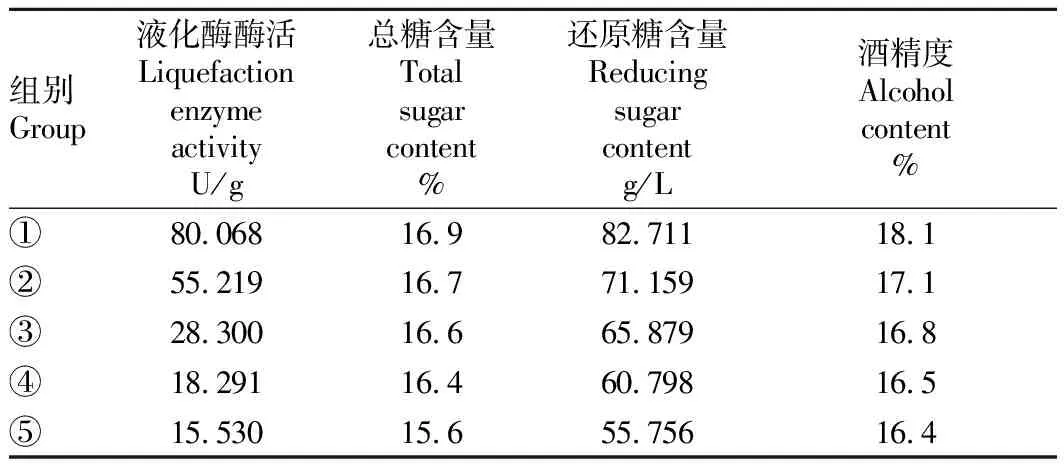
組別Group液化酶酶活Liquefaction enzyme activityU/g總糖含量Total sugarcontent%還原糖含量Reducing sugar contentg/L酒精度Alcohol content%①80.06816.982.71118.1②55.21916.771.15917.1③28.30016.665.87916.8④18.29116.460.79816.5⑤15.53015.655.75616.4
由表2可知,在不同酒曲組合中,當米根霉曲不變時加入糖化酶酶活不同的黑曲霉曲,結果發現起始糖化酶酶活高的試驗組可發酵性糖的含量較高,米酒發酵產酒精度高。
由表1、表2可知,甜米酒培菌糖化過程中,米根霉和黑曲霉邊生長、邊產酶、邊糖化,起始酶活高的試驗組最終生成可發酵性糖多。在甜米酒試驗的基礎上添加釀酒酵母,起始酶活高的試驗組發酵產酒精度高。因此,通過甜米酒和米酒發酵試驗可確定酒曲起始酶活,用于判斷酒曲活力。
表2糖化酶酶活與總糖含量、還原糖含量和酒精度的關系
Table2Relationshipbetweenglucoamylaseactivityandtotalsugarcontent,reducingsugarcontentandalcoholcontent
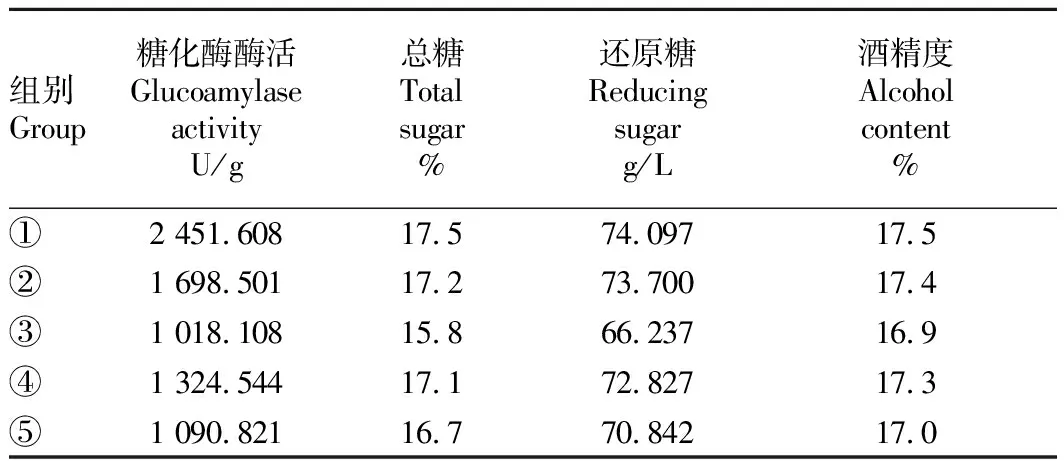
組別Group糖化酶酶活Glucoamylase activityU/g總糖Total sugar%還原糖Reducing sugarg/L酒精度Alcohol content%①2 451.60817.574.09717.5②1 698.50117.273.70017.4③1 018.10815.866.23716.9④1 324.54417.172.82717.3⑤1 090.82116.770.84217.0
3 結論
筆者研究高質量酒曲與酒曲中黑曲霉的糖化酶活、米根霉的液化酶酶活的關系,在保證氧氣、濕度和溫度的條件下,250 mL三角瓶裝料量10 g時米根霉曲和黑曲霉曲的生長產酶酶活較高,其中黑曲霉曲培養5 d,制曲原料為麩皮∶大麥芽(1∶1)時獲得糖化酶酶活最高,達到1 640 U/g;米根霉曲培養4 d,培曲原料為麩皮時獲得液化酶酶活最高,達到56 U/g。該研究中酒曲酶活均高于A廠酒曲和B廠酒曲。
將制備的酒曲進行甜米酒試驗,糖化時間為18 h時總糖含量最高達到17.5%,繼續進行米酒發酵試驗,發現米酒前3 d酒精度增加速度最快,發酵5 d酒精度達到18.4%。該研究酒曲糖化后還原糖含量為88 g/L,均高于A廠和B廠酒曲,3 d后發酵酒精度為13.4%,也高于添加A廠和B廠酒曲。因此,不同酒曲組合試驗結果表明起始糖化酶和液化酶酶活高,開始的糖化力較快,糖化速度快,產生可發酵性糖的數量較多,發酵產乙醇多。
酒曲質量與液化酶、糖化酶酶活有關,改變酒曲培養條件可以提高酒曲中液化酶和糖化酶酶活;通過測定酒曲的起始酶活以及甜米酒糖化和米酒酒精發酵,可綜合判定酒曲的活力。

