甘草查爾酮A調控人結腸癌細胞增殖與凋亡的分子機制研究①
張九成 陳衛東 鄒 寧
(湖北省腫瘤醫院腹部放療二病區,湖北省結直腸癌臨床醫學研究中心,武漢 430079)
結腸癌是最常見的胃腸道癌癥之一[1]。近些年,隨著經濟的快速增長及人們生活方式的改變,尤其是飲食結構的變化,結腸癌已成為發病率上升最快的惡性腫瘤之一,嚴重威脅著人們的生命與健康。已有研究顯示,結腸癌的死亡率已躍居全世界癌癥死亡率的第二位,在我國也已達到第四位[2]。目前,結直腸癌治療的主要手段有手術切除、放療、化療,但由于其高發生率,低治愈率以及較差的預后,這些治療手段并不是十分理想,所以迫切需要尋找新的治療策略來提高結腸癌患者的生存率[3]。天然產物作為抗腫瘤藥物的重要來源,具有效果顯著、機制獨特、毒副作用小等優勢[4]。因此,尋找作用效果好且毒副作用低的抗結腸癌天然產物具有很好的科學意義和臨床價值。
甘草在我國藥用歷史悠久,在傳統醫學中被廣泛應用。甘草查爾酮A(Licochalcone A,LCA)是從甘草植物中提取的一種黃酮類化合物,主要分布在甘草的根和莖中,具有多種藥理活性,如抗癌、抗炎、抗氧化和調節免疫等[5]。近年來研究表明LCA具有良好的抗腫瘤活性,對肺癌、胃癌、宮頸癌等均顯示出較好的抑制作用[6]。LCA主要通過誘導腫瘤細胞周期阻滯和凋亡等途徑來選擇性地抑制多種腫瘤細胞生長[7]。此外,也有研究表明氧化應激在LCA的抗腫瘤活性中發揮著重要作用[8]。因此,本研究將進一步驗證LCA良好的抗腫瘤活性,并闡明其具體的分子作用機制,旨在為結直腸癌的治療提供新藥物及靶標。
1 材料與方法
1.1材料
1.1.1實驗材料 細胞株:人結腸癌HCT116細胞株(貨號:ATCCCCL-247)購自美國菌種保藏中心;SW480(貨號:TCHu172)細胞株購自中科院細胞庫。
實驗試劑:RPMI1640培養基(貨號:11875101)、胎牛血清(貨號:26140079)、青霉素-鏈霉素(貨號:15140148)購自美國Gibco公司;LCA購自成都瑞芬思生物科技有限公司(純度≥98%,貨號:58749-22-7);MTT細胞增殖及細胞毒性檢測試劑盒(貨號:M1020-500)購自北京索萊寶科技有限公司;Annexin V-FITC/PI雙染細胞凋亡檢測試劑盒(貨號:KGA106)購自江蘇凱基生物技術股份有限公司;ROS抑制劑NAC(純度>99%,貨號:S0077)、活性氧ROS檢測(DCFH-DA探針法)試劑盒(貨號:S0033)購自上海碧云天生物技術有限公司;BCA法蛋白定量測定試劑盒(貨號:A045-3)及全蛋白提取試劑盒(貨號:W034)購自南京建成生物技術有限公司;抗ATF6抗體(貨號:24169-1-AP)、抗XBP-1抗體(貨號:25997-1-AP)、抗ATF4抗體(貨號:10835-1-AP)、抗CHOP抗體(貨號:15204-1-AP)、抗Bcl2抗體(貨號:26593-1-AP)、抗Bax抗體(貨號:50599-2-Ig)、抗GAPDH抗體(貨號:10494-1-AP)的兔多克隆一抗以及山羊抗兔IgG二抗(貨號:10285-1-AP)購自武漢三鷹生物技術有限公司;Anti-active Caspase3抗體(貨號:ab2302)購自Abcam公司。
1.1.2主要儀器 3111型CO2培養箱(Thermo,美國)、倒置顯微鏡(尼康,日本)、凝膠處理分析系統(ABI,美國)、低溫冷凍離心機(Eppendorf,德國)、酶標儀(Bio-Tek,美國)、FC500型流式細胞儀(Beckman,美國)等。
1.2方法
1.2.1細胞培養 人結腸癌細胞HCT116和SW480均培養在含有10%胎牛血清、青霉素100 U/ml、鏈霉素100 μg/ml的RPMI1640完全培養基中;培養條件:37℃,CO2體積分數為5%飽和濕度的培養箱中培養。根據細胞生長狀態定期換液,待細胞接近長滿培養瓶底部時,用0.25%的胰酶消化傳代。在正式實驗開始之前,需對細胞進行同步化培養處理后再進行分組及藥物處理。
1.2.2MTT法檢測LCA對HCT116和SW480的增殖抑制作用 取生長處于對數期的HCT116或SW480細胞,按照1.0×105ml-1濃度接種于96孔培養板中。將細胞分為7組,分別為空白對照組、1.0 μmol/L 的LCA藥物組、2.5 μmol/L的LCA藥物組、5 μmol/L的LCA藥物組、10 μmol/L的LCA藥物組、25 μmol/L的LCA藥物組以及50 μmol/L的LCA藥物組,每組設置3平行復孔。37℃,CO2體積分數為5%飽和濕度的培養箱中培養48 h,分別在12 h、24 h和48 h測量各孔細胞的吸光度(OD)并記錄,計算各組細胞在不同生長時間點的生長抑制率,抑制率(%)=(1-藥物組平均OD值/對照組平均OD值)×100%。以時間點為橫坐標,以抑制率為縱坐標,繪制各組細胞的生長抑制率變化統計圖,并采用Bliss法計算LCA在48 h對HCT116和SW480細胞的半抑制濃度(IC50)值。
1.2.3Annexin V-FITC/PI雙染檢測各組HCT116細胞凋亡水平 取生長處于對數期的HCT116細胞,按照1.0×105ml-1濃度接種于96孔培養板中。將細胞分為4組,分別為對照組(含10%FBS的完全培養基),LCA組(含50 μmol/L的LCA),N-乙酰半胱氨酸(N-Acetyl-L-cysteine,NAC)組(含5 mmol/L的NAC)以及LCA+NAC組(5 mmol/L的NAC預先孵育1 h,再加50 μmol/L的LCA),每組設置3平行復孔,用藥后常規培養24 h。后根據下列操作檢測各組細胞凋亡率:①1 000 r/min離心5 min,棄上清,收集細胞;②加入1 ml預冷的PBS,輕輕振蕩使細胞懸浮,1 000 r/min,4°C離心5 min,棄上清;③重復步驟②兩次;④將細胞重懸于200 μl的Binding Buffer;加入10 μl Annexin V-FITC和10 μl PI,輕輕混勻,4°C避光孵育30 min;⑤加入300 μl Binding Buffer,隨即進行流式細胞儀檢測;⑥使用CXP分析軟件進行分析并記錄結果。總凋亡率=第二象限B2細胞占比+第四象限B4細胞占比。
1.2.4各組HCT116細胞活性氧(ROS)水平檢測 取對數生長期的HCT116細胞,按照1.0×105ml-1濃度接種于96孔培養板中。將細胞分為4組,分別為對照組(含10%FBS的完全培養基),LCA組(含50 μmol/L 的LCA),NAC組(含5 mmol/L的NAC)以及LCA+NAC組(5 mmol/L的NAC預先孵育1 h,再加50 μmol/L的LCA),每組設置3平行復孔,用藥后常規培養24 h。后根據下列操作檢測各組細胞ROS水平:①1 000 r/min離心5 min,棄上清,收集細胞;②更換終濃度為10 μmol/L的ROS探針工作液(DCFH-DA)的無血清培養基;③37℃細胞培養箱中避光繼續培養20 min,每隔3~5 min依次輕振蕩混勻;④收集細胞,PBS洗滌、離心3次;⑤適量PBS重懸細胞,采用流式細胞儀檢測細胞內熒光強度。
1.2.5Western blot檢測各組HCT116細胞中內質網應激(Endoplasmic reticulum stress,ERS)及凋亡相關蛋白表達量 取對數生長期的HCT116細胞,按照1.0×105ml-1濃度接種于96孔培養板中。將細胞分為4組,分別為對照組(含10%FBS的完全培養基),LCA組(含50 μmol/L的LCA),NAC組(含5 mmol/L的NAC)以及LCA+NAC組(5 mmol/L的NAC預先孵育1 h,再加 50 μmol/L 的LCA),每組設置3個平行復孔,用藥后常規培養24 h。后采用全蛋白提取試劑盒對各組HCT116細胞分別進行蛋白提取;用BCA蛋白濃度檢測試劑盒對所提蛋白進行濃度檢測;取20 μg蛋白和4 μl 2×SDS上樣緩沖液混合均勻,100℃變性10 min;上樣,SDS-PAGE凝膠電泳分離后轉至PVDF膜上;用5%脫脂牛奶封閉1 h;PBS洗膜;PBS洗膜后分別加入一抗(ATF6、XBP-1、ATF4、CHOP、Bcl2、Bax、Cleaved-caspase3和GAPDH),在4℃下孵育過夜;PBS洗膜;加入HRP標記的羊抗兔IgG二抗(1∶5 000)室溫孵育0.5 h;PBS洗膜;用ECL化學發光試劑盒進行顯色。以GAPDH為內參蛋白,后采用Quantity One圖像分析軟件進行灰度比分析。
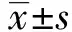
2 結果
2.1LCA抑制人直腸癌HCT116和SW480細胞的增殖 MTT檢測結果顯示(圖1),LCA呈明顯的時間和濃度依賴性抑制HCT116和SW480細胞的增殖。與同一時間點1 μmol/L的LCA作用效果比較,細胞增殖抑制率隨LCA濃度的增加而顯著增高(P<0.05,P<0.01);其中50 μmol/L的LCA作用細胞48 h后,HCT116和SW480細胞的增殖抑制率均高于80%,對細胞活力抑制效果顯著。根據Bliss法計算得出LCA在48 h對HCT116和SW480細胞抑制濃度的IC50值分別為21.94 μmol/L和29.38 μmol/L,故后續實驗我們選擇抑制效果較好的HCT116細胞為研究對象。
2.2LCA促進人直腸癌HCT116細胞的ROS水平 流式檢測結果顯示(圖2),與對照組比較,50 μmol/L 的LCA能顯著增加HCT116細胞的ROS水平(P<0.01),而5 mmol/L的NAC處理HCT116細胞能顯著降低ROS水平(P<0.01);與5 mmol/L的NAC處理組比較,加入50 μmol/L的LCA共孵育24 h能有效逆轉NAC的抑制作用,顯著增加細胞的ROS水平(P<0.01)。
2.3LCA促進人直腸癌HCT116細胞凋亡 流式細胞術檢測細胞凋亡結果顯示(圖3),與對照組比較,50 μmol/L的LCA能顯著促進HCT116細胞的凋亡(P<0.01),而采用5 mmol/L的ROS抑制劑NAC處理HCT116細胞,細胞的凋亡率顯著下降(P<0.05);與5 mmol/L的NAC處理組比較,加入50 μmol/L的LCA共孵育24 h能有效逆轉NAC對HCT116細胞凋亡的抑制作用,顯著增加細胞的凋亡率(P<0.01)。
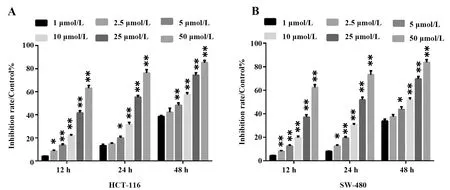
圖1 MTT法檢測不同濃度LCA對HCT116和SW480細胞活性的影響Fig.1 Determining effect of different concentrations of LCA on viability of HCT116 and SW480 cells by MTT assay
圖2 流式細胞術檢測各組細胞ROS水平Fig.2 ROS levels in each group of cells were detected by flow cytometry

圖3 流式細胞術檢測各組細胞凋亡率Fig.3 Apoptosis rates in each group of cells were detected by flow cytometry
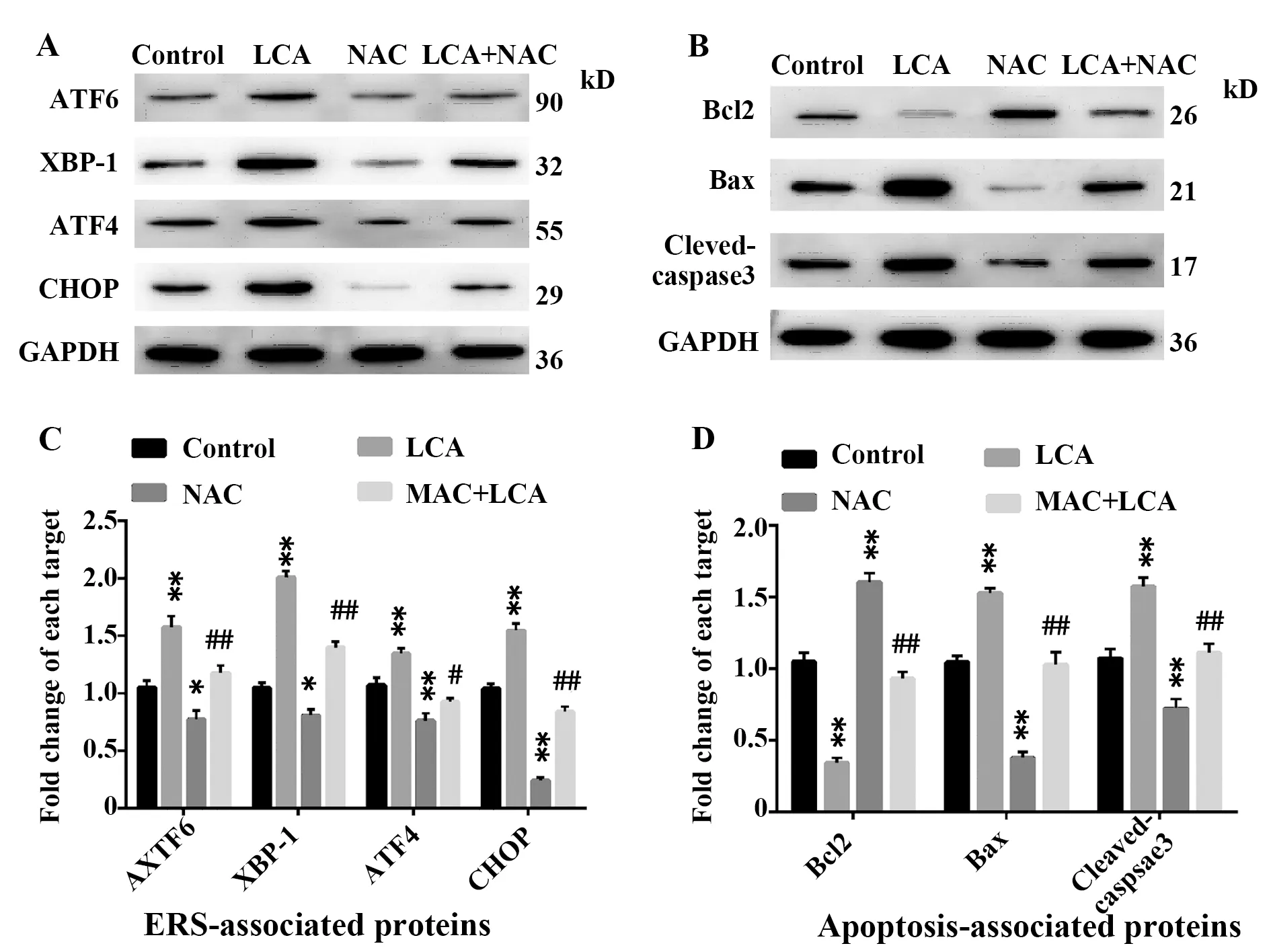
圖4 Western blot檢測各組細胞ERS及凋亡相關蛋白的表達水平Fig.4 Determining levels of ERS and apoptosis-related proteins in each group of cells by Western blot
2.4LCA上調人直腸癌HCT116細胞內質網應激及凋亡相關蛋白的表達水平 Western blot檢測結果顯示(圖4),與對照組比較,50 μmol/L的LCA處理組細胞中ERS相關蛋白ATF6、XBP-1、ATF4和CHOP以及凋亡相關蛋白中Bax和Cleaved-caspase3的表達水平均顯著升高(P<0.01),而采用5 mmol/L的ROS抑制劑NAC處理HCT116細胞后,上述指標表達水平顯著降低(P<0.05,P<0.01);相反地,與對照組比較,50 μmol/L的LCA處理組細胞中抗凋亡蛋白Bcl2表達水平顯著降低(P<0.01),而 5 mmol/L 的NAC處理組Bcl2表達水平顯著升高(P<0.01)。與5 mmol/L的NAC處理組比較,5 mmol/L NAC+50 μmol/L LCA組細胞中ATF6、XBP-1、ATF4、CHOP、Bax和Cleaved-caspase3表達水平顯著升高(P<0.05,P<0.01),而Bcl2表達水平顯著降低(P<0.01)。
3 討論
結腸癌作為全球發病率逐年攀升的惡性腫瘤之一,目前的主要治療方法仍然是手術切除、放化療等,但預后不良及發病率高等特點仍使得結腸癌的治療具有相當大的局限性,嚴重威脅著患者的生命及健康。更徹底地了解結腸癌的分子病理機制對于建立新的治療及診斷策略至關重要。隨著越來越多的中草藥植物的發現及其天然提取物藥理作用的研究,中草藥植物在抗腫瘤方面的作用逐漸被發現。黃酮類化合物是一類天然產物,在自然界中普遍存在,具有生理活性廣泛、毒副作用小的特點[9]。近年來,其抗腫瘤作用得到了廣泛的關注和研究。研究顯示,黃酮類化合物對多種常見癌癥如肺癌、乳腺癌、結腸癌、前列腺癌、肝癌、白血病、卵巢癌、胃癌等皆有顯著的防治效果。而其抗腫瘤的機制主要涉及抗氧化清除氧自由基、促凋亡、阻滯細胞周期、調節免疫、抑制腫瘤新生血管形成、抑制環氧合酶2、抑制端粒酶活性等[10]。LCA是一種在甘草中提取的黃酮類有效物質,在胃癌的研究中,Xiao等[11]已經證明來源于甘草的7種有效成分(甘草酸、甘草次酸、銨鹽、LCA、甘草素、異甘草素以及甘草黃酮),其中LCA對5種胃癌細胞株(CES-1、MKN-28、SGC7901、AGS以及MKN-45)抑制作用濃度的IC50值均最小,表明LCA對胃癌細胞的毒性作用最強,且其主要作用機制為阻滯G2/M期細胞和誘導凋亡。而本研究結果表明,LCA對結腸癌細胞株HCT116和SW480的毒性作用在一定程度上呈明顯的時間與濃度依賴性,且對HCT116的毒性作用強于SW480(48 h的IC50值分別為21.94 μmol/L和29.38 μmol/L)。
越來越多的證據表明,ROS通過誘導細胞凋亡和分化,在抑制癌細胞增殖方面起著重要作用[12]。低水平的ROS通常能支持細胞增殖和生存途徑,而一旦ROS水平過高,就會導致有害的氧化應激,從而導致細胞死亡;且在癌細胞中,癌細胞會對自身ROS水平進行嚴格的調控,以適應自身增殖,而通過自身突變或外界調控破壞了ROS的平衡,即癌細胞的氧化應激被調節,其增殖能力進而會被抑制[13]。因此如何有效抑制癌細胞ROS水平已成為抗癌的研究重點。研究顯示,ROS途徑是天然黃酮類化合物發揮抗腫瘤功能的主要途徑之一。例如,黃酮類化合物淫羊藿甙處理的甲狀腺癌B-CPAP細胞的ROS水平顯著高于未處理的對照組,且導致細胞的不可逆損傷,進而誘導細胞凋亡發生[14]。在膀胱癌的研究中,Jiang等[15]發現LCA主要通過增加T24癌細胞株的ROS水平來抑制其增殖,且經LCA處理的細胞氧化還原狀態被破壞,細胞GSH/GSSG水平呈明顯的濃度依賴性顯著降低。在胃癌的研究中,Hao等[16]同樣發現LCA能通過增加BGC-823癌細胞的ROS水平,進而激活MAPKs途徑,抑制PI3K/AKT途徑,最終誘導細胞的凋亡。而本研究顯示,LCA同樣能提升HCT116細胞的ROS水平,促進細胞凋亡;而采用ROS抑制劑NAC處理后,細胞的ROS水平及凋亡率顯著下降,證明LCA可通過ROS途徑介導癌細胞的凋亡。
ERS是細胞啟動的一種自我保護反應機制,有利于細胞內環境穩態的維持,但長期持續的ERS則可以損傷內質網的功能,ERS無法恢復平衡時,細胞將啟動內質網相關的凋亡程序[17,18]。目前ERS誘導凋亡的途徑主要有CHOP通路、ASK1-JNK通路及Caspase-12通路,其中CHOP是一種凋亡促進因子,被認為是ERS發生的標志物[19]。而CHOP基因的啟動子中含有ATF6、XBP-1以及ATF4等蛋白的結合位點,本研究檢測結果顯示,LCA能顯著提升CHOP、ATF6、XBP-1以及ATF4的蛋白表達水平;而ROS抑制劑NAC處理下能顯著逆轉這一變化,說明LCA介導的ROS水平變化參與了ERS過程。進一步對線粒體凋亡途徑中凋亡相關蛋白檢測結果顯示,LCA能顯著上調促凋亡蛋白Bax和Caspase-3蛋白活化片段Cleaved-caspase3的表達,下調抗凋亡蛋白Bcl2的表達,而ROS抑制劑NAC處理下能顯著逆轉這一變化,說明LCA介導的ROS水平變化還參與了線粒體凋亡途徑。Kang等[20]在乳腺癌相關研究中發現,LCA能顯著提升癌細胞MCF-7和MDA-MB-231的ROS及線粒體膜電位水平,同時通過線粒體凋亡途徑誘導細胞的凋亡,且通過siRNA技術證明了Sp1蛋白為其靶向作用位點。Tang等[21]在非小細胞肺癌的研究中發現,LCA不僅能增加內質網應激蛋白CHOP的表達,還能誘導癌細胞的自噬效應,且對CHOP進行敲降后發現LCA誘導的癌細胞活性有所增加,凋亡率和自噬能力均有所下降,提示CHOP蛋白與LCA誘導的細胞活力下降、凋亡和自噬至關重要。此外,在膀胱癌中,Yang等[22]的研究表明LCA不僅能增加細胞內Ca2+水平,進而誘導線粒體功能障礙,且ERS通路同樣被證明是LCA誘導T24膀胱癌細胞凋亡的重要機制。
綜上所述,LCA以劑量依賴的方式抑制人結腸癌細胞的活性;其可能的機制是通過上調細胞ROS水平,進而從Bcl2/Bax/Cleaved-caspase3線粒體凋亡和CHOP內質網應激兩條途徑共同誘導癌細胞的凋亡。因此,LCA有望成為抗結腸癌的新型治療藥物,但其更全面、深入的抗癌機制還有待進一步研究。

