可溶性腦信號蛋白4D在心房顫動患者血清中的表達
朱心怡 項麗 尤濤 焦陽 徐衛亭 陳建昌
(蘇州大學附屬第二醫院心臟內科,江蘇 蘇州 215004)
心房顫動(AF)是臨床較為常見的心律失常,患者常因為心房栓子脫落而發生腦栓塞等,不僅嚴重影響患者的生存質量且病死率較高〔1〕。其發病機制、電解剖結構等問題仍不完全明確,但近年來研究發現其與炎癥相關〔2~5〕。腦信號蛋白(Sema)4D是近年新發現的一種細胞因子,在神經細胞、免疫系統、血管發生、腫瘤轉移等方面均起重要作用〔6〕。而可溶性(s)Sema4D是Sema4D隨炎癥細胞活化后從細胞表面脫落的分子量為120 kD的物質。目前國內外關于sSema4D與AF的發生、預后的相關性報道甚少,本研究旨在觀察AF患者血清中sSema4D的表達并探討其高表達對AF發生及AF患者腦卒中發生的影響。
1 對象和方法
1.1對象 選擇2013年10月至2015年1月在蘇州大學附屬第二醫院心內科住院的心電圖證實的AF患者103例,其中陣發性AF 51例,非陣發性AF(包括持續性AF和永久性AF)52例;同期住院無AF發作史的竇性心律患者51例為對照組。分類標準:根據AF治療指南〔7〕,按照其持續時間進行分類:①陣發性AF:AF發作時間≤7 d,大多數在48 h內;②持續性AF:AF持續時間>7 d;③永久性AF:指AF用藥物或電轉復后不能恢復為竇性心律,或轉復后不能用藥物維持,數小時后復發者。排除標準:急性冠脈綜合征;急性心力衰竭;3個月內有感染、使用過糖皮質激素及重大外傷和手術者;自身免疫性疾病;風濕活動;嚴重肝腎功能損害;甲狀腺功能亢進;血液系統疾病。研究方案經蘇州大學附屬第二醫院倫理委員會批準,入選患者均知情同意。
1.2一般資料收集 所有入選患者入院時即完成一般資料的收集,包括年齡、性別、既往病史等,對患者進行AF分類及常規CHA2DS2VASC評分,C-心力衰竭1分,H-高血壓1分,A2-年齡>75歲2分,D-糖尿病1分,S-腦卒中、短暫性腦缺血(TIA)、外周血管性疾病2分,V-血管性病變1分,A-年齡65~74歲1分,SC-女性1分,如評分≥2分,使用華法林抗凝,監測國際標準化比值(INR)在2~3分之間。
1.3血液檢測 入院即刻采取外周靜脈血,保存于乙二胺四乙酸(EDTA)抗凝管中。離心取血清并保存于-80℃冰箱待檢。血清sSema4D濃度測定采用酶聯免疫吸附實驗(購自上海鑫樂生物科技有限公司),方法嚴格按照試劑盒說明書。所有患者入院即常規完成凝血指標等檢測。
1.4超聲心動圖檢測 在入院后3~5 d完成超聲心動圖檢測,主要選用左室長軸切面及心尖四腔切面,以左房內徑(LAD)≥40 mm為左房擴大(左側臥位)。
1.5隨訪 進行12個月的隨訪,詢問終點時腦卒中發生及治療情況。
1.6統計學處理 采用SPSS17.0軟件進行t檢驗、單因素方差分析、Mann-WhitneyU檢驗、χ2檢驗、多因素Logistic回歸分析。
2 結 果
2.13組基本資料比較 陣發性AF組和非陣發性AF組在心率、高血壓、心臟瓣膜病、慢性阻塞性肺疾病(COPD)、冠心病患病率及阿司匹林、硫酸氫氯吡格雷片(波立維)、華法林、β受體阻斷劑、胺碘酮用藥均顯著高于對照組(P<0.05)。陣發性AF組心率、冠心病患病率及阿司匹林、波立維、華法林、胺碘酮用藥均顯著高于非陣發性AF組,心臟瓣膜病患病率顯著低于非陣發性AF組(均P<0.05),見表1。
2.23組心臟超聲結果 陣發性AF組和非陣發性AF組LAD、左室舒張期內徑(LVDd)、左室收縮期內徑(LVDs)、左房內徑(RAD)長徑、RAD短徑、右房內徑(RVD)基底段、凝血酶原時間(PD)、INR均顯著高于對照組(P<0.05)。陣發性AF組LAD、LVDd、LVDs、RAD、RVD基底段、抗凝血酶Ⅲ、肺動脈壓顯著低于非陣發性AF組(P<0.05),EF顯著高于陣發性AF組(P<0.05),見表2。

表1 3組一般資料〔n(%)〕
與對照組比較:1)P<0.05;與非陣發性AF組比較:2)P<0.05;下表同
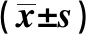
表2 3組心臟超聲及凝血結果比較
2.3各組sSema4D濃度比較 非陣發性AF組血清sSema4D水平〔(9.30±2.31)ng/ml〕顯著高于陣發性AF組〔(8.50±2.21)ng/ml〕(P=0.042),而兩組均顯著高于對照組〔(6.51±1.21)ng/ml〕(P<0.001)。
2.43組主要凝血指標比較 非陣發性AF組和陣發性AF組INR、PT水平均顯著高于對照組(P<0.05);陣發性AF組抗凝血酶Ⅲ水平顯著高于非陣發性AF組和對照組(P<0.05),且非陣發生性AF組顯著低于對照組(P<0.05),見表2。
2.5AF發生的多因素回歸分析 多因素Logistic回歸(后退法)結果顯示:男性、心率、高血壓、高血清sSema4D、LAD均是AF發生的獨立危險因素(P<0.05),見表3。
2.6隨訪結果及AF患者腦卒中事件發生的多因素回歸分析 患者均成功完成了包括住院在內的為期12個月的隨訪,發生腦卒中事件者共12例,其中陣發性AF組4例,非陣發性AF組8例。多因素Logistic回歸(后退法)結果顯示:心臟瓣膜病、高血清sSema4D、低INR均是AF患者腦卒中發生的獨立危險因素(P<0.05),見表4。

表3 預測AF發生的多因素回歸分析

表4 預測AF患者腦卒中發生的多因素Logistic回歸分析
3 討 論
AF的發病機制研究始于20世紀初期,但至今沒有完全闡明。目前認為有多種機制共同參與AF的發生和維持,包括心房重構、炎癥、遺傳學、經典假說等,其中近年來關于炎癥反應與AF發病機制相關性的研究較多。研究發現,多種炎性細胞(白細胞、單核細胞、巨噬細胞、淋巴細胞及肥大細胞等)及炎性相關因子〔C反應蛋白、腫瘤壞死因子-α、白細胞介素(IL)2、IL-6、IL-8等〕與AF發生及持續、復發密切相關〔8~10〕。
Sema4D生物功能多樣,最初僅在免疫細胞中發現〔11〕。Sema4D受體包括叢狀蛋白B1和分化抗原簇72,當 Sema4D與相應受體結合后,通過受體酪氨酸激酶途徑、三磷酸烏苷(RhoGTP)酶途徑、相關Ras(R-Ras)途徑等多種信號轉導途徑發揮作用〔6〕。研究發現sema4D及其受體在多種細胞表面均有表達,包括T細胞、B細胞、自然殺傷(NK)細胞、中性粒細胞、單核細胞、樹突細胞、巨噬細胞和破骨細胞等〔12〕。上述細胞活化后導致Sema4D表達明顯上調,而sSema4D則是在細胞活化后,由Sema4D從細胞表面脫落而成。研究證實sSema4D保留了與膜型Sema4D同樣的生物學活性〔12〕,而本研究證實sSema4D與AF存在相關性,且在非陣發性AF(包括持續性和永久性AF)中的表達高于陣發性AF患者,表明AF的發生和維持可能與炎性反應存在相關性,而這些炎性細胞活化后sSema4D的表達水平出現了相應的增高。
目前有大量證據證實心房重構是AF的發生、持續和復發的重要基礎,而炎性反應在心房的電重構、結構重構和自主神經重構中均有參與〔8,13〕。其中心房結構重構主要包括心房擴大、心房肌細胞超微結構改變及心房纖維化3個方面。AF易致心房肌缺血缺氧進而誘導炎性因子及其抑制因子之間失調而加重結構重構,持續時間越長,損害程度越重。一方面,AF發生后,產生持久的血流動力學改變使得心房壓力不斷增加導致心房肌收縮無力,引起心房增大;另一方面,一旦心房增大,房內壓力隨之增大,引起局部心房壁壓力變化從而使得局部心房不應期時間的不均勻性,成為心房折返基礎而又導致AF的發生。本研究發現非陣發性AF患者LAD明顯大于陣發性AF組和對照組,sSema4D的表達水平表現出相應結果,而其高表達與炎性細胞活化程度相關,故而進一步反映了sSema4D參與心房結構重構的可能。
AF帶來的另一大危害便是栓塞的發生,常常因為左心耳栓子脫落而致重要臟器發生栓塞(如腦、脾、腸等),其中以腦卒中的發生率最高,這與AF的高凝狀態密切相關。sSema4D在腦卒中患者中有較高表達,且與病情進展有一定關系,可能與梗死急性期血小板大量活化,血小板脫顆粒,其表面大量sSema4D釋放入血相關〔14〕。本研究又進一步發現即使不是在急性期,sSema4D在腦卒中患者中也有較高表達并且一定程度上可以預測AF患者腦卒中的發生。
綜上,通過對血清sSema4D的測定可以篩選出AF高危患者,可以進行早期加強抗凝等干預,減少腦卒中事件的發生從而改善患者的遠期預后。

