pH 值對低酯果膠/酪蛋白酸鈉復合體系流變及結構特性的影響
彭媛媛,王昱圭,湯雪纖,趙 欣,張甫生,鄭 炯,*
(1.西南大學食品科學學院,重慶 400715;2.食品科學與工程國家級實驗教學示范中心(西南大學),重慶 400715;3.重慶第二師范學院,重慶市功能性食品協同創新中心,重慶 400067)
食品體系的功能特性由多糖、蛋白質、脂類及其他生物大分子共同決定[1]。由于多糖在一定程度上能修飾蛋白質的微觀結構和功能性質,改善單一蛋白質在等電點附近失穩聚沉現象,故多糖和蛋白質在很大程度上影響著食品體系的微觀結構、穩定性和質地[2]。近年來,多糖和蛋白質的相互作用已廣泛應用于食品工業中,如新型凝膠[3]、乳液穩定[4]和微膠囊[5-6]等。但蛋白質和多糖間的作用主要由靜電力驅動,故pH值會影響其相互作用,大多數多糖/蛋白質復合體系對pH值環境條件變化表現出較強的敏感性[7]。因此,研究多糖/蛋白質復合體系在不同pH值下發生的結構和性質變化對其在不同pH值食品體系中的應用具有重要意義。
Yuan Yang等[8]發現,在pH 5.5和pH 6.0時殼聚糖和大豆球蛋白復合體系均能形成微凝膠網絡結構,但體系只在pH 5.0時具有較好的凝膠網絡結構。牛付閣等[9]發現隨著pH值的變化阿拉伯膠/卵白蛋白復合溶液呈現出4 個不同的相區(共溶區、可溶性復合物相區、不溶性復合物相區、共溶區)。Turgeon等[10]也發現,不同pH值條件下黃原膠和β-乳球蛋白相互作用是不同的,隨著pH值降低到β-乳球蛋白等電點以下,體系由溶膠轉化為凝膠網絡結構,故在不同pH值下復合體系結構是有差異的。李成倍[11]發現在pH 4.0~4.2時高酰基結冷膠與酪蛋白酸鈉通過絡合作用逐漸形成共聚體,凝膠網絡結構增強。酪蛋白酸鈉(sodium caseinate,SC)是由酪蛋白堿處理得到的一類可溶性蛋白質[12],常作為增稠劑、乳化劑和穩定劑廣泛應用于食品行業中[13-14]。但SC在酸性條件下失穩聚沉的現象制約其應用。水解桃膠[15]、羧甲基纖維素[16]、海藻酸鈉[17]等高分子質量水溶性多糖的添加,可對SC進行改性修飾,并改善其功能特性,使其具有更廣泛的應用前景。低酯果膠(low methoxyl pectin,LMP)作為一種水溶性多糖,具有良好的食用功效,且在較廣的pH值范圍(pH 2.0~6.0)內具有較好的凝膠性能[18]。在酸性條件下,帶有較多負電荷的LMP,可以吸附在蛋白質表面,并能通過靜電作用和空間位阻作用穩定體系[19-20]。因此向SC溶液體系中加入適量LMP,能提高體系在酸性條件下的穩定性。
目前關于pH值影響多糖/蛋白質復合體系結構性質的報道較多,但針對LMP/SC復合體系在不同pH值下流變及結構特性的系統研究較少。因此,本實驗以LMP/SC復合體系為研究對象,在不同酸性條件下(pH 3.0、3.5、4.0、4.5、5.0、5.5)研究其流變特性、Zeta電位、粒徑、濁度及微觀結構的變化,明確相關特性與pH值環境條件的關系,以期為不同酸性條件下LMP/SC復合體系在食品工業中的應用提供理論依據。
1 材料與方法
1.1 材料與試劑
LMP(食品級,酯化度20%) 河南恒銳食品生物科技有限公司;SC(食品級,蛋白質量分數98%)上海極威生物科技有限公司;檸檬酸(分析純) 成都市科龍化工試劑廠。
1.2 儀器與設備
FA2004A電子分析天平 上海精天電子儀器有限公司;pHS-3C酸度計 成都世紀方舟科技有限公司;AR-G2旋轉流變儀 美國TA公司;2100AN濁度儀美國Hach公司;Nano-ZS & MPT-2 Zeta電位及納米粒度儀英國Malvern公司;JSM-6510LV鎢燈絲掃描電子顯微鏡日本電子株式會社。
1.3 方法
1.3.1 樣品的制備
參考牛付閣[9]和邱蓉[21]等的方法稍有改動,在100 mL蒸餾水加入1 g SC和0.5 g LMP,80 ℃加熱60 min,加熱過程不斷攪拌,使體系充分水化溶解后靜置冷卻。用不同質量濃度檸檬酸(5、12.5、25、50 g/100 mL)調節體系pH 3.0、3.5、4.0、4.5、5.0、5.5,確保檸檬酸對溶液的稀釋作用最小。然后在4 ℃冰箱靜置24 h后進行測定。
1.3.2 流變特性的測定
樣品處理:參考劉麗婭[22]的方法稍做改動。采用平板-平板測量系統,平板直徑40 mm,設置間隙1.0 mm,取適量樣品于平行板,除去多余樣品,并用硅油密封表面以防止水分蒸發。每個樣品測試前保留時間180 s,測量溫度25 ℃。
靜態流變學測定:設置剪切速率從0.1~300 s-1遞增后,再從300~0.1 s-1遞減,測定過程中剪切應力及黏度的變化情況。采用Herschel-Bulkey模型(下式)對所得數據點進行回歸擬合,擬合系數R2表示方程擬合精度。

式中:σ為剪切應力/Pa;K為稠度系數/(Pa·sn);γ為剪切速率/s-1;n為流體指數;σ0為屈服應力/Pa。
動態黏彈性測定:控制掃描應變值0.5%,確保測定過程在樣品線性黏彈區內進行,振蕩頻率0.1~10 Hz,測定不同樣品儲能模量(G′)、損耗模量(G”)以及損耗正切角(tanδ)隨角頻率的變化情況。
1.3.3 粒徑的測定
將待測樣品用蒸餾水稀釋1 000 倍后,用檸檬酸溶液調節體系pH值與稀釋前一致。采用納米粒度儀測定其粒徑大小。平衡時間2 min,測定溫度25 ℃,所用光源為最大輸出功率10 W的He-Ne激光,檢測角90°,檢測波長633 nm。避免多重光散射,每次循環掃描10~120 次,每個樣品重復測量3 次。
1.3.4 Zeta電位的測定
將待測樣品用蒸餾水稀釋1 000 倍后,用檸檬酸溶液調節體系pH值與稀釋前一致。采用納米粒度儀測定不同條件下LMP/SC復合體系的Zeta電位。測定條件:折疊毛細管樣品池,0.45 cm2鉑電極,折疊毛細管間距0.4 cm。平衡時間2 min,測定溫度25 ℃。每次循環掃描10~100 次,每個樣品重復測量3 次。
1.3.5 濁度的測定
采用濁度儀測定:開機預熱30 min之后對儀器進行標定校準,緩慢注入50 mL待測液于樣杯中,蓋上樣杯蓋,用濾紙擦凈杯體后將其平穩置入比色池,關閉池蓋。待顯示數據穩定,讀出樣品濁度值,每個樣品重復測量3 次。
1.3.6 微觀結構的測定
將制備好的樣品倒入培養皿中,使樣品均勻平鋪在培養皿內,放入冰箱凍藏24 h,使樣品完全結冰。再放入真空冷凍干燥機中,于-50 ℃進行抽真空冷凍干燥72 h,使得樣品完全干燥。將干燥后的樣品固定在雙面導電樣品臺上,利用離子濺射儀使樣品具有導電性。使用掃描電子顯微鏡在500放大倍率下,對樣品的微觀結構進行觀察,并選擇具有代表性的視野進行記錄拍照。
1.4 數據處理
所得數據使用Origin 8.0和Microsoft Excel繪制相關圖表。粒徑、Zeta電位、濁度數據使用SPSS 20對其進行方差分析(ANOVA),利用鄧肯式多重比較對差異顯著性進行分析(P<0.05,差異顯著;P<0.01,差異極顯著)。每次測試前需更換樣品,且每組實驗均重復3 次。
2 結果與分析
2.1 pH值對復合體系流變學特性的影響
2.1.1 靜態剪切流變學特性
由圖1可知,復合體系剪切應力隨剪切速率的增大而增大,最后趨于平緩,呈現出剪切稀化的流體特征。在低剪切速率時,由于單位體積中大分子纏繞碰撞幾率比外力引起的纏結斷裂的幾率大,體系黏度此時較大;隨著剪切速率的增大,分子交聯結構受到破壞,體系黏度也隨之減小[23]。在pH 3.0~4.0時,體系剪切應力隨pH值的增大而減小;在pH 4.0~4.5時,體系剪切應力出現驟增;在pH 4.5~5.5時,體系剪切應力又隨pH值的增大而減小,且在pH 5.5時最小。
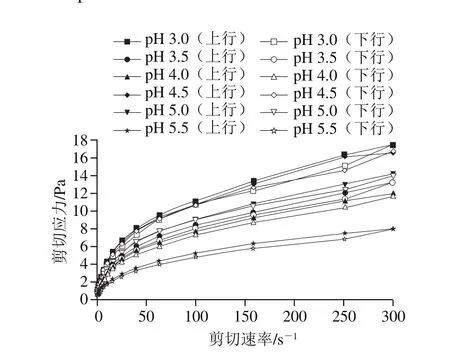
圖1 不同pH值下LMP/SC復合體系剪切應力隨剪切速率變化曲線Fig. 1 Shear stress vs. shear rate curves of LMP/SC composite system at different pH values
由表1可知,擬合曲線決定系數R2均大于0.99,故模型精度較高。流體指數n代表流體假塑性程度,n值偏離1的程度越大,表明體系越容易剪切變稀,即假塑性程度越大[24]。結果表明,n值均小于1,屈服應力σ0大于0,表明在剪切速率范圍內,體系呈現出有屈服值的剪切變稀非牛頓流體特性[25]。稠度系數K反映體系黏稠程度,結果表明:在pH 3.0~4.0時,隨著pH值的增大,K值減小,n值增大,體系表觀黏度減小;在pH 4.0~4.5時,K值和σ0值出現驟升,n值出現驟降,體系表觀黏度驟增,剪切變稀現象進一步增強,假塑性流體行為也更加明顯[26];在pH 4.5~5.5時,隨著pH值的增大,K值下降,n值增大,復合體系表觀黏度進一步減小。總體上,隨著pH值的增大,復合體系表觀黏度呈現出先減小,在SC等電點附近驟增,然后繼續減小的趨勢。

表1 LMP/SC復合體系Herschel-Bulkey方程擬合參數Table 1 Herschel-Bulkey equation fi tting parameters for LMP/SC composite system
2.1.2 動態黏彈流變學特性
tanδ反映G”與G′的比值,G′代表儲存在復合體系中的能量,反映體系彈性大小,G”代表體系由于不可逆黏性形變損耗的能量大小,反映體系黏性大小[24]。故tanδ反映體系黏性和彈性對LMP/SC復合體系黏彈性質的相對貢獻,tanδ小說明體系處于類似固體的狀態,流動性相對差,tanδ大則表明體系呈現類似液體的狀態,流動性較大,而復合體系大部分tanδ大于1,說明體系顯現出黏性為主的液體特性[27]。由圖2a可知,隨pH值的增大,體系tanδ呈現出兩段變化:在pH 3.0~4.0時,tanδ隨著pH值的增大而增大,復合體系流動性增強;在pH 4.5~5.5時,tanδ驟減后隨pH值的增大進一步增大。由圖2b可知,體系的G”也呈現兩段變化:在pH 3.0~4.0時,G”隨pH值的增大而減小;在pH 4.5時,G”出現驟增,此時體系黏性最大;在pH 4.5~5.5時,隨著pH值的增大,G”減小幅度更大,體系黏性減小更多。復合體系黏性在SC等電點(pH 4.5)附近會發生突變,且在pH值高于SC等電點后,pH值變化對體系流體特性的影響更大。
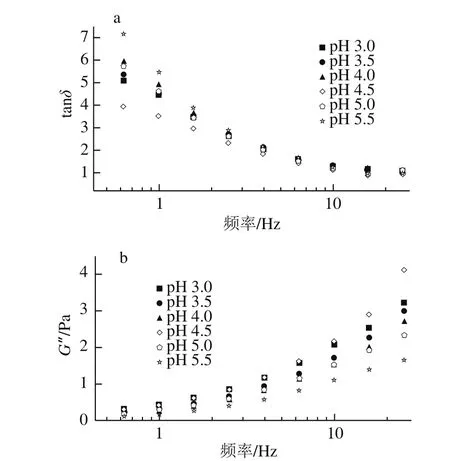
圖2 LMP/SC復合體系tanδ(a)和G”(b)隨頻率變化曲線Fig. 2 tanδ (a) and loss modulus (b) vs. frequency curves of LMP/SC composite system
2.2 pH值對復合體系Zeta電位及粒徑的影響
Zeta電位代表體系內微粒的平均電位,可衡量多糖/蛋白質復合物表面的電荷密度變化[28],粒徑代表體系內微粒大小,兩者均能反映體系的穩定性。在不同pH值條件下,體系Zeta電位和平均粒徑均存在顯著性差異(P<0.05)。由圖3A、B可知,隨著pH值的增大,復合體系粒徑先增大后減小,且在pH 4.5時最大;復合體系Zeta電位隨著pH值的增大而減小,當pH 4.5~5.5時,Zeta電位由正值減小為負值。而Zeta電位絕對值先減小后增大,表明復合體系穩定性先減小后增大。LMP/SC復合體系在SC等電點(pH 4.5)附近結構特性發生突變,這與流變學特性的測定結果相一致。

圖3 不同pH值下復合體系Zeta電位(A)及粒徑(B)的變化Fig. 3 Changes in zeta potential (A) and particle size (B) at different pH values
2.3 pH值對復合體系濁度的影響

圖4 不同pH值下復合體系的濁度(A)和樣品圖(B)Fig. 4 Turbidity (A) and visual appearance (B) of composite system at different pH values
濁度表征光散射對入射光的衰減,反映溶液對光線通過時所產生的阻礙程度,濁度與體系中懸浮物質含量及其大小形狀等有關。Rayleigh散射理論表明溶液體系內顆粒直徑的增加通常會導致體系濁度的增加[21]。由圖4A可知,在不同pH值條件下,體系濁度差異顯著(P<0.05)。隨著體系pH值的增大,濁度值呈先增大后減小的趨勢,表明pH值能在一定程度上改變復合體系的顆粒大小和形狀。濁度值在pH 4.5時最大,表明此時LMP/SC復合體系對光線通過的阻礙最大,這與Zeta電位及粒徑的測定結果一致。由圖4B可知,隨著pH值的減小,LMP/SC復合體系顏色先略微變深,后逐漸變淺,由最初的乳白色共溶體系變為淺白色的半透明水凝膠狀態。
2.4 pH值對復合體系微觀結構的影響

圖5 LMP/SC復合體系的掃描電子顯微鏡圖Fig. 5 SEM photographs of LMP/SC composite system
由圖5A、B可知,在pH 5.5時體系結構比較雜亂,松散的片狀結構呈堆砌狀態。但隨著pH值的減小,體系內片狀結構趨于規則;在pH 5.0時,復合體系中光滑的片狀LMP貼附在SC表面,同時條狀LMP向外延伸連結體系其他部分,說明pH值在高于SC等電點的酸性條件下,仍存在部分果膠吸附在酪蛋白膠束表面,形成微凝膠網絡結構[29]。
由圖5C、D可知,LMP/SC復合體系微觀結構隨pH值的降低發生明顯變化,體系變得更為立體致密。pH值在SC等電點附近時,體系內LMP分子鏈伸展連結球狀SC顆粒,形成連續性更佳的網絡結構。表明LMP能改善SC在等電點附近失穩聚沉的現象,提高酸性條件下SC的穩定性。這與陰離子多糖黃原膠在酸乳中能通過靜電作用和空間位阻作用改善酪蛋白簇的原有結構相類似[30]。
由圖5E、F可知,當pH值降低到SC等電點以下后,LMP/SC復合體系結構進一步發生改變,陰離子多糖LMP開始填充在SC的空隙中,形成一種“嵌入”式結構。結構整體空隙數目減少,體系內的分支更細薄,且呈現出片狀、條狀結構的纏繞鉤掛。此時體系開始表現出以LMP為主體的凝膠網絡結構,當pH 3.0時,這種結構最為明顯,光滑而纖細的鏈狀LMP結構像觸頭一樣伸展在體系中。
3 討 論
3.1 pH值對復合體系流變學特性的影響
食品結構往往能被外力及形變作用改變,研究流變行為可對食品體系的分子形態及微觀結構有進一步了解。實際上流變特性指體系同時表現出固體的彈性和液體的黏性[11]。LMP/SC復合體系流變學測定結果表明:LMP/SC復合體系在pH 3.0~5.5時,呈現出剪切變稀的非牛頓流體流動特性。由于LMP/SC復合體系內存在鏈狀分子構成的膠體粒子,在低剪切速率時這些鏈狀分子間相互鉤掛纏繞,體系表現出黏度較大的狀態;在剪切速率較大時鏈狀粒子較為散亂,相互勾掛現象減少,體系出現剪切稀化現象。隨著pH值的減小,體系先呈現出表觀黏度逐漸增大、流動性逐漸變小的現象;而當pH值在SC等電點附近,體系表觀黏度出現驟減;而隨著pH值的進一步減小,復合體系表觀黏度繼續增大、流動性也進一步減小。在復合體系中,隨著pH值的降低,LMP可吸附在SC表面,而SC和LMP結合程度也影響體系的黏度和流動性。因未吸附在SC表面的LMP能在一定程度上增加體系的黏度,同時這部分LMP能與LMP/SC復合膠粒之間形成弱網絡結構。
3.2 pH值對復合體系結構特征的影響
Zeta電位和粒徑可以反映LMP/SC復合體系結構的穩定性,測定結果表明:隨著pH值減小,LMP/SC復合體系顆粒先增大后減小,穩定性先減小后增大。pH值主要是通過影響氨基、羧基等大分子功能集團的離子化程度影響多糖/蛋白質復合體系的相互作用[7],隨著pH值減小,帶負電的多糖LMP能通過靜電作用逐漸吸附在帶正電的SC顆粒表面,使其粒徑變大。在SC等電點附近形成的LMP/SC復合物帶有一定數量的凈負電荷,膠粒間的靜電排斥作用較大,足以抵抗膠粒間的進一步復合凝聚,改善單一蛋白質分子在等電點附近失穩聚沉現象,此時Zeta電位值為負。當pH值低于SC等電點時,Zeta電位值變為正。SC所帶正電荷增加,多糖LMP側鏈上的羧基基團被質子化而帶有部分凈正電荷,凈負電荷減少[9]。結構特性表明:當pH值高于SC等電點時,SC膠束表面的κ-酪蛋白存在的正電荷區域也能與陰離子多糖LMP發生一定程度的靜電絡合作用[29]。隨著pH值減小,復合體系由溶膠結構向微凝膠網絡結構發生轉變。在SC等電點(pH 4.5)附近,帶負電的LMP與帶正電的球狀SC分子通過強靜電作用形成穩定的納米復合物,同時鏈狀LMP分子起到連結作用形成網狀結構。隨著pH值進一步減小,當pH 3.0~4.0時,體系開始更多呈現多糖LMP為主體的凝膠網絡結構[10],這可能是LMP分子鏈間的羧基,通過SC“架橋”實現連接;同時LMP分子間排斥作用非常小,鏈間距離降低,形成氫鍵;而SC的存在使得體系水分活度較低,此時復合體系能產生足夠的疏水相互作用穩定分子的網狀結構。故在低pH值體系中,氫鍵及疏水相互作用均有助于LMP凝膠結構的形成。
4 結 論
pH值對LMP/SC復合體系具有較大的影響。隨著pH值減小,復合體系能從共溶階段過渡到凝膠階段。在pH值高于SC等電點時,已存在少量LMP吸附在酪蛋白膠束帶正電的基團上,形成微凝膠結構的狀態,隨著pH值的降低,體系表觀黏度增大,流動性減弱;當pH值減小到其等電點附近時,LMP/SC復合體系由靜電相互作用形成較為穩定的網絡結構;隨著pH值繼續減小,體系形成以LMP為主體的凝膠網絡結構。研究結果不僅為LMP/SC復合體系在乳制品中的應用提供理論依據,還能拓寬其在食品行業中的應用范圍。

