轉(zhuǎn)錄組測(cè)序分析3 種不同鏈長(zhǎng)脂肪酸對(duì)釀酒酵母基因轉(zhuǎn)錄水平的影響
韓 麗,李 磊,楊厚榮,何培新,2,黃 申,2,*
(1.鄭州輕工業(yè)學(xué)院食品與生物工程學(xué)院,河南 鄭州 450002;2.鄭州輕工業(yè)學(xué)院食品生產(chǎn)與安全河南省協(xié)同創(chuàng)新中心,河南 鄭州 450002)
釀酒酵母(Sacchromyces cerevisiae)是一種重要的食品安全級(jí)微生物[1-2],目前通過(guò)釀酒酵母可以生物合成多種脂肪酸及脂肪酸類(lèi)衍生物如脂肪酸乙酯[3-4]、脂肪醇[5-6]及油脂等[7-10]。脂肪酸乙酯及脂肪醇可以作為香料物質(zhì)添加到食品當(dāng)中[11],如己酸乙酯是濃香型白酒香氣的重要成分之一,而己醇被研究證明是桑葚香氣成分的組成之一[12-14]。通過(guò)釀酒酵母合成脂肪酸類(lèi)衍生物如己酸乙酯等首先需要釀酒酵母合成脂肪酸,再進(jìn)一步通過(guò)不同的酶催化合成不同的化合物,而研究表明釀酒酵母體內(nèi)游離的脂肪酸主要包括C18及C16的飽和及不飽和脂肪酸[15-16],短鏈及中長(zhǎng)鏈脂肪酸的含量相對(duì)較少[17-18],因此限制其下游短鏈及中長(zhǎng)鏈脂肪酸酯及脂肪醇的產(chǎn)量。如何控制釀酒酵母體內(nèi)游離脂肪酸的鏈長(zhǎng),促進(jìn)短鏈及中長(zhǎng)鏈脂肪酸的合成,是提高釀酒酵母生物合成短鏈及中長(zhǎng)鏈脂肪酸酯類(lèi)及脂肪醇類(lèi)等化合物首先需要解決的問(wèn)題。
有研究提出在大腸桿菌中建立動(dòng)態(tài)感應(yīng)調(diào)控系統(tǒng)的概念[19-20],其原理主要基于脂肪酸進(jìn)入細(xì)胞內(nèi)會(huì)轉(zhuǎn)化為脂酰基輔酶A,脂酰基輔酶A與轉(zhuǎn)錄因子FadR結(jié)合,從而開(kāi)啟FadR抑制的啟動(dòng)子啟動(dòng)其下游基因的轉(zhuǎn)錄。通過(guò)將這種受調(diào)控的啟動(dòng)子用于大腸桿菌脂肪酸合成及由脂肪酸起始的脂肪酸乙酯合成途徑中,胞內(nèi)脂肪酸處于一種動(dòng)態(tài)平衡態(tài),細(xì)胞在感應(yīng)脂肪酸的同時(shí)受其調(diào)控,其結(jié)果可增加產(chǎn)物脂肪酸乙酯的同時(shí)避免脂肪酸過(guò)度積累造成的一系列問(wèn)題,同時(shí)減少副產(chǎn)物的積累。Dahl等[19]進(jìn)一步通過(guò)轉(zhuǎn)錄組測(cè)序等在大腸桿菌中篩選到可響應(yīng)法呢基焦磷酸脅迫的啟動(dòng)子作為動(dòng)態(tài)感應(yīng)調(diào)控元件,提高了目標(biāo)產(chǎn)物青蒿酸的積累并減少中間產(chǎn)物的量。Torella等[21]也在大腸桿菌中發(fā)現(xiàn)了通過(guò)類(lèi)似的調(diào)控策略動(dòng)態(tài)調(diào)控脂肪酸鏈長(zhǎng)從而達(dá)到截短脂肪酸鏈長(zhǎng)的目的。Xu Peng等[22]在大腸桿菌中設(shè)計(jì)并獲得響應(yīng)丙二酰單酰基輔酶A調(diào)控元件,建立了在胞內(nèi)響應(yīng)丙二酰單酰基輔酶A的動(dòng)態(tài)感應(yīng)調(diào)控系統(tǒng),脂肪酸的產(chǎn)量提高2.1 倍,達(dá)到3.8 g/L。
目前,釀酒酵母中源于脂肪酸的動(dòng)態(tài)感應(yīng)調(diào)控系統(tǒng)方面的報(bào)道較少[23]。這主要是因?yàn)獒劸平湍钢兄舅岬暮铣杉版滈L(zhǎng)延伸機(jī)制還未被明確闡述清楚[24-25],釀酒酵母中響應(yīng)脂肪酸的轉(zhuǎn)錄因子及轉(zhuǎn)運(yùn)蛋白等還未被研究清楚[26],因此,本實(shí)驗(yàn)將代表3 種不同鏈長(zhǎng)的脂肪酸己酸(C6)、十二烷酸(C12)及十六烷酸(C16)分別添加到對(duì)數(shù)期的釀酒酵母培養(yǎng)液中,通過(guò)轉(zhuǎn)錄組測(cè)序分析其對(duì)釀酒酵母基因轉(zhuǎn)錄水平的影響,對(duì)不同鏈長(zhǎng)脂肪酸存在下釀酒酵母差異基因的表達(dá)進(jìn)行分析,并對(duì)可能參與脂肪酸合成的轉(zhuǎn)錄因子及轉(zhuǎn)運(yùn)蛋白進(jìn)行預(yù)測(cè),最后進(jìn)一步分析3 種不同鏈長(zhǎng)脂肪酸存在下,酵母脂肪酸合成途徑中關(guān)鍵酶基因的表達(dá)情況,為進(jìn)一步闡明釀酒酵母響應(yīng)不同鏈長(zhǎng)脂肪酸的動(dòng)態(tài)感應(yīng)調(diào)控元件及其作用機(jī)制提供支持。
1 材料與方法
1.1 材料與試劑
實(shí)驗(yàn)中用到的釀酒酵母為BY4741(實(shí)驗(yàn)室保存)。
Total RNA Extractor(Trizol) 生工生物工程(上海)股份有限公司;Qubit2.0 RNA檢測(cè)試劑盒、Qubit2.0 DNA檢測(cè)試劑盒 美國(guó)Thermo Fisher公司。
1.2 儀器與設(shè)備
搖床、超凈臺(tái)、臺(tái)式高速冷凍離心機(jī)、聚合酶鏈?zhǔn)椒磻?yīng)(polymerase chain reaction,PCR)儀 美國(guó)Bio-Rad公司;NanoDrop 2000C超微量分光光度計(jì)、電泳儀北京市六一儀器廠。
1.3 方法
1.3.1 培養(yǎng)基配制
YPD培養(yǎng)基:葡萄糖10 g/L,酵母粉10 g/L,蛋白胨20 g/L,pH值自然。
發(fā)酵培養(yǎng)基:胰蛋白胨10 g/L,酵母粉5 g/L,葡萄糖5 g/L,氯化鈉10 g/L。
1.3.2 不同鏈長(zhǎng)脂肪酸加入酵母細(xì)胞中的濃度及誘導(dǎo)時(shí)間確定
根據(jù)文獻(xiàn)報(bào)道并結(jié)合本實(shí)驗(yàn)的要求[19,27-28],將不同濃度的脂肪酸加入到酵母細(xì)胞中,通過(guò)OD600nm測(cè)定酵母細(xì)胞的生長(zhǎng)情況,選取對(duì)酵母細(xì)胞生長(zhǎng)影響較為一致的脂肪酸濃度作為最終的濃度加入酵母處于對(duì)數(shù)生長(zhǎng)期的酵母培養(yǎng)基中,誘導(dǎo)培養(yǎng)6 h。其中C6終濃度為1 mmol/L,C12濃度為1 mmol/L,C16由于其存在一定溶解性的問(wèn)題,最終確定濃度為1 mmol/L。在實(shí)驗(yàn)過(guò)程選取30 mL培養(yǎng)基中加入600 μL混合的異丙醇-曲拉通X-100(3∶2)作為脂肪酸在酵母培養(yǎng)基中的助溶劑,其中對(duì)照組酵母中加入相同比例及體積的助溶劑以消除轉(zhuǎn)錄組測(cè)序過(guò)程中助溶劑產(chǎn)生的影響。
1.3.3 總RNA的提取
總RNA提取方法按照試劑盒說(shuō)明書(shū)進(jìn)行。通過(guò)Trizol提取試劑盒進(jìn)行RNA提取,利用Nanodrop檢測(cè)RNA濃度及瓊脂糖凝膠檢測(cè)RNA完整性以及基因組污染情況。檢測(cè)合格的RNA用于后續(xù)測(cè)序。
1.3.4 轉(zhuǎn)錄組測(cè)序數(shù)據(jù)處理及分析
將提取后的RNA送入華大基因進(jìn)行轉(zhuǎn)錄組測(cè)序分析,同時(shí)實(shí)驗(yàn)設(shè)置2 個(gè)重復(fù)。使用R軟件里的cor函數(shù)進(jìn)行相關(guān)性分析,使用R軟件里的hclust函數(shù)進(jìn)行層次聚類(lèi)分析,使用維恩圖展示樣品間基因表達(dá)分布。轉(zhuǎn)錄因子及轉(zhuǎn)運(yùn)蛋白等的預(yù)測(cè)分析由R軟件中的phyper函數(shù)進(jìn)行富集分析,此外,不同樣本間的基因表達(dá)差異均已RNA測(cè)序后的試劑讀數(shù)比值取log2的值來(lái)展示。
2 結(jié)果與分析
2.1 不同鏈長(zhǎng)脂肪酸存在下的基因表達(dá)相關(guān)性分析

圖1 不同鏈長(zhǎng)脂肪酸存在情況下及未加脂肪酸酵母菌株的基因轉(zhuǎn)錄情況分析Fig. 1 Transcriptional analysis of S. cerevisiae in the presence and absence of fatty acids with different chain lengths
在確保所提樣品RNA的質(zhì)量及通過(guò)Nanodrop測(cè)定RNA的純度之后,對(duì)加入不同脂肪酸的酵母RNA樣本進(jìn)行轉(zhuǎn)錄組測(cè)序,將所得數(shù)據(jù)結(jié)果對(duì)3 種不同鏈長(zhǎng)脂肪酸存在時(shí)基因的轉(zhuǎn)錄情況進(jìn)行歸類(lèi)比較分析后發(fā)現(xiàn),未加任何脂肪酸的酵母與C12脂肪酸存在時(shí)相關(guān)性最高,C16脂肪酸存在時(shí)次之,C6脂肪酸存在時(shí)其與對(duì)照菌株、C12及C16脂肪酸存在時(shí)相關(guān)性最低。進(jìn)一步根據(jù)基因轉(zhuǎn)錄信息對(duì)各樣品進(jìn)行聚類(lèi)分析,發(fā)現(xiàn)這4 個(gè)樣品的聚類(lèi)關(guān)系依次為C6、C16、C12及對(duì)照(圖1a、c)。進(jìn)一步對(duì)C6、C12及C16存在時(shí)酵母的轉(zhuǎn)錄情況進(jìn)行分析后發(fā)現(xiàn),加入脂肪酸C6、C12及C16的酵母均有5 553 個(gè)轉(zhuǎn)錄本被檢測(cè)到(包括預(yù)測(cè)的新轉(zhuǎn)錄本),C6特異性的轉(zhuǎn)錄本包括132 個(gè),C12特異性的轉(zhuǎn)錄本90 個(gè),C16特異性轉(zhuǎn)錄本63 個(gè),C12與C16共同轉(zhuǎn)錄本145 個(gè),C6與C12共同轉(zhuǎn)錄本67 個(gè),C6與C16共同轉(zhuǎn)錄本95 個(gè)(圖1b)。
2.2 不同鏈長(zhǎng)脂肪酸存在下基因表達(dá)差異分析
在本實(shí)驗(yàn)中,選取C6、C12以及C16脂肪酸分別代表不同鏈長(zhǎng)的脂肪酸,通過(guò)轉(zhuǎn)錄組測(cè)序發(fā)現(xiàn)C6及C12相比差異最為不同,其中上調(diào)基因?yàn)?66 個(gè)而下調(diào)基因?yàn)? 087 個(gè),而與長(zhǎng)鏈的脂肪酸如C16相比則上調(diào)307 個(gè),下調(diào)733 個(gè)(圖2)。與對(duì)照未加脂肪酸菌株BY4741相比,加入脂肪酸之后,其中C6對(duì)釀酒酵母影響最大(上調(diào)基因591 個(gè),下調(diào)基因317 個(gè)),此外,從數(shù)據(jù)分析來(lái)看,不同鏈長(zhǎng)的脂肪酸加入酵母細(xì)胞之后,酵母胞內(nèi)的基因表達(dá)差異更為明顯,這提示酵母細(xì)胞對(duì)不同鏈長(zhǎng)的脂肪酸表現(xiàn)出不同的反應(yīng)機(jī)制。

圖2 不同脂肪酸存在條件下的釀酒酵母基因表達(dá)差異情況分析Fig. 2 Differential expression of genes in S. cerevisiae in the presence and absence of fatty acids with different chain lengths
目前,已有報(bào)道包括釀酒酵母對(duì)多不飽和脂肪酸的響應(yīng)[23]以及釀酒酵母對(duì)抗辛酸(C8)及癸酸(C10)的反應(yīng)機(jī)制[24-25]等。本研究將結(jié)合已有的資料進(jìn)一步分析其對(duì)不同鏈長(zhǎng)脂肪酸的響應(yīng)情況等。分別與對(duì)照未加入任何脂肪酸的菌株相比,3 種不同鏈長(zhǎng)的脂肪酸共使得21 個(gè)基因上調(diào)及18 個(gè)基因下調(diào)(選取log2比值不小于1的進(jìn)行統(tǒng)計(jì))。C6、C12及C16脂肪酸均顯著促進(jìn)UTP15、URA7、FDR4、PET117等基因的上調(diào),在3 種不同鏈長(zhǎng)的脂肪酸存在條件下,其與對(duì)照菌株相比,上調(diào)的倍數(shù)較為一致,這體現(xiàn)出3 種不同鏈長(zhǎng)脂肪酸共同促進(jìn)基因上調(diào)的趨勢(shì)較為一致。而對(duì)于3 種鏈長(zhǎng)脂肪酸均使得轉(zhuǎn)錄水平下調(diào)的基因來(lái)說(shuō),C6、C12及C16均顯著抑制基因TOD6、TRM2、FEX1、STH1、RAD7、HEK2、POB3、NUP53、FMP49等的轉(zhuǎn)錄,而C6明顯抑制PHO5、LCP5及POL31基因的轉(zhuǎn)錄,C12則明顯抑制CRP1基因的轉(zhuǎn)錄(表1)。同時(shí),實(shí)驗(yàn)還對(duì)不同脂肪酸對(duì)釀酒酵母基因轉(zhuǎn)錄的影響進(jìn)行了比較,C6與C12均會(huì)使得RCK2、YBR056W、YBR287W、PEX5、POX1、SAM50、PUS2、GPB2基因轉(zhuǎn)錄水平上調(diào),SMM1、ETS1-1、ETS1-2、YLR256W-A、YIL156W-B、snR31、NME1、CEX1、MSG5、GFD1基因轉(zhuǎn)錄水平下調(diào)。C6與C16對(duì)釀酒酵母轉(zhuǎn)錄影響一致的基因包括37 個(gè),其中RDH54、MRP10、ATG34、NST1、PHM8、MRPL32、SLU7、UBP10、SPC72、SNA2、RGD2基因上調(diào),IMD4、ADR1、RPA190、CHS2、FAS1等26 個(gè)基因下調(diào)。C12與C16對(duì)釀酒酵母轉(zhuǎn)錄影響一致的基因包括50 個(gè),其中16 個(gè)上調(diào),34 個(gè)下調(diào)。在此基礎(chǔ)上,剔除掉上述各個(gè)脂肪酸影響一致的基因之后,分別對(duì)C6、C12及C16脂肪酸分別對(duì)酵母基因轉(zhuǎn)錄水平的影響進(jìn)行分析(除去轉(zhuǎn)錄組測(cè)序時(shí)轉(zhuǎn)錄條數(shù)小于10,Read counts小于10的基因),發(fā)現(xiàn)C6特異性影響釀酒酵母的基因數(shù)為165 個(gè),C12為40 個(gè),C16為5 個(gè)。

表1 C6、C12及C16對(duì)釀酒酵母轉(zhuǎn)錄水平影響一致的基因Table 1 Transcription levels of genes in S. cerevisiae consistently affected by C6, C12 and C16

續(xù)表1
2.3 不同鏈長(zhǎng)脂肪酸存在下可能參與的轉(zhuǎn)錄因子及轉(zhuǎn)運(yùn)蛋白
在生物體內(nèi),轉(zhuǎn)錄因子的表達(dá)量相對(duì)較少,通過(guò)轉(zhuǎn)錄組測(cè)序并進(jìn)一步分析轉(zhuǎn)錄數(shù)據(jù),發(fā)現(xiàn)3 種不同鏈長(zhǎng)的脂肪酸存在條件下對(duì)于釀酒酵母體內(nèi)的轉(zhuǎn)錄因子的轉(zhuǎn)錄水平是有影響的,共有17 條轉(zhuǎn)錄因子的轉(zhuǎn)錄受到了影響(表2),其中HMRA1受到3 種鏈長(zhǎng)脂肪酸的影響后轉(zhuǎn)錄明顯上調(diào)。脂肪酸C6及C16促進(jìn)GSM1、SWI4、TEC1、RSC3轉(zhuǎn)錄因子的轉(zhuǎn)錄,短鏈脂肪酸C6與長(zhǎng)鏈脂肪酸C16相比明顯促進(jìn)上述基因的轉(zhuǎn)錄,中長(zhǎng)鏈脂肪酸C12則抑制以上轉(zhuǎn)錄因子的轉(zhuǎn)錄;而同樣C6及C16抑制CUP2、DUR1,2的轉(zhuǎn)錄,C12則相反使得其上調(diào)。此外,C6特異性促進(jìn)CIN5、YAP7、VPS72、HMLALPHA2、MATALPHA2、CAD1轉(zhuǎn)錄因子的轉(zhuǎn)錄(C12及C16抑制)而抑制ARG80的轉(zhuǎn)錄。3 種脂肪酸共同使得MCM1轉(zhuǎn)錄水平下調(diào)。

表2 3 種不同鏈長(zhǎng)脂肪酸對(duì)釀酒酵母轉(zhuǎn)錄因子轉(zhuǎn)錄水平的影響Table 2 Inf l uence of fatty acids with different lengths on transcript factors in S. cerevisiae
進(jìn)一步對(duì)3 種鏈長(zhǎng)脂肪酸存在條件下,對(duì)轉(zhuǎn)運(yùn)蛋白的基因轉(zhuǎn)錄情況進(jìn)行分析后發(fā)現(xiàn),共得到受3 種脂肪酸影響的轉(zhuǎn)運(yùn)蛋白有61 個(gè),進(jìn)一步對(duì)其中40 個(gè)轉(zhuǎn)運(yùn)蛋白進(jìn)行分析(表3),其中11 個(gè)基因均受C6、C12及C16的影響,ALR1、RIP1、MRH1、QCR9、ATR7及QCR7分別被上調(diào)而KAP120、DNF2、THI7、FMP49及MMP1被下調(diào);C6及C12均會(huì)導(dǎo)致APL1、TRK1、QCR8及QCR6基因轉(zhuǎn)錄水平的上調(diào)而C12及C16對(duì)轉(zhuǎn)運(yùn)蛋白影響相一致的基因包括12 個(gè),其中3 個(gè)上調(diào),9 個(gè)下調(diào);此外,C6特異性影響8 個(gè)轉(zhuǎn)運(yùn)蛋白的轉(zhuǎn)錄,C12特異性影響3 個(gè)而C16則特異性影響2 個(gè)。

表3 3 種不同鏈長(zhǎng)脂肪酸對(duì)釀酒酵母中轉(zhuǎn)運(yùn)蛋白轉(zhuǎn)錄水平的影響Table 3 Inf l uence of fatty acids with different chain lengths on transporter proteins in S. cerevisiae
2.4 不同鏈長(zhǎng)脂肪酸對(duì)脂肪酸合成途徑的影響
釀酒酵母脂肪酸合成途徑包括前期脂肪酸合成到16 個(gè)碳脂肪酸之后進(jìn)入長(zhǎng)鏈脂肪酸的合成,而脂肪酸機(jī)體需要時(shí)可以通過(guò)β氧化途徑進(jìn)一步降解為乙酰輔酶A(圖3),通過(guò)轉(zhuǎn)錄組測(cè)序,進(jìn)一步比較分析不同鏈長(zhǎng)脂肪酸存在條件下,釀酒酵母脂肪酸的合成及降解途徑受到的影響,發(fā)現(xiàn)與對(duì)照未加任何脂肪酸酵母菌株相比,3 種不同鏈長(zhǎng)的脂肪酸存在條件下,8 個(gè)基因的轉(zhuǎn)錄水平受到了影響,其中除2 個(gè)不飽和脂肪酸降解所需的異構(gòu)酶ECI1及ECI2外,其他6 個(gè)基因在圖3中標(biāo)注了其作用位點(diǎn)。從圖3可發(fā)現(xiàn),以C12為代表的中長(zhǎng)鏈脂肪酸在整個(gè)釀酒酵母的脂肪酸合成及降解過(guò)程中均起到促進(jìn)基因轉(zhuǎn)錄的作用,如ACC1、FAS1、FAS2、ELO1、FAA3及POX1;而短鏈脂肪酸C6則抑制脂肪酸的合成過(guò)程中ACC1、FAS1及FAS2的轉(zhuǎn)錄及長(zhǎng)鏈脂肪酸的合成相關(guān)基因Elo1,C6卻促進(jìn)脂肪酸降解途徑β氧化途徑關(guān)鍵酶基因POX1的轉(zhuǎn)錄水平上調(diào);C16與C6作用相似,但是其與C6脂肪酸不同的是,C16促進(jìn)長(zhǎng)鏈脂肪酸的合成,抑制了脂肪酸到乙酰輔酶A的降解過(guò)程。
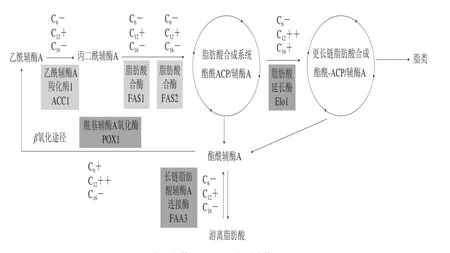
圖3 3 種不同鏈長(zhǎng)脂肪酸對(duì)釀酒酵母脂肪酸合成及降解途徑的影響Fig. 3 Effects of fatty acids with different chain lengths on fatty acid biosynthesis and degradation pathways in S. cerevisiae
3 討論與結(jié)論
本研究通過(guò)轉(zhuǎn)錄組測(cè)序分析了不同鏈長(zhǎng)脂肪酸對(duì)于釀酒酵母基因轉(zhuǎn)錄水平的影響,結(jié)果發(fā)現(xiàn)3 種脂肪酸中短鏈脂肪酸如C6對(duì)酵母基因的轉(zhuǎn)錄水平影響最大,相比于C12及C16脂肪酸,C6對(duì)酵母細(xì)胞的形成過(guò)程、細(xì)胞膜的組成以及細(xì)胞的生長(zhǎng)及凋亡等影響最為明顯,如MIC27、RGI1、PIC2、INH1、ATP1、YPR010C-A、ATP3、EXO70、MGM1、IRR1、YKR078W、MCR1、SST2、CLB4、GRX1、STE2、PEP12、GIN4、COX12、TOM70、ATP25、RNY1、CMK2、AIM24、GDI1、ISM1、COA6基因轉(zhuǎn)錄水平明顯上調(diào),而ALG3、TMA19、EMC3、SUR7、MCH5、RPS27B、HUT1、ERC1、ARG80、HEM1、PPX1、MDE1、NAP1、ARN2、RCL1、RPS21A、SMX3、EFM4、DUT1、PDR10、AIM46等基因則下調(diào),C6脂肪酸存在條件下,細(xì)胞受到脅迫后的應(yīng)激基因如FUS2、HSP82、HSP78、HSP104均明顯上調(diào);此外,C6脂肪酸存在時(shí)一些基因在基因信息的傳遞過(guò)程如結(jié)合、折疊、分選及降解過(guò)程、轉(zhuǎn)錄過(guò)程及翻譯調(diào)控過(guò)程等受到影響,這些基因包括RIE1、TPH3、TFA1、MSC1、HRR25、NMD2、ZTA1、COX6、DOG2、BAR1、DOA4、SKO1、MSH5、APL2、TMC1、MSS1、HFD1、RPL36B、YER152C、RPL23B、ADO1、RPA12、ITR1、OPI3等,此類(lèi)基因中明顯受C12影響的基因則包括RPN8、HDA2、MKT1、YKR070W等,相比之下,這類(lèi)基因中受C16脂肪酸影響的較少;3 種脂肪酸存在條件下除脂肪酸代謝途徑受到影響,糖的代謝途徑會(huì)受到一定影響,如C6導(dǎo)致SOL4、MDH1基因明顯上調(diào),而C12導(dǎo)致GSC2、INO1、PRM7基因明顯下調(diào);同時(shí),C6影響氨基酸代謝途徑中TDA10、MDE1基因上調(diào),而C12明顯使得TYR1基因上調(diào);值得關(guān)注的是,C16特異性影響基因HAM1明顯上調(diào),HAM1為三磷酸肌苷焦磷酸酶,為細(xì)胞中能量?jī)?chǔ)存過(guò)程中的酶[27-30]。
通過(guò)轉(zhuǎn)錄組測(cè)序,對(duì)一些可能的轉(zhuǎn)錄因子及轉(zhuǎn)運(yùn)蛋白進(jìn)行分析及預(yù)測(cè),在生物體內(nèi),轉(zhuǎn)錄因子的表達(dá)量并不多,在后續(xù)的實(shí)驗(yàn)中,將進(jìn)一步研究不同脂肪酸存在下,分析差異表達(dá)轉(zhuǎn)錄因子的功能,同時(shí)將結(jié)合不同脂肪酸的表達(dá)差異基因進(jìn)一步尋找不同的轉(zhuǎn)錄因子[27,30]。而對(duì)于轉(zhuǎn)運(yùn)蛋白的差異,后續(xù)的實(shí)驗(yàn)需要進(jìn)一步對(duì)其驗(yàn)證,轉(zhuǎn)運(yùn)蛋白對(duì)于釀酒酵母生物合成脂肪酸途徑具有重要意義。
最后本研究分析不同脂肪酸存在下,釀酒酵母脂肪酸合成途徑受到的影響,研究發(fā)現(xiàn)短鏈及中長(zhǎng)鏈脂肪酸可一定程度上促進(jìn)β氧化途徑的進(jìn)行,中長(zhǎng)鏈脂肪酸促進(jìn)整個(gè)脂肪酸合成及延伸途徑的進(jìn)行,而長(zhǎng)鏈脂肪酸促進(jìn)長(zhǎng)鏈脂肪酸的延伸過(guò)程,對(duì)于此現(xiàn)象的機(jī)理還需要進(jìn)一步研究。
本研究通過(guò)高通量測(cè)序分析不同鏈長(zhǎng)脂肪酸存在條件下,釀酒酵母體內(nèi)基因轉(zhuǎn)錄的差異,為后續(xù)研究釀酒酵母脂肪酸合成途徑的動(dòng)態(tài)感應(yīng)調(diào)控元件提供了豐富的數(shù)據(jù)資源。

