3.0T MRI彌散加權成像對腦膠質瘤分級的診斷價值分析
李鴻波,程春紅,張波
武漢市第六醫院(江漢大學附屬醫院)1放射科,2功能科,武漢 430015 00
腦膠質瘤是常見的原發性腫瘤,2016年世界衛生組織(WHO)中樞神經系統腫瘤分類標準中描述,對Ⅰ~Ⅱ級腦膠質瘤患者進行局部切除治療并配合放療或化療,患者多能獲得良好的預后,而Ⅲ~Ⅳ級腦膠質瘤的切除范圍廣泛,即使對患者進行綜合治療,患者的預后仍較差[1]。磁共振成像(magnetic resonance imaging,MRI)作為經典的影像學手段,其在腦膠質瘤的應用中雖然能夠有效地定位腫瘤,準確地反映腫瘤侵犯的程度,并幫助臨床初步明確腫瘤組織類型,但是對腫瘤組織學分級和微觀組織狀態的定量描述仍需依賴術后組織病理學檢查;又因高級別的腦膠質瘤合并Ⅱ~Ⅳ級連續的組織學特征,因此,活檢取樣部位也會影響腫瘤的分級,不利于治療方案的選擇,從而影響患者預后[2]。MRI彌散加權成像(diffusion-weighted imaging,DWI)通過水分子擴散運動測量小分子物質在組織內的布朗運動情況,從微觀角度體現腫瘤的病理狀態,并通過表觀彌散系數(apparent diffusion coefficient,ADC)值對擴散情況進行量化分析[3]。為了進一步探討DWI在腦膠質瘤分級中的應用價值,本研究對124例腦膠質瘤患者的臨床資料進行回顧性分析,現報道如下。
1 資料與方法
1.1 一般資料
回顧性分析2013年1月至2017年12月武漢市第六醫院(江漢大學附屬醫院)收治的腦膠質瘤患者的臨床資料。納入標準:①符合腦膠質瘤的診斷標準[4],且經手術病理學檢查證實;②術前行頭顱MRI平掃、增強掃描和DWI檢查,且相關影像學資料保存完整。排除標準:①有放療史或化療史;②檢查時間與行腦膠質瘤手術切除的時間間隔≥1周;③圖像質量不佳(如有運動偽影)。根據納入和排除標準,本研究共納入124例腦膠質瘤患者。其中,男72例,女52例;年齡為20~65歲,平均年齡為(39.27±5.25)歲;低級別腦膠質瘤60例,高級別腦膠質瘤64例;腫瘤直徑為14~65 mm,平均腫瘤直徑為(33.14±10.25)mm。
1.2 設備與方法
1.2.1 MRI掃描設備掃描設備選擇Discovery MRI 750 3.0T磁共振掃描儀(美國GE公司),配備8通道頭部相控表面線圈。具體掃描方法:全部患者均先行常規平掃,掃描橫斷面T1加權成像(T1 weighted imaging,T1WI)、T2加權成像(T2 weighted imaging,T2WI)、液體衰減反轉恢復(fluid-attenuated inversion recovery,FLAIR)及橫斷面T1WI增強序列;橫斷面DWI掃描采用平面回波(echo planer imaging,EPI)序列。掃描參數設置:重復時間(repetition time,TR)2300 ms,回波時間(echo time,TE)65.5ms,b=1000s/mm2,視野(field of view,FOV)24 cm×24 cm,矩陣160×160,層厚5.0 mm,層間距1.0 mm,共采集4次,擴散梯度方向選取x、y、z三個方向。
1.2.2 ADC值測量將所采集數據傳送至AW4.1工作站進行后處理,后處理軟件為Functool 2.0,影像資料由2位以上高年資醫師采用雙盲法閱片,分別獨立測量腦膠質瘤的ADC值,并結合橫斷面T2WI、FLAIR序列及橫斷面T1WI增強序列進行定位,在定位時,應盡可能地避開腫瘤邊緣、壞死、囊變、出血、鈣化及偽影區域,并在腫瘤直徑最大層面的實性均勻部位選擇3個面積相同的感興趣區域,即面積范圍為50~100 mm2的圓形區域,并測量其ADC值;并隔日重復上述步驟再次測量ADC值。若兩次均值變異系數范圍﹤10%則取均值作為最終的ADC值,若兩次均值變異系數范圍≥10%則需重新重復上述步驟再次測量。
1.3 手術病理分級診斷標準
參照2007年WHO制定的中樞神經系統腫瘤分類標準[4]及彭令榮等[5]研究中的低級別及高級別腦膠質瘤的ADC最佳臨界值對腫瘤進行病理分級:Ⅰ級惡性程度較低,主要有毛細胞型星形細胞瘤、室管膜下巨細胞星形細胞瘤等;Ⅱ級為多形性黃色星形細胞瘤或彌漫性星形細胞瘤等,可進展至Ⅲ級膠質細胞瘤,且腫瘤細胞的細胞核具有一定的異型性,伴或不伴有核分裂、微囊變性,患者的生存期通常長于5年;Ⅲ級則為間變性星形細胞瘤、間變性少突膠質瘤等,患者的生存期僅為2~5年,瘤體密度高,且腫瘤細胞普遍存在核分裂現象;Ⅳ級則為膠質母細胞瘤、膠質肉瘤等,患者的平均生存期不足1年,腫瘤細胞排列密集,血管內可見柵欄樣、凝固性壞死,并可見血栓形成,惡性程度最高。其中,Ⅰ~Ⅱ級為低級別腦膠質瘤,以ADC值1.11×10-3mm2/s為最佳臨界點;Ⅲ~Ⅳ級為高級別腦膠質瘤,以ADC值0.93×10-3mm2/s為最佳臨界點。
1.4 觀察指標
靈敏度=真陽性例數/(真陽性+假陰性)例數×100%;特異度=真陰性例數/(真陰性+假陽性)例數×100%;準確率=(真陽性+真陰性)例數/總例數×100%;陽性預測值=真陽性例數/(真陽性+假陽性)例數×100%;陰性預測值=真陰性例數/(真陰性+假陰性)例數×100%。
1.5 統計學方法
采用SPSS 19.0軟件對數據進行統計分析。計數資料以例數和率(%)表示,組間比較采用χ2檢驗。以P﹤0.05為差異有統計學意義。
2 結果
2.1 ADC值對低級別和高級別腦膠質瘤的診斷效能分析
以ADC值1.11×10-3mm2/s為最佳臨界點,ADC值≥1.11×10-3mm2/s即為低級別腦膠質瘤,3.0T MRI DWI診斷低級別腦膠質瘤的靈敏度為93.33%,特異度為93.75%,準確率為93.55%,陽性預測值為93.33%,陰性預測值為93.75%。以ADC值0.93×10-3mm2/s為最佳臨界點,ADC值﹤0.93×10-3mm2/s即為高級別腦膠質瘤。3.0T MRI DWI診斷高級別腦膠質瘤的靈敏度為81.25%,特異度為93.33%,準確率為87.10%,陽性預測值為92.86%,陰性預測值為82.35%。兩種ADC值診斷腦膠質瘤的靈敏度比較,差異有統計學意義(χ2=4.023,P﹤0.05)。(表1、表2)
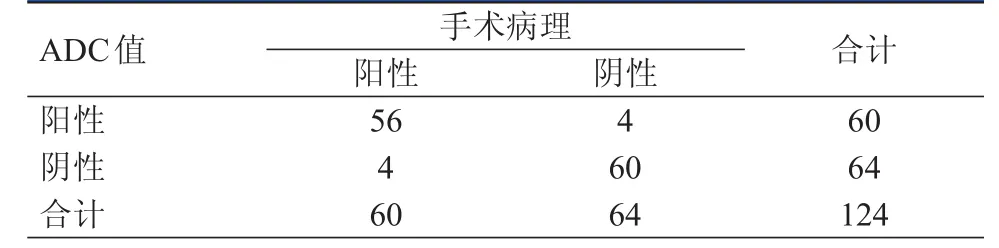
表1 ADC值與手術病理對低級別腦膠質瘤診斷結果對照
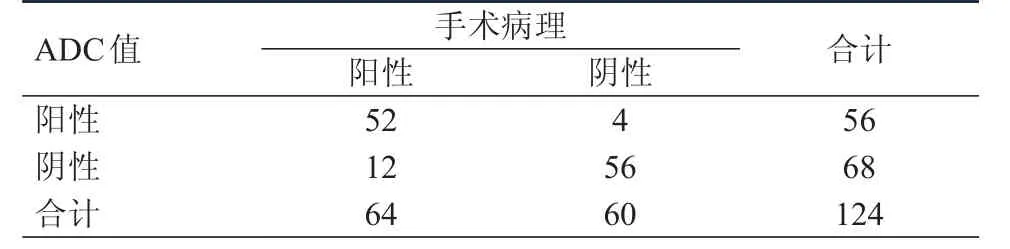
表2 ADC值與手術病理對高級別腦膠質瘤的診斷結果對照
2.2 影像學資料
2.2.1 病例1女,34歲,經手術病理明確診斷為節細胞腦膠質瘤,參照2007年WHO中樞神經系統腫瘤分級標準為低級別腦膠質瘤Ⅰ級,MRI掃描可見T2WI呈均勻稍高信號,DWI呈等信號或稍高信號,ADC值為1.276×10-3mm2/s。(圖1)
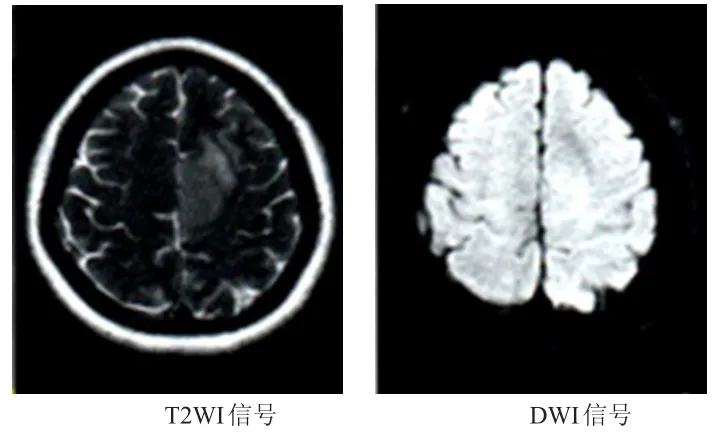
圖1 34歲女性節細胞腦膠質瘤患者的MRI平掃圖像
2.2.2 病例2 男,61歲,經手術病理明確診斷為典型的腦膠質瘤,參照2007年WHO中樞神經系統腫瘤分級標準為高級別腦膠質瘤Ⅳ級,MRI可見T2WI及DWI均呈不均勻高信號,并具有明顯占位效應,ADC值為0.717×10-3mm2/s。(圖2)
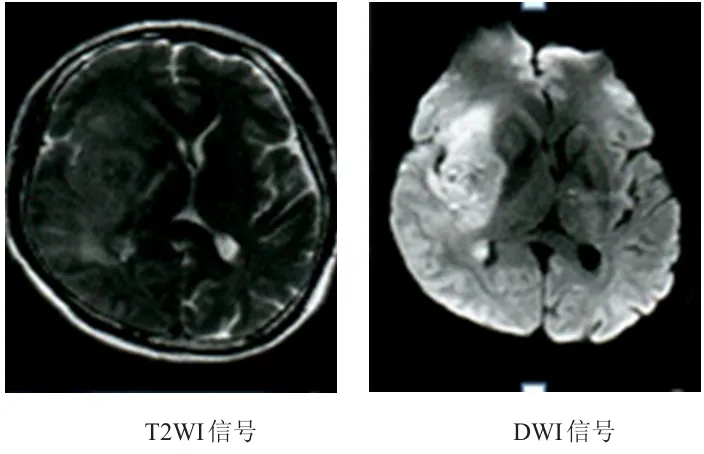
圖2 61歲男性高級別腦膠質瘤患者的MRI平掃圖像
3 討論
DWI的ADC值能夠反映水分子的運動情況[6]。因腦膠質瘤區域的正常腦組織被腫瘤細胞侵襲,因此,隨著腫瘤細胞的增多、瘤體的增大,細胞間隙亦發生變化并最終影響水分子的擴散運動,因此,腫瘤細胞構成比及細胞核與細胞質的平均截面積比值均可能導致ADC值下降。腫瘤細胞的惡性程度以及腫瘤細胞的侵襲、轉移能力均與腫瘤細胞的增殖、構成和密度密切相關[7]。2012年的中國中樞神經系統膠質瘤診斷和治療指南[8]亦指出,低級別腦膠質瘤患者僅需接受外科手術切除,術后無需接受放化療便可獲得良好的預后,而高級別腦膠質瘤具有明顯的侵襲性,腫瘤以浸潤性生長的方式向周圍組織擴散,難以對腫瘤組織及正常腦組織進行有效區分,因此,即使行外科手術切除也難以獲得滿意的預后,因為,此類患者多需給予外科手術切除、術后放化療并聯合替莫唑胺進行綜合治療。由此可見,如何對腦膠質瘤的分級進行準確診斷,對于患者的治療方案、預后等均具有重要的價值[9-10]。
DWI作為彌散成像技術中最簡單的一種成像手段,可通過對組織各方向的彌散運動平均值即ADC值描述腦組織的彌散情況,因其組織中的腫瘤細胞數量相對較少,且細胞有絲分裂和血管內皮細胞增殖均不明顯,因此,細胞間隙大,水分子擴散快,從而導致ADC值上升;而高級別腦膠質瘤細胞異型性明顯,血管內皮細胞的增殖速度快,腫瘤細胞的密度大,因此,細胞間隙少,水分子擴散受限,從而導致ADC值下降[11]。本研究發現,分別以ADC值1.11×10-3mm2/s、0.93×10-3mm2/s作為診斷低級別腦膠質瘤和高級別腦膠質瘤的診斷臨界值時,其診斷低級別腦膠質瘤的靈敏度為93.33%,特異度為93.75%,準確率為93.55%,陽性預測值為93.33%,陰性預測值為93.75%;其診斷高級別腦膠質瘤的靈敏度為81.25%,特異度為93.33%,準確率為87.10%,陽性預測值92.86%,陰性預測值82.35%,這與彭令榮等[5]的報道相符;而Hu等[12]以1.115×10-3mm2/s為低級別腦膠質瘤診斷的最佳臨界值,診斷的靈敏度和特異度分別為82.70%、85.20%,略低于本研究中低級別腦膠質瘤的診斷靈敏度和特異度,分析原因可能是由于進行MRI掃描時b值的選擇差異所致,本研究僅應用1個b值(1000 s/mm2),而Hu等[12]的研究則采用了多個b值;但是,亦可發現,ADC值對腦膠質瘤分級的診斷價值依然是較高的,值得臨床重視。
綜上所述,ADC值對腦膠質瘤分級的診斷具有重要的價值。但是,本研究亦存在一定的局限性,如樣本量較小,且DWI用于腦膠質瘤分級的診斷時,雖然能夠通過對腫瘤細胞形態學、功能學特點的描述輔助觀察腫瘤的微觀構造,從而提供高價值的影像學資料,但是,也有部分低級別或高級別腦膠質瘤在進行ADC值測量時存在一定的重疊現象,加之受腫瘤細胞內部出現囊變、出血及壞死等因素的影響,往往出現磁場不均勻,而DWI對磁場不均勻尤其敏感,因此,極容易造成ADC值出現誤差;另外,目前診斷低級別及高級別腦膠質瘤的ADC最佳臨界點并未見權威且統一的標準將其規范化,因此,使用DWI評價腦膠質瘤的分級還存在巨大的深入探究空間,仍需進行大樣本、多中心的研究予以佐證。

