納米珍珠粉/殼聚糖-透明質酸支架修復兔股骨遠端骨缺損的實驗研究
王秋子,徐 普,李 娜,陳明煒,張文柏
中南大學湘雅醫學院附屬海口醫院 海南省口腔醫學中心種植科,海口 570100
骨缺損為臨床較為常見的現象,當缺失過大或自我修復能力下降時,則需要人為干預促進骨組織再生。骨缺損的修復是一個嚴峻的挑戰,常需要昂貴的費用及較長的恢復時間,且在復雜的臨床情況下效果不理想[1],無論是自體骨還是異體骨在臨床使用上均存在缺陷[2]。因此,骨缺損的修復成為學者們的研究熱點[3,4]。
隨著生物材料的發展,目前骨組織工程中常見的生物支架都存在生物力學性能不佳的共性。珍珠粉作為天然生物材料,在2000年前已作為中藥成分使用,具有較好的藥用價值,現代珍珠粉已被添加于化妝品、保健品等外用或內服的產品中,得到廣泛認可。珍珠內部無機物晶體與有機基質相互交錯排列成“磚墻結構”,致密均勻,排列整齊。無機晶體多為板層狀文石型碳酸鈣,常見的有多邊形或六邊形,多種有機基質分布于碳酸鈣板層間,形成特殊的物理學特性。
課題組前期研究結果表明,珍珠粉其微觀結構類似于天然骨組織,有機-無機復合的板層樣結構決定其具有良好的力學性能[5],同時,體內外實驗均顯示珍珠粉具有良好的促成骨作用[6-8]。然而粉劑材料存在團聚、孔隙率不穩定、難以維持骨修復空間等問題,且臨床使用中操作不方便,導致流失較多或充填不均勻。因此課題組進一步研制出NPP/C-HA支架,并對支架物理性能檢測,其符合骨組織中理想生物支架要求,而體外實驗表明支架可促進小鼠前成骨干細胞增殖分化[9]。本文以此為基礎旨在探討NPP/C-HA復合支架的體內促成骨效果。
1 材料與方法
1.1 材料合成
以蒸餾水為介質通過機械球磨法獲得納米級珍珠粉(圖1),過120目篩備用。殼聚糖(4wt%)和透明質酸(1wt%)分別溶于1%的醋酸,于攪拌機中以2 000 rpm攪拌5分鐘,室溫靜置24小時,將殼聚糖和透明質酸混合,再以2 000 rpm攪拌5分鐘,然后加入納米珍珠粉(10wt%),以2 000 rpm再攪拌5分鐘,澆鑄于96孔板中,置于-20 ℃冷凍24小時后,冷凍干燥48小時,取出制備好的復合支架(支架規格:7 mm×10 mm圓柱體),經Co-60γ消毒后置于-20 ℃冰箱密封保存備用。

圖1 納米級珍珠粉掃描電鏡圖Fig.1 Scanning electron microscopy of nanometer pearl powder
1.2 骨缺損模型的建立
實驗符合《關于善待實驗動物的指導性意見》的要求,并通過中南大學湘雅醫學院附屬海口醫院倫理委員會審查(2016科研倫審-002)。
取36只6~10月齡新西蘭大白兔(SCXK<湘>2014-0011),雄兔,2.5~3 kg,適應性喂養7天。全麻下進行骨缺損制備,隨時關注實驗兔麻醉狀態,待呼吸平穩,以腹式呼吸為主、角膜反射消失、肌肉松弛及對皮膚夾捏無反應時,認為麻醉深度良好。
將36只新西蘭大白兔隨機分為4組,A組為空白對照組、B組為殼聚糖-透明質酸組(C-HA組)、C組為納米珍珠粉組(NPP組)、D組為納米珍珠粉/殼聚糖-透明質酸組(NPP/C-HA組),每組9只。術區備皮,消毒,于雙側股骨髁外側縱行切口,暴露股骨遠端,以干骺線為參照制備直徑7 mm,深度10 mm的骨缺損。術中使用4 ℃無菌0.9%NaCl沖洗降溫。按不同分組于骨缺損區植入不同材料,空白組不植入任何外來材料。造模過程為單盲實驗。
術后使用抗生素及鎮痛藥,繼續飼養。術后第4周,第8周,第12周對實驗兔行安樂死,取雙側股骨髁標本進行下一步觀察。
1.3 觀察指標
1.3.1 大體觀察
術后觀察實驗兔活動情況、進食進水情況、排便情況、傷口愈合情況、周圍組織反應以及骨缺損區骨修復情況等。
1.3.2 影像學觀察
造模前后,術后第4周、第8周、第12周行雙側股骨CBCT檢查。統一拍攝條件,通過掃描數據進行三維重建,并進行Lane-Sandhu X射線評分,評估骨缺損區骨組織愈合情況及骨化情況。
1.3.3 血清骨堿性磷酸酶含量測定
于0、2、4、6、8、10、12周抽取兔耳中央動脈血,離心后使用Elisa試劑盒檢測血清中BALP含量。
1.3.4 組織學觀察
術后第4周、第8周和第12周每組處死3只實驗兔,取雙側骨缺損區標本,厚度約4 mm,置于10%福爾馬林,經脫鈣、包埋、切片、封片后行HE染色及Masson染色,評估正常骨組織與缺損區連接處新生骨組織情況及骨組織成熟度。
1.4 統計學方法
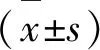
2 結果
2.1 大體觀察
所有實驗兔均在2小時內蘇醒,術后3天活動較少,飲食飲水均較差,排便減少。術后7天拆線,傷口愈合良好,未出現明顯感染現象,飲食飲水等生活習慣基本恢復正常。術后及處死時,術區未見明顯紅腫、溢膿等局部炎癥。骨缺損區標本見軟組織附著,缺損區被新生組織充填,骨面凹陷。

圖2 術后第4、8、12周與造模后的CBCT對比Fig.2 Comparison of CBCT 4,8,and 12 weeks after surgery with after modeling注:A:空白對照組,B:C-HA組,C:NPP組,D:NPP/C-HA組,1為造模后,2為術后第4周,3為術后第8周,4為術后第12周,箭頭為缺損區域。Note:A:blank control group,B:C-HA group,C:NPP group,D:NPP/C-HA group,1 is after modeling,2 is the 4th week after surgery,3 is the 8th week after surgery,4 is the 12th week after surgery,the arrow indicates position is defect area.

圖3 不同時間段的3D重建對比Fig.3 Comparison of 3D reconstruction in different time注:A:空白對照組,B:C-HA組,C:NPP組,D:NPP/C-HA組,1為術后第4周,2為術后第8周,3為術后第12周。Note:A:blank control group,B:C-HA group,C:NPP group,D:NPP/C-HA group,1 is the 4th week after surgery,2 is the 8th week after surgery,3 is the 12th week after surgery.
2.2 影像學
由CBCT可知(圖2),造模后四組均可見低密度的骨缺損區,C組呈現高密度影,D組密度較AB組稍高。術后第4周,各組缺損區邊緣不規則,C組高密度充填影變小,D組缺損區密度更均勻。術后第8周,各組缺損區有所變小。術后第12周,缺損區大小進一步縮小,A組缺損區密度略高于造模后,B組缺損區邊緣密度明顯增高,C組缺損區邊界難以分辨,中心區域密度仍較低,D組缺損區被新生骨組織充填,其密度高于正常骨組織。
三維重建可知(圖3),每組隨著時間的增加,同樣缺損區面積變小,但在觀察期內缺損區未被完全充填。同一時間各組也存在差別,D組缺損區面積最小,B組與C組相差無幾,BCD組缺損區面積較A組均小,且D組缺損區表面骨質更為光滑,其他組骨面凹凸不平。
將CBCT圖像根據Lane-sandhu X射線評分進行統計分析,統計結果如表1、圖4。

表1 各組不同時間點Lane-sandhu X射線評分分析結果
注:A:空白對照組,B:C-HA組,C:NPP組,D:NPP/C-HA組,*P< 0.05,**P< 0.01。
Note:A:blank control group,B:C-HA group,C:NPP group,D:NPP/C-HA group,*P< 0.05,**P< 0.01.
第8周和第12周中各組比較差異具有統計學意義,組間兩兩比較如圖4,第8周時,D組AB組比較P<0.05,第12周時,D組與ABC組比較P<0.05。

圖4 各組不同時間點Lane-sandhu X射線評分分析結果兩兩比較Fig.4 Pairwise comparisons of Lane-sandhu X-ray analysis results at different time points in each group注:A:空白對照組,B:C-HA組,C:NPP組,D:NPP/C-HA組,*為P<0.05,**為P<0.01。Note:A:blank control group,B:C-HA group,C:NPP group,D:NPP/C-HA group,*P<0.05,**P<0.01).
2.3 BALP含量測定
四組血清中BALP含量在0周至6周逐漸上升,在第6周時達到峰值,隨后開始下降,第12周時各組血清中BALP含量逐漸降低,接近初始水平(圖5)。

圖5 不同時間點各組血清中BALP含量變化Fig.5 Changes of BALP levels in serum at different time points in each groups注:A:空白對照組,B:C-HA組,C:NPP組,D:NPP/C-HA組。Note:A:blank control group,B:C-HA group,C:NPP group,D:NPP/C-HA group.
對各組數據進行統計分析(表2),第4周、第6周、第8周四組比較差異具有統計學。

表2 不同時間點各組血清中骨堿性磷酸酶含量
注:A:空白對照組,B:C-HA組,C:NPP組,D:NPP/C-HA組,*P< 0.05;**P< 0.01。
Note:A:blank control group,B:C-HA group,C:NPP group,D:NPP/C-HA group,*P< 0.05,**P< 0.01.
將第4周、第6周、第8周進行各組間兩兩比較(圖6)。第4周時NPP/C-HA組與其他三組比較均具有統計學意義,其中空白對照組與NPP組比較也具有統計學意義。在第6周時,NPP/C-HA組與空白對照組和C-HA組比較具有顯著差異,空白對照組與NPP組差異具有統計學意義。在第8周時,僅NPP/C-HA組與空白對照組差異具有統計學意義。

圖6 不同時間點各組血清中骨堿性磷酸酶含量兩兩比較Fig.6 Pairwise comparisons of bone alkaline phosphatase levels in serum at different time points in each groups注:A:空白對照組,B:C-HA組,C:NPP組,D:NPP/C-HA組,*為P<0.05,**為P<0.01。Note:A:blank control group,B:C-HA group,C:NPP group,D:NPP/C-HA group,*P <0.05,**P <0.01.
2.4 組織學觀察結果
2.4.1 HE染色
圖7,術后第4周,各組可見炎細胞浸潤,A組缺損區邊緣見新生纖維組織,靠缺損中心區域纖維組織疏松,B組見新生纖維組織長入材料間隙,有少量無規則結構的不成熟類骨質,C組未降解的珍珠粉成團分布于新生纖維間,D組缺損區邊緣致密的纖維組織與植入材料相互融合,纖維間見新生類骨質,B、C兩組新生骨周圍見成骨細胞。
術后第8周,各組未見炎性細胞浸潤,A組纖維間有少量新生類骨質,B組致密的纖維組織間見新生類骨質,內部含豐富的骨細胞,周圍見成骨細胞,C組不成熟的類骨質間見新生血管,D組缺損區纖維間同樣見新生類骨質,周圍見成骨細胞,且植入材料間有塊狀類骨質形成。
術后第12周,A組致密的纖維間有類骨質,但缺損區中心區域仍未被填滿,B組材料未完全降解,靠近缺損區中心的材料間隙新生組織較少,C組植入材料難以分辨,大量不成熟的類骨質周圍見成骨細胞,有新生血管存在,D組纖維由缺損區邊緣向植入材料移行,材料逐漸被不成熟的類骨質取代,大量新生的類骨質周圍見成骨細胞及新生血管。
2.4.2 Masson染色
圖8,術后第4周,A組缺損區邊緣正常骨組織呈紅藍相間,靠近缺損區的為藍染,B組見少量藍染的新生類骨質,其他多為紅藍相間的正常骨組織,C組未見明顯的新生類骨質,D組見明顯不規則的藍染類骨質。
術后第8,A組缺損區邊緣見不定型的藍染類骨質,B組新生藍染類骨質出現少許紅染,材料間隙未被新生組織填滿,C組見藍染的類骨質具有一定的形態,靠近缺損區一側的類骨質含較多骨細胞,先形成的類骨質出現紅染,D組藍染的類骨質具有規則的形態,內含大量骨細胞,早期形成的類骨質有紅染。
術后第12周,各組視野內均為藍染的新生類骨質,A組缺損區中心缺乏新生類骨質,B組致密的纖維間見不規則的藍染類骨質,C組見大量藍染類骨質,排列疏松,D組連接區有大量藍染的不規則的類骨質,早期形成的類骨質形態規則。

圖7 術后不同階段各組HE染色對比圖(x100,x200)Fig.7 Comparison of HE staining at different time after surgery in each group (x100,x200)注:A:空白對照組,B:C-HA組,C:NPP組,D:NPP/C-HA組,abcd為局部放大圖,箭頭為成骨細胞,B為骨組織,F為纖維組織,NB為新生骨組織,1為術后第4周,2為術后第8周,3為術后第12周。Note:A:blank control group,B:C-HA group,C:NPP group,D:NPP/C-HA group,a、b、c and d is partial enlarged drawing,B is bone tissue,F is fibrous tissue,NB is new bone tissue.

圖8 術后不同階段各組Masson染色對比圖(x100,x200)Fig.8 Comparison of Masson staining at different time after surgery in each group (x100,x200)注:A:空白對照組,B:C-HA組,C:NPP組,D:NPP/C-HA組,abcd為局部放大圖,箭頭為成骨細胞,B為骨組織,F為纖維組織,NB為新生骨組織,1為術后第4周,2為術后第8周,3為術后第12周。Note:A:blank control group,B:C-HA group,C:NPP group,D:NPP/C-HA group,a、b、c and d is partial enlarged drawing,B is bone tissue,F is fibrous tissue,NB is new bone tissue.
3 討論
目前骨組織工程中常見的羥基磷灰石吸收非常緩慢[10],人工合成高分子聚合物的降解產物呈弱堿性,可能會引起不良反應[11],并且生物力學均不佳。生物材料如殼聚糖[12]、透明質酸[13,14]等受到人們的歡迎,也都存在一定缺陷。為了完善材料性能,學者們常對其進行改性處理[15]。
本實驗中所用復合材料包括透明質酸、殼聚糖和納米珍珠粉。透明質酸自身性能不穩定,其中的陰離子基團(-COOH)可與殼聚糖中的陽離子基團(-NH2)發生反應生成穩定的聚合物[16]。在復合材料中再添加納米珍珠粉,珍珠粉顆粒可均勻分散于復合支架中,使支架獲得理想的孔隙結構和強度,所形成的三維支架更有利于細胞的生長及礦化,促成骨效果也得到進一步提升[17-19]。
實驗結果顯示機體與材料相互融合,組織細胞逐漸長入材料孔隙,隨著材料緩慢降解,新生組織也慢慢代替缺損區材料,表明植入材料具有良好的生物相容性。
影像學研究結果提示,隨著時間的延長,缺損區骨密度逐漸增高,骨組織逐步修復。骨修復的過程不僅有新生骨組織充填缺損區,也包括周圍組織的改建,隨著密度增高形成更為成熟更適應自身需求的骨結構。
研究報道常用堿性磷酸酶來評價成骨細胞的活性[20,21],但目前發現的6種同工酶中,僅有1種來源于成骨細胞,本實驗中選用特異性的BALP,更精確的體現了成骨細胞活性[22],隨著骨形成的相對增強而骨吸收相對減弱,成骨細胞活性增強,分泌大量BALP進入血液循環,表現為血清中BALP含量升高,更好的反應材料的促成骨作用。
NPP/C-HA組植入材料間隙中見未成熟的類骨質更多,隨著成骨細胞的分化成熟,形成成骨中心,進而逐漸有類骨質出現,體現其良好的成骨作用,且比其他組更能促進骨組織再生,說明其良好的骨傳導作用[23],但在骨質成熟度方面并沒有明顯的優勢。同時發現各組缺損區邊緣存在致密規則的纖維組織,而有研究表明纖維細胞可分泌與成骨細胞一樣的Ⅰ型膠原,促進骨愈合過程中的鈣鹽沉積,具有成骨潛能[24]。同時中心區域血供較差,細胞生長繁殖所需的營養難以很好的供給,所產生的代謝廢物也不能及時排出,成骨稍困難,因此缺損區邊緣成骨優于缺損區中心區域。
本實驗通過影像學、組織學和分子生物學分析了NPP/C-HA組復合支架對骨組織缺損的修復效果。該天然生物支架材料利用較低的成本可達到良好的成骨效果,符合理想支架材料的特性,在骨組織工程領域具有良好的應用前景。
本研究也存在一定的局限,實驗觀察時間為3個月,觀察期間各組缺損區均未完全修復,骨的完全修復或許需要更長時間,實驗中未對新生骨組織的機械性能做詳細檢測等。

