雙氫楊梅樹皮素與4種抗生素聯合對多重耐藥金黃色葡萄球菌體外抗菌作用研究
黃郁梅 洪正善 陳海鵬 楊柯 曾春暉
(廣西中醫藥大學,南寧 530001)
抗菌藥物的濫用導致耐藥菌株的產生,在某些條件下易使致病菌毒力增強而破壞宿主的正常菌群,其不合理使用則易引起嚴重的不良反應、二重感染等問題[1]。金黃色葡萄球菌(Staphylococcus aureus,SA)是引起多種感染的重要致病菌,由于在臨床及獸醫用藥上抗生素的亂用及濫用,導致SA出現耐藥,甚至呈現多重耐藥現象,使臨床治療及獸醫用藥治療難度加大,現已成為治療的重大難題之一。藤茶[Ampelopsis grossedentata(Hand-Mazz)W.T.Wang]系葡萄科蛇葡萄屬植物顯齒蛇葡萄的嫩莖葉,為瑤族民間藥用的草藥之一[2],性涼味甘、淡,具有清熱解毒、消腫止痛、祛風濕、強筋骨等功效,主治感冒風熱、咽喉腫痛、黃疸型肝炎、急性結膜炎等[3]。其主要化學成分是黃酮類化合物,其中以雙氫楊梅樹皮素(ampelopsis,APS)含量最高,高達38%[4]。又被稱之為雙氫楊梅素、白蘞素、蛇葡萄素等。體外抗菌研究結果表明:APS對耐甲氧西林金黃色葡萄球菌(methicillin-resistantStaphylococcus aureus,MRSA)、標準SA等臨床常見致病菌均有極高的抗菌活性,且優于鹽酸黃連素,表明APS有較強的抑制或殺滅細菌作用[5]。然而,APS對多重耐藥SA的體外抗菌及抗菌機制研究相對較少,為能尋找一種對細菌不易產生耐藥且能恢復耐藥菌株對抗生素敏感性的抗菌藥物,本實驗采用多步誘導法和瓊脂平皿二倍稀釋法,以青霉素為對照,通過測定誘導前后的MIC值,評價標準SA是否容易對APS產生耐藥;采用棋盤稀釋法測定單用APS、青霉素、慶大霉素、四環素、氯霉素對多重耐藥SA的MIC、MBC、及APS分別與這4種抗生素聯用對多重耐藥SA的FICI,評價APS與這4種抗生素聯用效果,考察APS分別與4種抗生素聯用對多重耐藥SA的抗菌作用。
1 實驗材料與儀器
1.1 實驗菌株
標準金黃色葡萄球菌(ATCC25923)由廣西中醫大學食品教研室提供;1株臨床分離多重耐藥金黃色葡萄球菌由廣西中醫藥大學第一附屬醫院提供,并鑒定其對青霉素、四環素、慶大霉素、氯霉素均耐藥。
1.2 主要藥物和試劑
APS:由廣西中醫藥大學中藥化學教研室提供,系從廣西藤茶[Ampelopsis grossedentata(Hand-Mazz)W.T.Wang]莖葉中分離、純化,為灰白色粉末,純度≥98%,結構式如圖1。

圖1 APS化學結構式Fig.1 The chemical structural formula of APS
實驗用APS配制:APS加50μL/mL DMSO助溶后,用無菌生理鹽水稀釋到所需濃度,再用0.22μmol/L針式過濾器過濾備用。
注射用青霉素鈉(桂林南藥股份有限公司 151107);硫酸慶大霉素注射液(河南潤弘制藥股份有限公司,批號:1707101);四環素片(廣東華南藥業集團有限公司,批號:170201);氯霉素注射液(國藥集團容生制藥有限公司,批號:1708313);氯化三苯四氮唑(TTC)(中國華東師范大學化工廠,批號:20101026);水解酪蛋白胨(MH)肉湯(廣東環凱微生物科技有限公司,批號:3105299);二甲基亞砜(DMSO)(天津市富宇精細化工有限公司,批號:20150105);營養瓊脂(北京陸橋技術有限責任公司,批號:1001079);MHB培養基(北京陸橋技術有限責任公司,批號:1608231);瓊脂(Beijing Solarbio,批號:1295D0330)。
1.3 主要儀器
SW-CJ-1F型潔凈工作臺(蘇凈集團蘇州安泰空氣技術有限公司);HVE-50型高壓滅菌鍋(廣州市深華生物技術有限公司);CD-UPT型純水儀(成都越純科技有限公司);SQP型電子天平(賽多利斯科學儀器(北京)有限公司);Mini-15K型高速離心機(杭州奧盛儀器有限公司)。
2 實驗方法
2.1 菌液配制
挑取培養好的菌落1~2個接種到3mL MH肉湯中,37℃振搖過夜。
2.2 APS誘導標準SA耐藥實驗
2.2.1 誘導濃度確定
根據前期實驗研究,可知APS對標準SA的MIC為125μg/mL,青霉素對標準SA的MIC為0.0244μg/mL,故選擇對標準SA有一定抗菌效果而又不完全抑制細菌生長的1/2MIC濃度作為初始誘導濃度。
2.2.2 藥物配置
稱取一定量APS,注射用青霉素鈉,用無菌生理水配制成一定濃度的溶液,過濾除菌即分別為藥液初濃度,根據倍比稀釋,將藥液用無菌生理鹽水稀釋成所需濃度。
2.2.3 誘導實驗[6]
吸取培養過夜菌液,加入藥液,混勻,使其藥物終濃度為1/2MIC,37℃振搖培養24h后,1500r/min,離心5min,棄上清液,調菌液濃度至106CFU/mL,再分別吸取100μL稀釋菌液接種于不含藥MHB瓊脂、1/2MIC濃度的含藥MHB瓊脂及MIC濃度的含藥MHB瓊脂平皿中,37℃培養24h觀察有無細菌生長;并設立空白對照,不加誘導藥液,進行相同操作;根據MHB瓊脂培養皿中細菌是否有細菌生長情況,調整誘導藥物濃度及含藥瓊脂濃度,若不含藥和含藥MHB瓊脂培養皿均有細菌生長,則挑取含藥瓊脂培養皿中單菌落接種至 MH肉湯中振搖培養過夜后, 倍比增加誘導藥物濃度繼續誘導;若不含藥MHB瓊脂培養皿有細菌生長,而含藥MHB瓊脂培養皿中無細菌生長,則藥物濃度不變繼續誘導;若不含藥和含藥MHB瓊脂培養皿均無細菌生長,則實驗結束,說明藥物不會誘導耐藥產生。
2.3 APS分別與4種抗生素聯用對多重耐藥SA體外抗菌效應實驗
2.3.1 APS及4種抗生素單用對多重耐藥SA的MIC、MBC測定[7]
藥物配制同“2.2.2”項,按棋盤稀釋法將藥物稀釋成9個濃度。藥物終濃度見表1。將培養過夜菌液用無菌MH肉湯調菌濃度至106CFU/mL。每孔加入100μL菌液、100μL藥液,并設立對照孔,37℃孵育18~24h后。每孔加入10mg/mL(1%)氯化三苯四氮唑(TTC)5μL,37℃孵育4h后觀察,有細菌生長孔呈紅色,不顯紅色的最低藥物濃度為藥物對待測菌的MIC。分別取藥物MIC以上未見細菌生長的各孔菌液50μL接種到不含藥物的營養瓊脂平皿上,置于37℃培養過夜,觀察有無細菌生長。平皿培養基中,計數少于5個菌落者作為該藥的最低殺菌濃度(MBC)。

表1 各藥物濃度Tab.1 Drug concentration
2.3.2 APS聯用抗生素對受試菌的FICI測定
藥物配制同“2.2.2”項,按棋盤稀釋法將藥物配成6個濃度。各藥物終濃度見表2。將培養過夜菌液用無菌MH肉湯調濃度至106CFU/mL。每孔加入100μL菌液、100μL藥液,并設立對照空,37℃孵育18~24h后。每孔加入10mg/mL(1%)氯化三苯四氮唑(TTC)5μL,37℃孵育4h后觀察,有細菌生長孔呈紅色。藥物體外的相互作用方式以協同抗菌指數(FICI)來判定。FICI為每一種藥物聯合抑菌時所需最低抑菌濃度(MIC)與單用時MIC的比值,FICI為兩種藥物部分抑菌濃度之和。FICI的計算與判段標準分別讀取兩點:一為A藥聯用的最低MIC;二為B藥聯用的最低MIC,分別記為MICA及MICB。兩藥單用時的MIC分別記為A、B。計算公式為:
FICI=MICA/A+MICB/B。當FICI≤0.5為協同作用;FICI=0.5~1.0為相加作用;FICI=1.0~2.0為無關作用;FICI>2.0為拮抗作用。
3 實驗結果
3.1 APS誘導標準SA耐藥實驗
實驗結果表明,APS與青霉素分別誘導標準SA 288h后,誘導菌株對32×MIC濃度下的青霉素產生耐藥,對APS未產生耐藥。青霉素在1/2MIC初濃度下誘導標準SA24h后,菌株出現MIC濃度耐藥;誘導濃度增加至MIC濃度繼續誘導48h后,出現2×MIC濃度耐藥;誘導濃度增加至4×MIC濃度誘導120h后,出現4×MIC濃度耐藥;誘導濃度增加至8×MIC濃度繼續誘導72h后,出現8×MIC濃度耐藥;誘導濃度增加至16×MIC濃度繼續誘導24h后,出現32×MIC濃度耐藥。而APS在1/2MIC初濃度下誘導標準SA 288h,未見耐藥菌株產生(表3和圖1)。
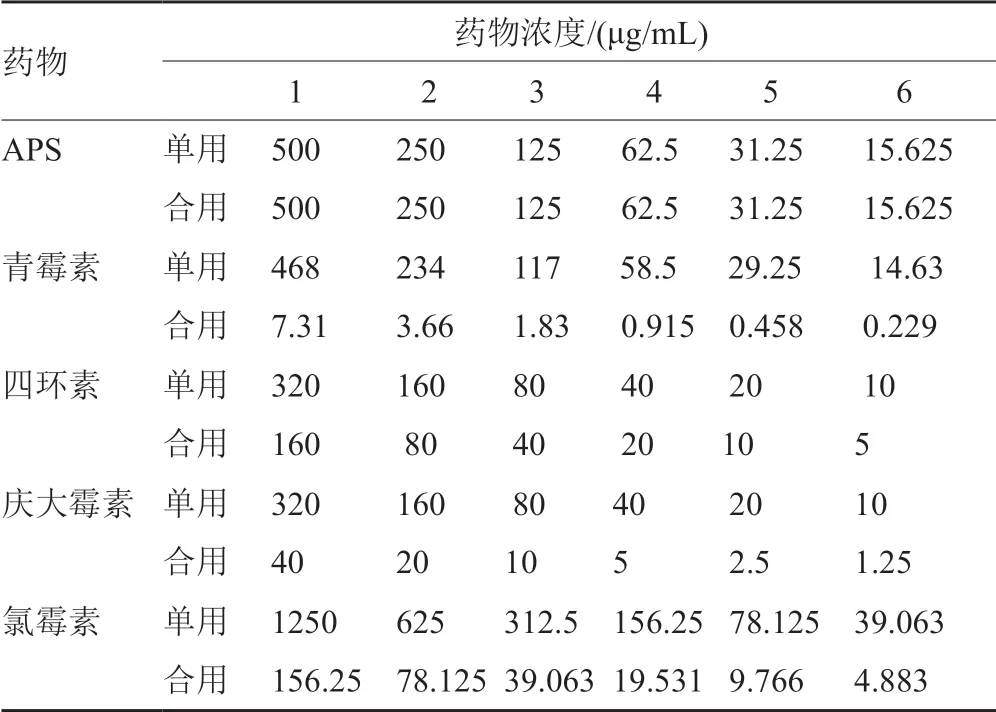
表2 各藥物單用及聯用終濃度Tab.2 The final concentration of each drug and its combination

表3 APS及青霉素誘導標準金黃色葡萄球菌耐藥/(μg/mL)Tab.3 APS and Penicillin induced resistance to standard Staphylococcus aureus/(μg/mL)
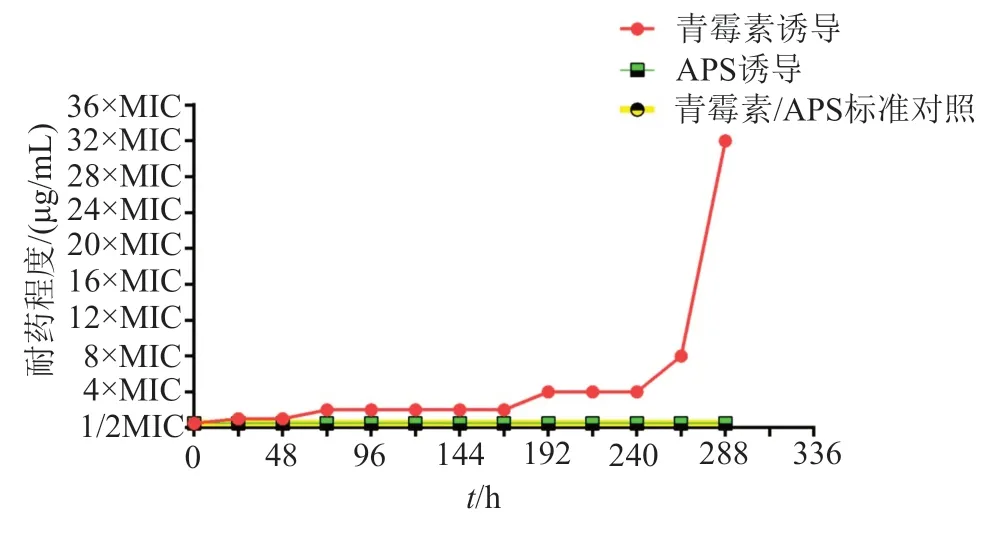
圖1 APS及青霉素誘導標準金黃色葡萄球菌耐藥Fig.1 APS and penicillin induced resistance to standard Staphylococcus aureus
3.2 APS分別與4種抗生素聯用對多重耐藥SA抗菌效應實驗結果
3.2.1 APS及4種抗生素單用對多重耐藥SA的MIC、MBC測定結果
實驗結果表明,單用APS、青霉素、四環素、慶大霉素、氯霉素對多重耐藥SA的MIC分別為125、29.25、40、40和78.125μg/mL,MBC分別為125、117、320、160和>1250μg/mL。提示APS對多重耐藥SA具有殺菌作用,青霉素、四環素、慶大霉素對多重耐藥SA高濃度殺菌,低濃度抑菌,氯霉素對多重耐藥SA具有抑菌作用(表4)。
3.2.2 APS分別與4種抗生素聯用對多重耐藥SA的FICI測定結果
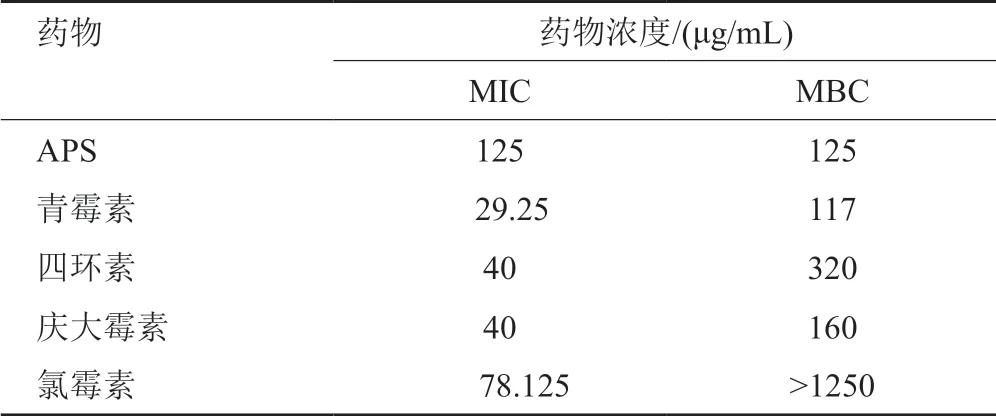
表4 APS及抗生素單用對多重耐藥SA的MIC、MBC結果Tab.4 The MIC and MBC results of APS and antibiotics alone against multidrug resistant SA
實驗結果表明,APS在單用MIC濃度下,分別與青霉素、四環素、慶大霉素、氯霉素聯用對多重耐藥SA的作用,隨著APS聯用濃度不同而表現出不同的抗菌效果。APS與青霉素聯用表現出協同或相加作用,以15.625μg/mL APS聯用青霉素對多重耐藥SA作用效果最佳,表現出協同抗菌作用,青霉素合用劑量降低為單用1/4;APS與四環素聯用表現出協同或協同作用,以31.25μg/mL APS聯用四環素對多重耐藥SA作用效果最佳,表現出協同抗菌作用,四環素合用劑量降低為單用1/8;APS與慶大霉素聯用表現出無關或相加作用,以62.5μg/mL APS聯用慶大霉素效果最佳,表現出相加抗菌作用,慶大霉素合用劑量降低為單用1/32;APS與氯霉素聯用表現出無關或相加作用,以62.5μg/mL APS聯用氯霉素效果最佳,表現出相加抗菌作用,氯霉素合用劑量降低為單用1/16。結果提示APS與4種抗生素聯用可恢復多重耐藥SA對抗生素的敏感性(表5)。

表5 APS聯用抗生素對多重耐藥SA的FICI結果Tab.5 The FICI results of multidrug resistant SA by APS in combination with antibiotics
3 討論
金黃色葡萄球菌在臨床及畜牧業造成的感染日益加重,是臨床常見的重要致病菌。近年,其耐藥率呈逐年上升趨勢,使得SA感染的治療難度大大加深。抗生素可用于治療人和動物因細菌感染而引發的疾病。但是,隨著其使用量不斷增多,細菌耐藥性問題也不斷凸顯,在臨床及畜牧業中被廣泛關注[8-9]。抗生素不僅能夠預防和治療細菌、真菌感染所引發的疾病,也能夠殺滅相應的腫瘤細胞,應用價值較高[10]。其中以青霉素、四環素、慶大霉素、氯霉素分別為β-內酰胺類、氨基糖苷類、四環素類、氯霉素類抗生素的典型代表,具有其衍生物共性。細菌耐藥性的產生使抗生素的使用劑量大大增加,而其不良反應跟抗生素的使用量成正相關, 隨劑量增加不良反應加大,從而降低了抗生素的使用效率及療效,也限制了抗生素的使用范圍。而聯合用藥不但可以減少抗生素的使用量,降低藥物的不良反應、提高療效,還可以治療細菌引起的混合感染、重癥感染,并且能延緩甚至避免細菌耐藥性的產生。故研究并開發一種不易誘發細菌產生耐藥性又能恢復耐藥菌株對抗生素敏感性,或又能對細菌有殺死或抑制作用的抗菌藥物迫在眉睫。
許多研究發現[11-14],中藥成分毒副作用少,且具有較強的抗菌作用,又不易誘導細菌耐藥耐藥,在我國資源豐富,與抗生素聯用能夠減少其使用劑量,提高抗生素療效的作用。又有研究[15-16]表明:標準SA對青霉素極為敏感,但又易誘導標準SA產生耐藥,故本實驗以青霉素誘導標準SA作為對照,觀察APS誘導標準SA是否易誘導產生耐藥,在誘導相同時間內,誘導菌出現32×MIC青霉素耐藥,而APS耐藥情況與原菌株一致,表明與青霉素誘導耐藥相比,APS不易誘導標準SA產生耐藥性。并通過研究APS分別聯合青霉素、四環素、慶大霉素、氯霉素4種抗生素對多重耐藥SA進行體外抗菌實驗,發現APS在單用MIC以下濃度與這4種抗生素聯用能恢復抗生素對多重耐藥SA的敏感性,從而降低抗生素的使用劑量。由此根據這4種抗生素與APS的聯用效果推及其衍生物聯用作用效果,由此及彼,為提高抗生素的使用效率提供有效依據,為研究出不易誘導細菌耐藥且對細菌具有較強抗菌活性或能恢復抗生素敏感性的中藥抗菌藥物提供實驗依據,為提高抗生素在臨床及畜牧業的使用效率奠定基礎。