活動性肺結核患者Tim-3/Galectin-9的表達變化及其與巨噬細胞相關細胞因子的相關性
代嬌 宋秋玲 段慧英 王露喬 畢靜
1曲靖醫學高等專科學校(云南曲靖655011);2昆明醫科大學第一附屬醫院(昆明650032)
肺結核(pulmonary tuberculosis,TB)由結核桿菌引起,是全球范圍內最致命的感染性疾病之一。據報道每年有927萬新發TB病例,且其中410萬病例涂片陽性[1]。長期的流行病學研究發現僅5%~10%的結核桿菌感染者進展為活動期狀態,這也表明人體免疫系統可以影響結核桿菌的復制,并在大部分人群中可以阻止疾病進展為活動狀態[2]。而活動期患者通常存在自身免疫系統功能不足的情況,巨噬細胞通過為結核桿菌提供胞內微環境而在TB病因學過程中扮演重要角色,當巨噬細胞被適當激活,即可直接殺滅結核桿菌[3]。T細胞免疫球蛋白黏蛋白3(T cell Ig and mucin domain 3,Tim-3)是一種重要的免疫負調控分子,其在自身免疫和腫瘤免疫中均扮演重要角色,在單核-巨噬細胞、T細胞和樹狀細胞表面均有表達[4-5]。半乳糖凝集素-9(galectin-9,Gal9)是Tim-3配體之一,兩者結合發揮免疫調控效應[6]。先前研究表明活動性TB患者巨噬細胞出現極化現象,即向著具有免疫抑制功能的M2型分化,而分泌促炎細胞因子介導機體免疫防御的M1型巨噬細胞則處于劣勢[7]。活動性TB中這種極化受到何種分子調控,目前尚未明確。既往研究證實Tim-3能通過抑制Stat1/miR-155作用軸,上調SOCS1進而促進IL-10、Arg-1的表達,增強巨噬細胞M2方向的極化[8]。本研究將通過檢測活動期TB外周血可溶性Tim-3(sTim-3)和可溶性Gal-9(sGal-9)水平,以及外周血單個核細胞(PBMC)中Tim-3/Gal-9的表達變化,及其與M1型巨噬細胞特征因子iNOS和M2型巨噬細胞特征因子Arg-1的相關性,以初步分析活動性TB中Tim-3/Gal-9的變化及其與巨噬細胞極化的相關性。
1 對象與方法
1.1 研究對象選取活動性肺結核患者組(ATB)33例,其中男19例,女14例,平均年齡(39.1±3.9)歲,其中痰涂片發現結核桿菌患者24例。所有入選病例診斷均符合中華醫學會結核病學分會制定的《肺結核診斷和治療指南》中的診斷標準[9],具有細菌學或病理學依據。肺結核患者排除合并HIV陽性及其他自身免疫性疾病的病例,且治療前均未曾使用過抗結核藥物或近3個月內未使用過免疫抑制或增強藥物,排除肺部真菌感染,合并腫瘤、矽肺及其他臟器嚴重疾病的患者。選取潛伏期肺結核患者(LTBI)31例,其中男17例,女14例,平均年齡(40.3±2.4)歲;該組患者結核菌素試驗清強陽性或近期由陰性轉為陽性,但沒有活動性肺結核疾病的細菌學、影像學和臨床癥狀的人群。另取健康體檢人群30例,其中男18例,女15例,平均年齡(39.5±2.8)歲;該組人群常規體檢無異常,既往無結核病史和臨床癥狀,胸部放射學檢查無異常,結核菌素試驗陰性,血清抗結核抗體陰性。ATB患者治療方案如下:異煙肼0.3 g/次,1次/d;利福平0.6 g/次,1次/d;吡嗪酰胺0.75 g/次,2次/d;乙胺丁醇1.0 g/次,1次/d。以上藥物均為口服,治療周期為6個月。
1.2 血液標本采集及處理抽取所有研究對象治療前清晨空腹靜脈血8 mL,其中3 mL置于EDTA抗凝管中用于PBMC提取;另5 mL置于干燥管中,4 000 r/min離心10 min分離血清,血清凍存至-80℃冰箱,備用于檢測血清sTim-3、sGal-9、Arg-1和iNOS的濃度。
1.3 試劑Human TIM-3 Quantikine ELISA Kit(美國R&D公司)、Human galectin-9 Quantikine ELISA Kit(美國 R&D公司)、Human Arginase 1 ELISA Kit?(英國abcam公司)和ELISA Kit for Nitric Oxide Synthase,Inducible(NOS)(美國CCC公司)分別用于檢測血清sTim-3、sGal-9、Arg-1和iNOS的水平。所有步驟嚴格按照試劑盒說明說操作。
1.4 方法EDTA抗凝全血與等體積PBS混勻,緩緩加入Ficoll淋巴細胞分離液(天津灝洋),密度梯度離心(2 000 r/min離心30 min),收集中間層細胞即為PBMC。E.Z.N.A.Total RNA Kit II(上海索寶生物)提取PBMC RNA;PrimeScript RT reagent Kit with gDNA Eraser(日本TAKARA公司)合成cDNA;SYBR@Premix Ex TaqTMII(日本TAKARA公司)用于Real time qPCR反應,所有實驗嚴格按照試劑盒說明書執行。Real time qPCR擴增標準程序:95℃預變性30 s,95℃變性5 s,循環數為40,60℃退火30 s。選取人β-actin為內參,利用2-△△Ct法計算Tim-3 mRNA和Gal-9 mRNA的相對含量。其中△△Ct=(Ct目的基因-Ctβ-actin)TB組-(Ct目的基因-Ctβ-actin)對照組。2-△△Ct指TB組與對照組目的基因表達變化的倍數。引物序列如下:人β-actin:5′-AGTTGCGTTACACCCTTTC-3′(上游引物)和5′-CCTT-CACCGTTCCAGTTT-3′(下游引物);人 Tim-3:5′-ACTCTACCTACATCTGGGACACT-3′(上游引物)和5′-GTAGGTCCCATGGTCATCCAG-3′(下游引物);人Gal-9:5′-GTCTCCAGGACGGACTTCA-3′(上游引物)和 5′-CACGTACCCTCCATCTTCA-3′(下游引物)。
1.5 統計學方法采用SPSS 19.0統計學軟件進行數據分析,正態分布或近似正態分布數據采用均數±標準差表示,兩組間差異采用獨立樣本t檢驗,3組間均數比較采用單因素方差分析,多重比較采用Fisher′s LSD檢驗;Tim-3和Gal-9與Arg-1和iNOS間相關性行Spearman相關分析,以P<0.05為差異有統計學意義。
2 結果
2.1 各組血清sTim-3、sGal-9、iNOS和Arg-1以及外周血PBMC上Tim-3和Gal-9 mRNA表達的差異分析3組受試者中血清sTim-3、sGal-9、iNOS、Arg-1以及外周血PBMC上Tim-3和Gal-9 mRNA水平差異均有統計學意義(P<0.05),兩兩分析比較發現ATB患者以上指標均高于LTBI和健康對照組。除了Tim-3 mRNA在LTBI組和健康對照組間差異無統計學意義(P<0.05),其余指標LTBI組中亦均與健康對照組間差異有統計學意義(P<0.05)。見表1。
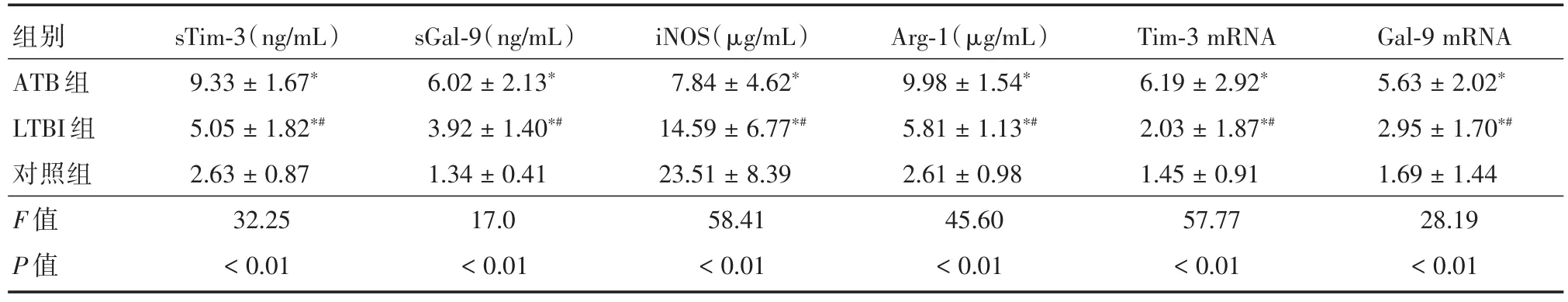
表1 3組受試者血清sTim-3、sGal-9、iNOS和Arg-1及外周血PBMC上Tim-3和Gal-9 mRNA的表達差異Tab.1 Comparison of the levels of sTim-3,sGal-9,iNOS,Arg-1,Tim-3 mRNA and Gal-9 mRNA among three groups of participants x±s
2.2 空洞型和非空洞型ATB患者血清sTim-3、sGal-9、iNOS和Arg-1以及外周血PBMC上Tim-3和Gal-9 mRNA表達的差異分析空洞型ATB患者血清iNOS、Arg-1以及外周血PBMC上Tim-3mRNA水平與非空洞型ATB患者間均具有顯著差異,而血清sTim-3、sGal-9、以及外周血PBMC上Gal-9 mRNA表達水平間差異無統計學意義(P<0.05)。見表2。
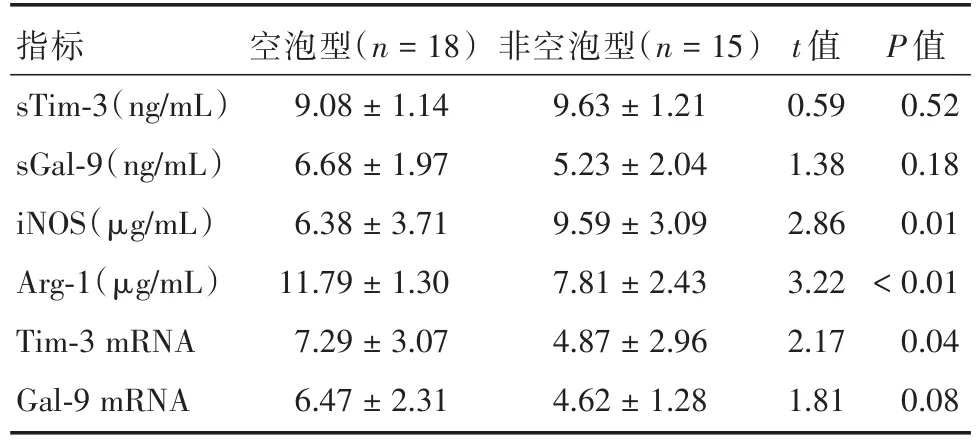
表2 空洞型和非空洞型ATB血清sTim-3、sGal-9、iNOS和Arg-1及外周血PBMC上Tim-3和Gal-9 mRNA的表達差異Tab.2 Comparison of the levels of sTim-3,sGal-9,iNOS,Arg-1,Tim-3 mRNA and Gal-9 mRNA between ATB patients with cavity and patients without cavity x±s
2.3 ATB患者sTim-3、sGal-9、Tim-3 mRNA和Gal-9 mRNA與iNOS和Arg-1水平間的相關性相關性分析發現ATB患者sTim-3、Tim-3 mRNA與iNOS均呈負相關(r=-0.333 7、-0.515 1,P<0.05),而與Arg-1均呈正相關(r=0.537 9、0.382 5,P<0.05);而sGal-9和Gal-9 mRNA與iNOS間均無相關性,sGal-9與Arg-1間亦無相關性,僅Gal-9 mRNA與Arg-1間呈正相關(r=0.485 9,P<0.05)。見圖1。
2.4 ATB患者治療前后血清sTim-3、sGal-9、iNOS和Arg-1以及外周血PBMC上Tim-3和Gal-9 mRNA表達的差異分析分析治療前后ATB患者以上指標的差異,結果顯示治療后血清sTim-3、sGal-9、iNOS和Arg-1以及外周血PBMC上Tim-3和Gal-9 mRNA表達水平較治療前均有顯著變化,除iNOS顯著上調外,其余指標均較治療前顯著下降,差異有統計學意義。見表3。
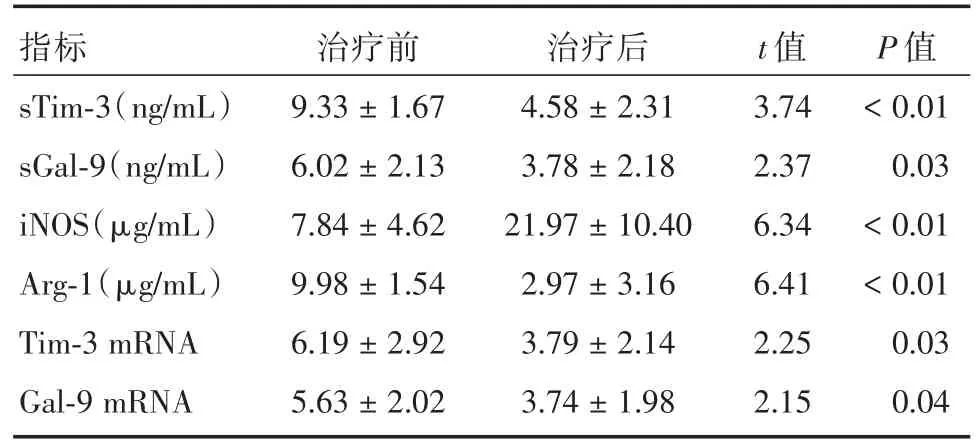
表3 ATB患者治療前后血清sTim-3、sGal-9、iNOS和Arg-1以及外周血PBMC上Tim-3和Gal-9 mRNA表達的差異分析Tab.3 Comparison of the levels of sTim-3,sGal-9,iNOS,Arg-1,Tim-3 mRNA and Gal-9 mRNA in ATB patients before and after treatment x±s
3 討論
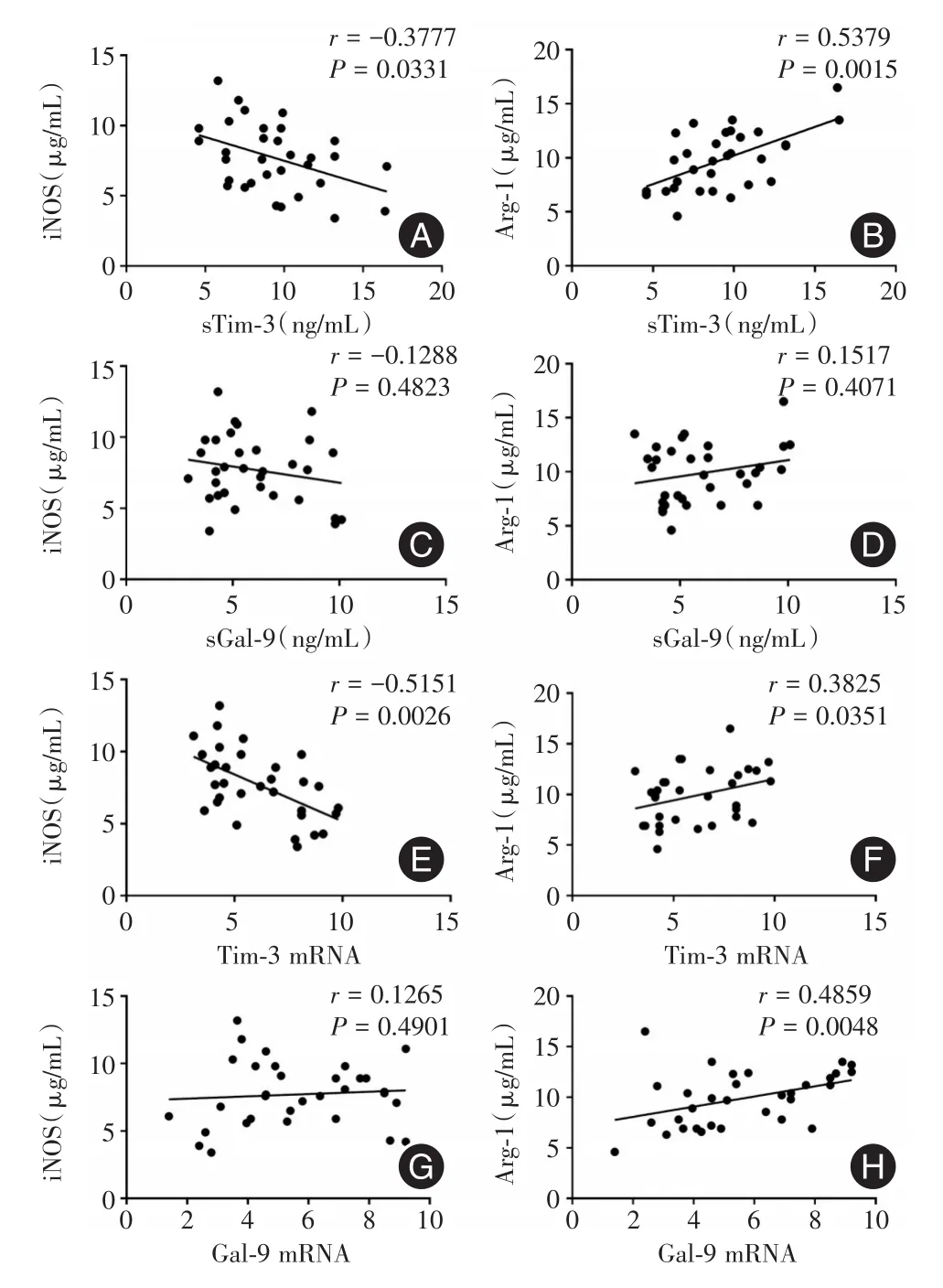
圖1 ATB患者sTim-3、sGal-9、Tim-3 mRNA 和 Gal-9 mRNA與iNOS和Arg-1水平間的相關性Fig.1 The correlations between sTim-3,sGal-9,Tim-3 mRNA or Gal-9 mRNA and iNOS or Arg-1
巨噬細胞是抵抗結核分支桿菌進入肺部的第一道防線,其與巨噬細胞間的相互作用是整個致病過程中的關鍵環節。探究巨噬細胞在TB患者中的變化及所受調控的因素對于弄清TB致病機制非常重要,既往研究報道巨噬細胞在不同病原微生物刺激后可向著不同方向分化,呈現出極化現象,且分泌表達生物學效應相反的細胞因子和酶類物質[10]。其中M1型巨噬細胞與MHC-II分子和共刺激受體CD86上調相關,分泌促炎細胞因子發揮促進細胞免疫作用[11-12];而M2型巨噬細胞與清道夫受體CD163和甘露糖受體CD206上調相關,分泌抗炎細胞因子發揮免疫負調控效應[13]。既往研究[14-15]證實在感染性疾病中M1/M2極化參與致病過程,包括結核桿菌引發的肺結核。在肺結核患者中單核細胞顯著增加,M1型巨噬細胞是參與殺滅分支桿菌和宿主抵抗胞內菌的重要細胞,而M2型巨噬細胞與組織修復和細菌殘留密切相關。
本研究也發現M1型巨噬細胞標志性物質iNOS顯著下降,而M2型巨噬細胞特征因子Arg-1則顯著上調,提示ATB患者確實存在M1/M2巨噬細胞極化現象,這與HUANG等[15]在結核病患者中發現的結果類似。巨噬細胞極化被認為是TB中維持炎癥反應平衡的關鍵因素,然而是何信號通路調控巨噬細胞極化,并不清楚。Tim-3/Gal-9是重要的免疫平衡調節因子,可調控T細胞、B細胞和巨噬細胞等的分化,WANG等[16]發現TB患者CD8+T細胞表面Tim-3顯著上調,Tim-3過表達會減少IFN-γ的分泌,而阻斷Tim-3則可顯著增加IFN-γ的分泌。JAYARAMAN等[17]在體外腹腔巨噬細胞感染結核桿菌的實驗中,加入Tim-3信號阻斷蛋白,能激活Caspase-1介導的IL-1β分泌,來抑制結核桿菌的生長。楊宜等[18]也報道阻斷Tim-3/Gal-9后小鼠肺部肉芽腫病變明顯減輕,荷菌量亦有所下降,且CD4+T細胞IFN-γ表達量顯著上調。這些結果提示Tim-3/Gal-9在TB致病過程中可能發揮重要作用。而近期報道發現除了在T細胞上表達并對T細胞的調控,Tim-3/Gal-9還在巨噬細胞表面表達并可發揮調控巨噬細胞極化的生物學效應。JIANG等[19]在DSS誘導的結腸炎小鼠模型中發現Tim-3可顯著抑制促炎性M1型巨噬細胞,Tim-3過表達會通過降低M1型巨噬細胞反應進而抑制腸道炎癥。但在ATB患者中Tim-3/Gal-9信號通路異常表達是否與同樣異常的M1/M2極化存在關聯,尚未見相關報道。本研究發現ATB患者Tim-3/Gal-9血清水平和PBMC mRNA水平均存在顯著上調現象,而在治療后卻又顯著下降,這也提示Tim-3/Gal-9可能參與了ATB的病因學過程。這與先前SHIRATORI等[20]在日本ATB人群和張佳等[21]在中國新疆地區的研究結果相一致,但本研究不僅僅檢測了Tim-3/Gal-9血清水平,還同時檢測了其PBMC上mRNA水平,更加全面的證實了Tim-3/Gal-9在ATB患者中存在異常高表達這一現象。此外,相關性分析發現Tim-3/Gal-9,尤其是Tim-3在血清水平和轉錄水平均與M1型巨噬細胞和M2型巨噬細胞特征因子均存在顯著相關性,也提示在ATB患者中其可能參與了巨噬細胞極化過程。未來研究中,將對ATB小鼠模型給予Tim-3/Gal-9阻斷和過表達干預,進一步闡明其對巨噬細胞極化的調控效應和相關免疫學機制。
綜上,本研究初步發現ATB患者外周血Tim-3/Gal-9信號通路存在異常表達,且與異常變化的M1型巨噬細胞和M2型巨噬細胞特征因子iNOS和Arg-1存在顯著相關性,可能參與了ATB發病過程。

