阻塞性睡眠呼吸暫停低通氣綜合征對患者腎功能的影響
趙丹 劉婭欽 袁國航 路蘋 萬自芬 葉賢偉
1貴州省人民醫院呼吸與危重癥醫學科,貴州省呼吸疾病研究所(貴陽550002);2貴州大學醫學院(貴陽550025)
阻塞性睡眠呼吸暫停低通氣綜合征(obstructive sleep apnea-hypopnea syndrome,OSAHS)是高血壓、冠心病、心力衰竭、腦血管事件等多種心腦血管疾病的高危因素[1]。近來研究發現,約60%的慢性腎功能衰竭患者合并睡眠呼吸暫停,其患病率遠高于普通人群中20%的比例,OSAHS在慢性腎病病因學中存在潛在作用[2],但其機制尚不十分清楚。本文擬探討OSAHS患者體內ROS、HIF-1α、NO與對肌酐、腎小球濾過率的影響,初步揭示OSAHS對腎功能損害的機制。
1 對象與方法
1.1 研究對象順序納入2017年3月至2018年3月在貴州省人民醫院門診及住院就診的睡眠監測患者230例,其中男127例,女103例,年齡18~80歲,平均(59.3±13.1)歲。根據多導睡眠監測(polysommography,PSG)睡眠呼吸暫停低通氣指數(apnea-hypopnea index,AHI)分為正常對照組及輕、中、重度OSAHS組,參考阻塞性睡眠呼吸暫停低通氣綜合征診治指南[3]。正常對照組(AHI<5次/h)62例、輕度OSAHS組(5次/h ≤ AHI<15次/h)45例、中度OSAHS組(15次/h≤ AHI<30次/h)53例、重度OSAHS組(AHI≥ 30次/h)70例。并排除其他疾病,如急慢性腎功能不全、藥物性腎損害、惡性腫瘤、結締組織病、結核病、嚴重心衰、代謝性疾病、近期手術、激素、營養支持。各組在性別、年齡等方面相匹配,經統計學處理,差異無顯著性(P>0.05),具有可比性。所有受試者均被告知研究目的、方法及注意事項,并簽已署知情同意書。
1.2 一般情況在正式進行PSG睡眠監測前,采集患者性別、年齡、吸煙史、既往史等參數,測量身高、體質量(空腹),計算體質量指數(BMI)。
1.3 PSG監測所有納入患者采取美國飛利浦Alice 5 PSG監測系統,監測內容包括:腦電圖、眼電圖、下頜肌電圖、心電圖、口鼻氣流、胸部呼吸運動、腹部呼吸運動、脈搏氧飽和度(SPO2)、最低血氧飽和度(minSaO2)、血氧飽和度低于90%的時間(TSaO2)、體位、鼾聲、脛前肌電圖等。監測時間自晚10點至次日早上6點共8 h。
1.4 血標本的留取所有對象在行PSG檢查后的次晨6時,空腹靜臥抽取外周靜脈血8 mL,6 mL注入非抗凝管中,室溫靜置30 min后,4℃3 000 r/min離心10 min,留取血清,采用酶聯免疫吸附(ELISA)檢測ROS、HIF-1α、NO水平,試劑盒均由美國A&D公司提供。2 mL靜脈血采用OLIMPUS AU600全自動生化分析儀檢測尿素氮(BUN)、肌酐(Cr)、尿酸(UA),計算腎小球濾過率(GFR)。
1.5 統計學方法采用SPSS 18.0統計軟件,數據用均數±標準差表示,各組數據經Levene方差齊性檢驗后認為總體方差齊,多組之間的比較采用單因素方差分析中的兩兩比較:最小顯著差數法(LSD)。相關性分析采用雙變量相關分析中spearman秩相關分析進行檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 正常對照組及輕、中、重度OSAHS組基本資料比較各組性別、年齡、吸煙史差異均無統計學意義(P>0.05)。重度OSAHS組BMI明顯高于正常對照組,中重度OSAHS組糖尿病史、高血壓病史患病率較正常對照組升高,差異具有統計學意義(P<0.05)。說明肥胖是OSAHS的易患因素。OSAHS是高血壓、糖尿病的獨立危險因素,患病率與OSAHS的嚴重程度有關。見表1。

表1 各組患者基本資料Tab.1 Patients′basic data in each group
2.2 各組患者血清BUN、Cr、UA、GFR比較與正常對照組比較,OSAHS組BUN、UA差異均無統計學意義(P>0.05)。與正常對照組比較,重度OSAHS組患者Cr升高,GFR水平下降,差異具有統計學意義(P<0.05)。說明OSAHS患者腎臟功能下降,與OSAHS的嚴重程度有關。見表2。
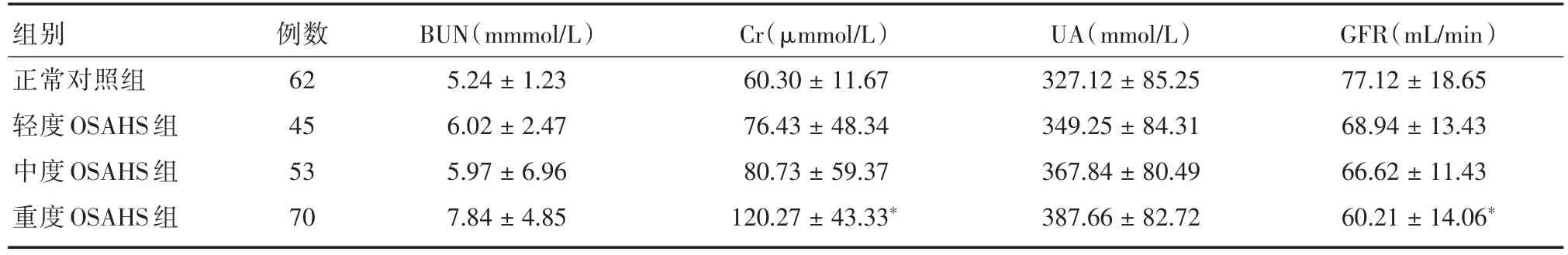
表2 各組患者血清BUN、Cr、UA、GFR水平比較Tab.2 Comparison of patients′BUN,Cr,UA and GFR levels in each group x±s
2.3 各組患者血清ROS、NO、HIF-1α水平比較中重度OSAHS組血清ROS、HIF-1α水平明顯高于正常對照組,中重度OSAHS組血清NO水平低于正常對照組,差異具有統計學意義(P<0.05)。說明OSAHS患者隨著缺氧程度增加,機體內存在較高水平的氧化應激反應,而具有舒張血管功能的NO水平卻降低,這可能是導致OSAHS患者腎臟功能下降的原因之一。見表3。
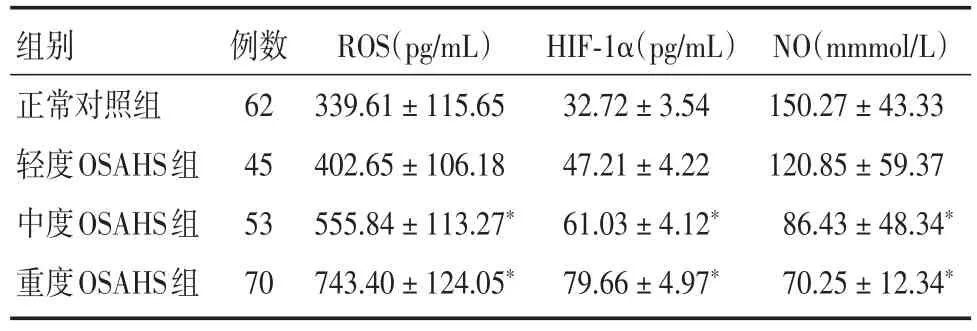
表3 各組患者血清中ROS、HIF-1α、NO水平對比Tab.3 Comparison of patients′ROS,HIF-1α and NO levels in each group x±s
2.4 采用Pearson檢驗血清ROS、HIF-1α、NO、Cr、GFR水平與SPO2、AHI、minSaO2、TSaO2相關性分析:ROS、HIF-1α與minSaO2呈負相關性(r=0.935,P<0.05)。說明OSAHS患者睡眠過程中的最低血氧飽和度越低,機體的缺氧程度及氧化應激反應水平越嚴重。
3 討論
OSAHS是指睡眠中反復發生上氣道部分或完全阻塞而表現為夜間間斷低氧和高碳酸血癥,伴有打鼾、反復覺醒、睡眠結構紊亂、白天嗜睡的綜合征。OSAHS可誘導分子水平上的慢性間歇性低氧(chronic intermittent hypoxia,CIH)、氧化應激、持續的系統性炎癥、氧傳感器激活、交感神經興奮性增加[4]。CIH誘導活性氧(reactive oxygen species,ROS)釋放,ROS水平的增加導致細胞粘附,激活白細胞和炎癥反應[5]。研究表明,CIH導致缺氧誘導因子1-α(hypoxia inducing factor-1α,HIF-1α)升高,誘導抗氧化酶下降,一氧化氮(NO)水平下降,內皮功能障礙,引起血管收縮[6]。腎臟的生理功能主要是排泄代謝產物及調節水、電解質酸堿平衡以維持機體內環境穩定以及重吸收、分泌功能。研究表明睡眠呼吸暫停綜合癥和慢性腎病有雙向關系,睡眠呼吸障礙的病理生理后果有可能對腎功能產生不利影響,并導致既定的CKD進展,而晚期腎病中液體動力學的改變已確定對睡眠呼吸有不利影響[7]。OSAHS是獨立增加腎功能喪失的危險因素[8]。睡眠呼吸暫停與慢性腎功能衰竭相互影響[9]。而隨著腎功能下降,睡眠呼吸暫停和夜間缺氧的患病率增加,激進的透析已經發現改善阻塞性睡眠呼吸暫停[10]。
本研究結果顯示重度OSAHS組患者Cr升高,GFR水平下降。重度OSAHS組BMI明顯高于正常對照組,糖尿病、高血壓在重度組中的患病率亦升高,目前研究表明,OSAHS與代謝生理學之間是雙向關系,OSAHS可導致肥胖、糖尿病等代謝性疾病,而這些代謝性疾病又可進一步加重OSAHS病情[11]。然而,在OSAHS患者腎功能損害的病因中,合并高血壓、糖尿病、BMI增大等因素本身也是導致GFR下降的主要因素之一[12]。另外,除考慮本身的合并癥因素外,OSAHS患者體內存在脂質過氧化反應和氧化應激,且隨著患者的病情加重機體內脂質過氧化反應和氧化應激加強亦可導致患者腎功能損害。本研究結果顯示,中重度OSAHS組血清ROS、HIF-1α水平明顯高于正常對照組,中重度OSAHS組血清NO水平低于正常對照組。考慮與患者夜間呼吸暫停和(或)低通氣,引起反復缺氧/再氧合,類似于心肌細胞的缺血再灌注損傷有關。間歇性低氧可導致體內ROS釋放增多,HIF-1α升高,NO水平下降,腎小動脈普遍收縮、腎血管內皮功能失調、腎血管重建,從而導致腎小球濾過功能下降[13]。另外,慢性間歇性低氧可激活煙酰胺腺嘌呤二核苷酸使得氧自由基和氮自由基生成增多[14],體內兒茶酚胺分泌增高及交感神經興奮引起血壓升高及腎臟血管持續收縮,腎素-血管緊張素-醛固酮系統激活,引起血管收縮,腎臟缺氧、細胞壞死及纖維化,進一步加重腎臟功能損害[15-16]。
可見,OSAHS是腎功能不全的病因之一,患者低氧血癥伴含氧量恢復的循環改變,即類似于缺血再灌注損傷,導致氧化應激增加,ROS、HIF-1α釋放增多,舒張血管的NO因子減少,以及伴發的神經內分泌系統改變,均是導致腎功能損害的潛在危險因素。

