TiN涂覆的 Ti-6Al-4V注入Cu2+ 后的抑菌性與細胞相容性研究
褚珊珊 萬榮欣 呂曉飛 顧漢卿* 彭 誠
1(天津醫科大學第二醫院,天津 300211)2(天津醫科大學天津市泌尿外科研究所,天津 300211)
引言
鈦及鈦合金因具有良好的生物相容性、優越的綜合力學性能、耐腐蝕性能、機械加工性能,是當今主要的口腔和骨科植入材料[1-2]。鈦及鈦合金具有良好的生物相容性,但不具有抑菌性[2]。雖然正規植入操作在無菌條件下進行,但仍出現大量因植體周圍細菌黏附,使周圍組織感染而導致植入失敗的情況。因此,賦予植體材料一定的抑菌性已經成為臨床亟待解決的科學問題。
鈦合金本身耐磨性較差,在人體內如果長期磨損,會產生大量金屬粒子,使身體現出不良反應[3]。而TiN涂層具有優良的耐摩擦性能、韌性以及高硬度等特點[4],可彌補鈦合金的不足。
近年來,常用的表面定植抑菌劑的方法有:MEVVA離子注入、溶膠-凝膠法、物理氣相沉積、電鍍/化學鍍等[5]。本研究在TiN修飾的鈦合金表面再注入Cu,以期提高鈦合金耐磨性、韌性、硬度,防止V離子過量釋放導致的不良反應,同時使其具有一定的抑菌性。離子注入是風險控制最好的一種的方法,在真空中、低溫下把注入離子加速,離子獲得很大動能后即可直接進入材料表面中。當然,這也會在材料表面產生一些晶格缺陷,因此在離子注入后需用低溫退火或激光退火來消除這些缺陷。注入的離子濃度分布一般呈現為高斯分布,并且濃度最大處不是在表面,而是在表面以內的一定深度處;優點是能精確控制雜質的總劑量、深度分布和面均勻性,而且是低溫工藝(可防止原來雜質的再擴散等),同時可實現自對準技術(以減小電容效應)。其中,MEVVA離子是通過金屬蒸汽真空弧離子源進行注入。采用這種方法,使注入粒子與基底結合緊密,注入物不易脫落[6];使離子釋放緩慢而持久,賦予了材料長久而穩定的抑菌性能。
Ag+具有良好抑菌性[7]與生物相容性[8],因此被廣泛應用于醫療材料領域。本課題組之前的研究表明:在TiN涂覆的Ti-6Al-4V表面離子注入Ag+后,可賦予其良好的機械性能、細胞黏附力與抑菌性能。但Ag+并非人體必需元素,且其生物安全性越來越受到人們關注,因此需要探索其他的具有良好細胞相容性及抑菌性的元素,比如Cu。研究表明,Cu2+符合上述要求[9-11],是一種較好的可用于提高材料表面抑菌性能的表面改性材料。基于上述考慮,在TiN涂覆的Ti-6Al-4V表面上注入一定量的銅,與銀相比較,考察Cu2+注入表面的初步細胞相容性和抗菌性。
1 方法
1.1 實驗材料
Ti-6Al-4V片,直徑10 mm,厚度2 mm。
試劑和儀器: HyClone 1640培養基、胎牛血清(BI,以色列),青鏈霉素混合液、LB細菌培養基(天津索羅門生物科技有限公司),0.25%胰蛋白酶、曲拉通X-100、40 g/L多聚甲醛(Sigma,美國),羅丹明-羅丹明-鬼筆環肽(上海翊圣生物科技有限公司),Heochest33342染色液(碧云天),抗熒光衰減封固劑(博士德生物工程有限公司),Live-or-DieTM Viability Cytotoxicity Kit for Bacteria Cells(Gene Copoeia,美國),CCK-8試劑盒(日本,同仁),無水乙醇,PBS(BI,以色列),國產MEVVA-360型離子注入機,激光共聚焦顯微鏡(Olympus F10-SHAUIX,日本)、SUPRA 55VP掃描電鏡(ZEISS,德國),ZXJP-A1150 CO2細胞培養箱(上海智城分析儀器制造有限公司),X射線電子能譜分析儀-725(瓦里安,美國),SCIENTZ-10 N凍干機(寧波新芝生物科技股份有限公司),-80℃冰箱(Thermo,美國),低速臺式離心機(湘儀 L-530),多功能酶標儀(天津志卓生物科技有限公司)。
細胞與細菌:L929細胞系(中國科學院細胞庫,上海),金黃色葡萄球菌(天津師范大學生命科學學院中心實驗室)。
1.2 實驗過程
1.2.1樣本的制備
制備TiN涂覆的Ti-6Al-4V表面注Cu樣品和TiN涂覆的Ti-6Al-4V表面注Ag樣品。伴隨著離子的沉積,各部分參數設置如下:工作氣壓0.5~0.8 Pa,固定直流偏壓為50 V,脈沖偏壓為-150 V,占空比為30%,其中Ar2與N2的氣壓分壓比為1∶5,沉積時間為35 min。
首先將光滑的Ti-6Al-4V基底材料分別浸泡在乙醇和丙酮溶液中交替清洗,每種溶液15 min,吹風機吹干后置于空曠處,放入鍍膜機的腔室內,其靶基距約為30 cm。處于工作狀態后,當真空室的本底真空度達到5×10-3Pa時,通入氬氣至5 Pa,調節直流偏壓為200 V,脈沖偏壓為-600 V,占空比為60%,對樣品進行輝光清洗15 min。之后調節氣壓至0.5 Pa,鍍TiN時,通入氬氣與氮氣的體積比為1∶5,根據設置的偏壓進行鍍膜。然后,采用MEVVA金屬蒸氣真空弧離子源注入機進行離子注入,注入劑量為5.0×1017ions/cm2的離子,注入加速電壓為40 kV,束流密度為2 μA/cm。
1.2.2樣本的影響
1)L929細胞的培養。將L929細胞培養于HyClone 1640培養基中(含1%抗生素、體積分數10%的滅活胎牛血清),放置于37℃、體積分數5% CO2飽和濕度的恒溫培養基中,兩天后進行1次換液,當細胞達到90%以上時融合后進行傳代。
2)細胞接種。取鈦合金組、TiN組、注Ag組、注Cu組各4片,分裝在24孔板中。L929細胞培養3代后,當細胞生長到對數期時進行細胞計數,以每孔2×104/well接種到各組片上,置于37℃、體積分數5%的CO2飽和濕度培養箱中孵育24 h。
3)羅丹明-鬼筆環肽染色。細胞接種24 h后,徹底吸掉培養基,用37℃預熱的1×PBS(pH值7.4)清洗3次,每次5 min。40 g/L多聚甲醛溶液固定細胞15 min,用PBS清洗細胞3次,每次10 min。用0.5%的TritonX-100溶液通透化處理5 min。取配置好的羅丹明-鬼筆環肽工作液,用移液槍滴加到各組鈦合金組片上表面,每孔200 μL,然后每孔滴加800 μL BSA封閉液進行封閉,室溫避光孵育30 min。PBS清洗3次,每次5 min。室溫下用配置好的Heochest33342細胞核染色,每孔加入500 μL,室溫下避光孵育30 min,PBS浸洗5 min。用抗熒光衰減封固劑進行封固,在激光共聚焦顯微鏡下觀察各組片表面細胞的骨架及黏附鋪展狀態[11]。
4)注Cu組、注Ag組對L929細胞生長形態的影響。細胞接種、固定、脫水、凍干:取鈦合金組、TiN組、注Ag組、注Cu組各4片,分裝在24孔板中。細胞培養,接種如上。PBS浸洗3次,每次10 min。將PBS清洗后的樣品轉移至新的24孔板中。在4℃用2.5%戊二醛浸泡各組片4 h,PBS清洗3次,每次10 min。用梯度酒精(30,50,70,80,90,100V/V%)脫水,每種濃度脫水10 min,最后再用100%的乙醇脫水兩遍;在-80℃條件下冷凍3 h,然后放入冷凍干燥機(SCIENTZ-10 N)抽真空20 h[12]。樣品表面噴金,掃描電鏡通過觀察偽足伸展,判斷樣品表面細胞的鋪展狀況。
5)注Cu組、注Ag組對L929細胞增殖影響。細胞接種:將處于對數生長期的L929細胞用0.25%胰蛋白酶消化下來,用HyClone1640培養基(含體積分數10%血清,1%雙抗)配置成細胞懸液,以每孔5×103/well分別接種到鈦合金組、TiN組、注銀組、注銅組的樣片表面,每組設置4個平行樣,然后將培養板放到孵育箱中孵育。
細胞增殖檢測:1、3、5 d后,吸除液體。每孔內滴加500 μL含有10%CCK-8的配置好的工作液,置于細胞培養箱內培養2 h。每孔用移液槍抽取100 μL加入96孔板中,用多功能酶標儀在450 nm波長下檢測OD值[13]。記錄各孔的吸光度值,計算后畫制細胞增殖狀況圖。
1.2.3抑菌性檢測
1)實驗菌株的培養。將冷凍復蘇的金黃色葡萄菌株接種于LB瓊脂板上,在37℃需氧狀態下培養24 h,涂片染色,形態學觀察為純培養物后,若無其他雜質則作為備用。
2)菌液和LB瓊脂板的準備。用接種環將培養平皿上的金葡菌轉移到10 mL的LB液體培養基中,用加樣槍充分吹打混勻后,取2 mL細菌懸液進行比濁,根據結果將剩余金黃色葡菌濃度調整至3×107CFU/mL。液體LB培養基加入適量瓊脂,放入滅菌蒸鍋中滅菌,待冷卻到65℃左右時倒入平皿中,封口備用。
3)細菌接種。取鈦合金組、TiN組、注Ag組、注Cu組片各4片,置于24孔板中。每片樣品表面用移液槍滴加100 μL配置好濃度菌液,在24孔板孔周圍間隙滴入PBS,封口膜封口后置于細菌培養箱中培養24 h。
4)活菌鋪板計數檢測。用PBS清洗樣品片3次,每次10 min。將樣品轉移至15 mL的無菌離心管中,每個離心管中裝入10 mL的PBS。放在SB25-12DT超聲波清洗機中震蕩15 min,再每管吸取100 μL液體滴于LB瓊脂培養板上,用一次性涂布棒涂布均勻后置于細菌培養箱中,培養24 h后觀察計數,并根據公式計算相對抑菌率,有
相對抑菌率(Ra)=

5)激光共聚焦檢測抑菌性。用PBS清洗樣品片3次,每次10 min。每孔中加入500 μL配置好的細菌活死染液,室溫避光孵育15 min。每片樣品上滴加20 μL抗熒光衰減封片劑,用原型蓋玻片蓋在樣品片上。在激光共聚焦顯微鏡下,觀察細菌活死狀態[13]。
6)掃描電鏡檢測抑菌性。用PBS清洗樣品片3次,每次10 min。4%的多聚甲醛固定15 min后,再酒精梯度脫水;在-80℃條件下冷凍3 h,然后放入冷凍干燥機(SCIENTZ-10 N)抽真空20 h。樣品表面噴金,SEM觀察樣品表面細菌形態及生長黏附。
陳主任不慌不忙地從煙盒里抽出一支煙,再慢條斯理地點上。打火機竄出的火苗在他諱莫如深的鏡片里綻放出兩個小小的亮點。
1.3 觀察指標
1)接種24 h后,4組片表面L929細胞的形態,以及黏附鋪展和生長情況;
2)接種1、3、5 d后,4組片表面L929細胞的增殖情況;
3)抑菌實驗中,與細菌接觸24 h后,4組片表面的細菌形態,以及生長和黏附情況。
1.4 統計學分析
所有數據均以平均值±標準差來表示,采用Graphpad Prism 7軟件處理,多組間比較采用單因素方差分析,P<0.05為差異有顯著性意義。
2 結果
2.1 XPS圖譜
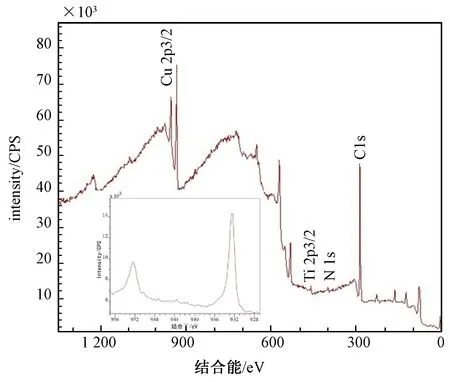
圖1 注Cu組的XPS圖譜Fig.1 XPS wide spectra of the surface of the Cu group

圖2 注Ag組的XPS圖譜Fig.2 XPS wide spectra of the surface of the Ag group
根據XPS圖譜,可以分析材料的成分結構、分布等。如圖1、2所示,材料經過TiN磁控濺射改性后表面觀測的峰位,主要有 N1s、Ti2p3/2。N1s的峰位在399.60 eV,表明改性層中形成了TiN硬質相。由圖1可見,材料在TiN涂層基礎上經過Cu2+注入改性后,表面觀測峰位有Cu2p3/2。由圖2可見,材料在TiN涂層基礎上經過Ag+注入改性后,表面觀測峰位有Ag3d5/2。這些峰位的出現,表明在鈦合金表面的TiN表面成功地注入了Cu和Ag,且注入效果較好。Cu2p3/2的相對原子比是7.35%,Ag3d5/2的相對原子比是7.6%。
2.2 離子析出濃度
將各組樣品浸入PBS中,分別在7、14、21和28 d時,通過ICP-MS技術,分別檢測注Cu組和注Ag組的Cu2+和Ag+釋放的濃度。由表1可見,Cu第28d的離子析出濃度是(0.014±0.000 5) mg/L,析出濃度低。
2.3 接觸角比較
由圖3可見,鈦合金組的接觸角是89.74°±0.03°,TiN組的接觸角是87.24°±0.03°,注Cu組的接觸角是75.54°±0.02°,注Ag組的接觸角是86.01°±0.02°。可見,注Cu組和注Ag組相對于對照組的接觸角減小,親水性增加。這說明,注Cu和注Ag后,材料表面的親水性增大,利于材料表面的細胞黏附。

表1 注Cu組和注Ag組的離子析出濃度Tab.1 The concentration of ion released from the Cu group and the Ag group mg/L

圖3 接觸角。(a)注Cu;(b)注Ag組;(c)TiN組;(d)鈦合金組Fig.3 The contact angle.(a)the Cu group;(b)the Ag group;(c)the TiN group;(d)the titanium alloy group
2.4 顯微鏡觀察
由圖4可見:鈦合金組、TiN組細胞分布均勻而密集,細胞呈多角形,可觀察到大量絲狀偽足,相互交織,呈網狀,細胞核形態正常,核染均勻;注Cu組和注Ag組細胞相對前兩組的數量稍有下降,絕大部分細胞鋪展充分,只有極少數細胞呈梭形,說明Cu2+和Ag+的注入未對TiN涂覆的鈦合金表面的細胞相容性產生明顯的影響。
2.5 掃描電鏡觀察
如圖5所示,羅丹明-鬼筆環肽染色后L929細胞黏附鋪展:鈦合金組、TiN組細胞鋪展充分,與材料表面黏附緊密,可見大量板狀偽足與絲狀偽足,使細胞間相互交織,F-肌動蛋白大量表達;注Ag組和注Cu組除極個別細胞呈梭形外,其他細胞均呈現多角型,絲狀偽足相互交織,黏附鋪展得較為充分均勻。這與激光共聚焦顯微鏡下觀察到的結果一致。
2.6 細胞增殖檢測
從圖6可以看出,4組材料在同一時間點的細胞活力,除了TiN組的略高外,其余各組材料表面的L929細胞生長活力按照如下趨勢排列:TiN組>鈦合金組>注Cu組>注Ag組,P>0.05,無統計學差異。研究表明,鈦合金組、TiN組的材料均不具有細胞毒性,所以注Cu組和注Ag組也無明顯的細胞毒性。

圖4 激光掃描共聚焦顯微鏡觀察各組樣品表面的L929細胞骨架(羅丹明-羅丹明-鬼筆環肽染色)。(a)鈦合金組;(b)TiN組;(c)注Cu組;(d)注Ag組Fig.4 Confocal laser scanning microscope images of L929 cytoskeleton on different sample surfaces (rhodamine-phalloidine staining).(a)the titanium alloy;(b)the TiN group;(c)the Cu group;(d)the Ag group

圖5 掃描電鏡觀察各組鈦片表面MC3T3-E1細胞形態。(a)注Cu組;(b)注Ag組;(c)TiN組;(d)鈦合金組Fig.5 Scanning electron microscope images of cellular morphology of L929 cells on different sample surfaces.(a)the Cu group;(b)the Ag group(c)the TiN group;(d)the titanium alloy group

圖6 L929細胞增殖情況Fig.6 The proliferation of L929 cells
2.7 活菌鋪板計數
根據活菌鋪板觀察結果(見圖7)以及據此做出的抑菌率柱狀圖(見圖8)可看到,注Cu組和注Ag組活菌菌落少而分散,TiN組和鈦合金組活菌菌落數較為密集,可知注Cu組和注Ag組具有較強抑菌性。注Cu組抑菌率是91%±2%,注Ag組抑菌率是87%±2%,P=0.006 9<0.05, 無統計學差異。
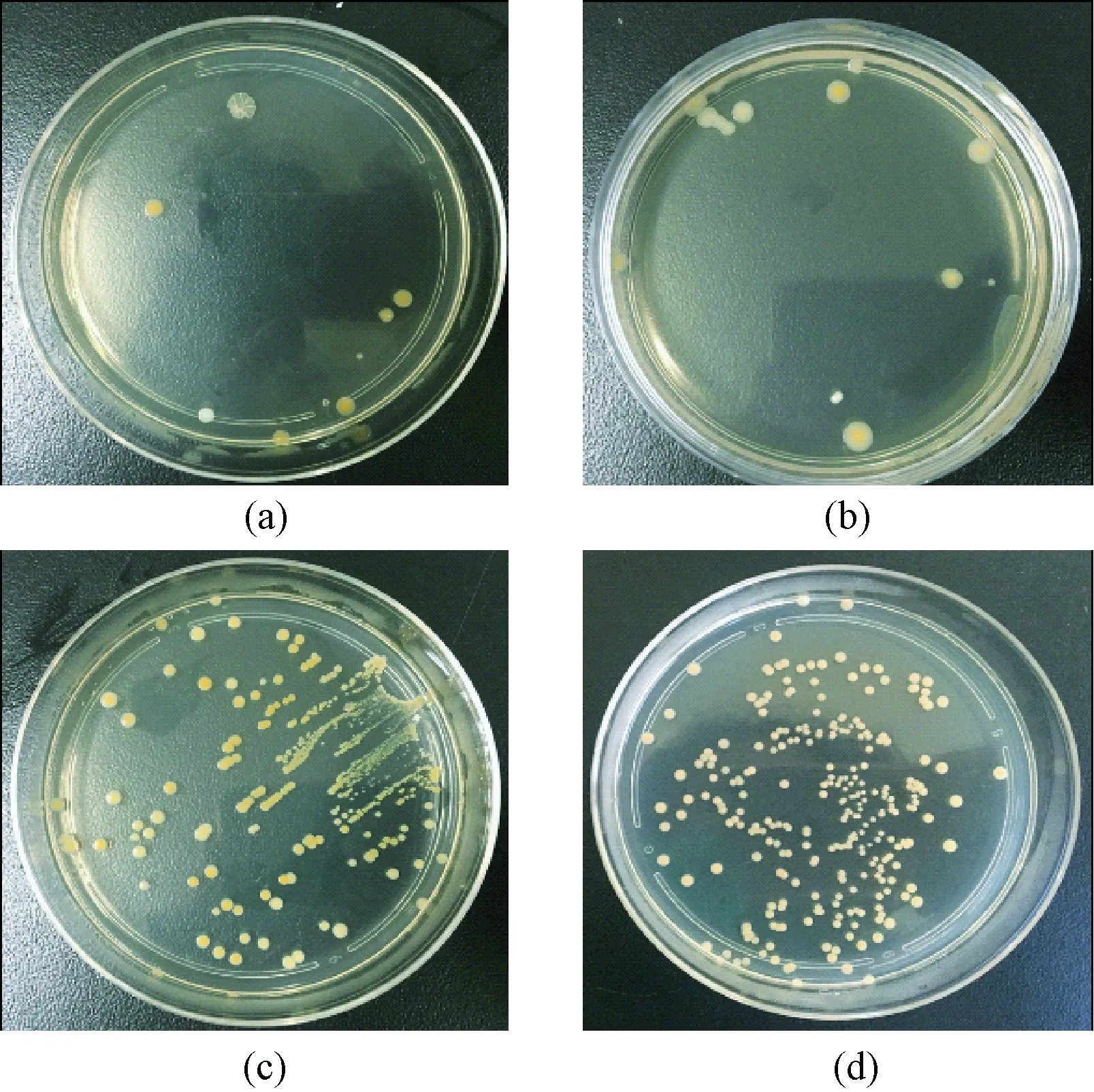
圖7 金黃色葡萄球菌鋪板結果。(a)注Cu組;(b)注Ag組;(c)TiN組;(d)鈦合金組Fig.7 Staphylococus aureus colonies.(a)the Cu group;(b)the Ag group;(c)the TiN group;(d)the titanium alloy group

圖8 抑菌率Fig.8 The antibacterial rates

圖9 活死染色觀察金黃色葡萄球菌在各組樣品表面的狀態。(a)注Cu;(b)注Ag組;(c)TiN組;(d)鈦合金組Fig.9 Live/dead staining of Staphylococus aureus on different sample surfaces.(a)the Cu group;(b)the Ag group;(c)the TiN group;(d)the titanium alloy group
2.8 表面活菌情況
由圖9可以看出:鈦合金組和TiN組幾乎全部被活菌覆蓋,說明細菌生長活力好;注Ag組和注Cu組綠染部分少,證明細菌大量死亡,說明這兩組具有良好的抑菌性。
2.9 葡萄球菌形態
由圖10可見:鈦合金組和TiN組金黃色葡萄球菌形態飽滿,和正常情況下細菌形態一致,分布均勻,其中鈦合金組密集層疊,TiN組細菌稍少;注Ag組和注Cu組細菌在材料表面大面積死亡,黏附少,細菌壁完整性被破壞,內容物流出,外形皺縮,說明這兩組對其表面的金黃色葡萄球菌具有較為顯著的破壞和抑制生長作用。

圖10 掃描電鏡觀察各組樣品表面金黃色葡萄球菌形態。(a)鈦合金組;(b)TiN組;(c)注Cu組;(d)注Ag組Fig.10 Scanning electron microscope images of cellular morphology of Staphylococus aureus cells on different sample surfaces.(a)the titanium alloy;(b)the TiN group;(c)the Cu group;(d)the Ag group
3 討論
醫用鈦合金具有優越的生物相容性,因其與骨相近的彈性模量以及較強的耐腐蝕性能,成為近年來被廣泛使用的口腔與骨科植入物的材料。但是,植入物與人體接觸后,其表面因為不具有一定的抑菌性,容易黏附細菌進而形成生物膜,一旦形成則抗生素等治療手段不易穿透,無法有效殺滅細菌,從而導致種植體周圍炎癥的發生[14]。植入物感染會導致植入失敗,嚴重的會導致全身感染甚至危及生命,局部感染需要徹底處理感染后再重新植入。
口腔與骨科的植入在嚴格的無菌環境下操作,但依然無法避免細菌定植與感染發生,因此只能通過植入物表面改性賦予其抑菌性能。研究表明,Ag+是一種廣譜有效的抑菌物,但其生物安全性近來受到一些質疑,Cu能否因其良好的抑菌性與細胞相容性逐漸取代Ag,仍需進一步研究。同時,Cu是人體必需的微量元素,參與細胞代謝和催化作用等生理功能。WHO建議,成人每日Cu的上限攝入量為2~3 mg[15],生活用水標準中Cu的上限為1 mg/L,遠大于Ag的0.05 mg/L。
文獻[16]和本實驗接觸角的檢測結果表明,與對照組相比,注Ag組和注Cu組小,親水性好,早期促進細胞黏附。結合細胞增殖和毒性實驗可得出結論:實驗組Cu2+析出對人體無毒性,能促進細胞早期黏附,并且具有良好的抑菌性。綜上所述,Cu2+可被用作材料表面改性來提高抑菌性。
Cu的抑菌機制目前尚未明確,主要的殺菌理論是接觸抑菌[17]以及離子析出抑菌。根據ICP-MS的結果可看出,本實驗中Cu第28 d的離子析出量是(0.014±0.000 5)mg/L,遠小于文獻中[18]提到的Cu2+離子析出量400 mg/L。所以注Cu組的主要抑菌機制是接觸抑菌。另外,該數值也遠低于生活用水標準中Cu的上限值1 mg/L。接觸抑菌的原理是:從金屬Cu表面溶出,造成細菌損傷;細菌的細胞膜破裂,因為Cu和其他壓力的影響,導致膜電位的損失和細胞胞質外泄;Cu2+誘導活性氧生成,進一步導致細菌結構遭到損傷;細菌全基因組 DNA 和質粒發生降解[17]。
因植體需長期與人體組織接觸,所以需要具備穩定而持久的抑菌性。傳統的鍍膜技術與基底合力較差,而采用MEVVA離子注入技術注入的粒子與基底的結合力大,即金屬顆粒與TiN層結合緊密,不易脫落,可持久釋放離子,發揮抑菌作用。
4 結論
在TiN涂覆的鈦合金表面注入一定劑量的Cu2+后,會具有良好的細胞相容性和抑菌性,因此Cu有可能作為具備抑菌性的口腔與骨科植入物表面改性的Ag+的替代物被進一步研究。
(致謝:感謝天津師范大學李麗和龔煥煥同學給予的大力幫助和技術支持)

