SRPX2對肝癌細胞侵襲與遷移能力的影響及作用機制
王云檢 尤國華 張珉 張璐陽
肝癌術后復發轉移率超過60%,成為肝癌患者死亡的主要原因[1]。侵襲與遷移是肝癌的基本特征,細胞侵襲與遷移取決于細胞黏附以及細胞外蛋白水解變性[2]。肝癌細胞可以在趨化因子刺激下發生運動,但其黏附性程度下降,容易從原發灶脫離并降解細胞外基質,形成向外轉移的通道,促進腫瘤細胞的侵襲、遷移[3]。sushi重復蛋白X連鎖2(sushi repeat containing protein x linked 2,SRPX2)是一種硫酸軟骨素蛋白聚糖,與腫瘤的侵襲與遷移密切相關[4]。研究發現,當SRPX2的表達受到抑制,可以減緩肝癌細胞的侵襲與遷移[5]。因此,通過研究SRPX2對人肝癌細胞MHCC97H侵襲與遷移能力的影響及作用機制,為SRPX2成為肝癌治療靶點提供一定依據。
資料和方法
一、主要試劑與儀器
人肝癌細胞MHCC97H(中國科學院典型培養物保藏中心昆明細胞庫,中國)、SRPX2特異性siRNA和陰性對照(negative control,NC)(上海吉瑪生物科技有限公司,中國)。DMEM 培養基、胰酶(Gibco公司,美國)、胎牛血清(武漢普諾賽生命科技有限公司,中國)。Trizol Reagent RNA提取試劑盒(Invitrogen公司,美國)、PrimeScript RT reagent Kit Perfect Real Time RNA反轉錄試劑盒(大連Takara公司,中國)、UltraSYBR One Step RNA PCR Kit熒光定量PCR試劑盒(寶生物工程大連有限公司,中國)。PCR引物序列(大連Takara公司,中國)為SRPX2引物序列:上游引物為5′-ACTGGATTTGCGGCATGTGA-3′,下游引物為:5′-CCATGTTGAAGTAGGAGCG-AGTGA-3′;MMP-2引物序列:上游引物為5′-AGACATACATCTTTGCTGGAGACA-3′,下游引物為:5′-CTTGAAGAAGTAGCTGTGACCG-3′;GAPDH引物序列:上游引物為5′-TCCCATCACC-ATCTTCCAG-3′,下游引物為:5′- GGTATCC-ATCGCCATGCTC -3′。細胞蛋白抽提試劑(碧云天生物技術研究所,中國)、鼠抗SRPX2、MMP-2(Santa Cruz公司,美國)、辣根過氧化物酶HRP標記親和純化山羊抗小鼠IgG二抗、鼠抗GADPH單克隆抗體(武漢艾美捷科技有限公司,中國)。凝膠成像儀(美國 UVP 公司)、ECL 顯影液(美國 Millipore 公司) 。CO2細胞培養箱 (Thermo Revco,美國)、24孔Transwell小室(CORNING科技有限公司,美國)。NanoDrop2000c 型蛋白核酸檢測儀(Thermo公司,美國)、實時熒光定量PCR儀(BIO-RAD公司,美國)、倒置顯微鏡(Nikon公司,日本)、基質膠、BIO-RAD 垂直電泳儀(BD公司,美國)、凝膠成像儀( UVP 公司,美國) 。
二、細胞培養及轉染
用含10%胎牛血清的DMEM培養液培養人肝癌細胞MHCC97H,條件為37℃、5% CO2,隔天換液,當人肝癌細胞HepG2處于對數生長期時進行實驗。實驗分為空白對照組、陰性對照組和干擾SRPX2組。空白對照組在鋪板后48 h收獲細胞,陰性對照組和干擾SRPX2組分別用Lipofectamine法將NC和SRPX2特異性siRNA轉染到人肝細胞癌MHCC97H,繼續培養48 h收獲細胞,進行相關檢測。
三、細胞體外侵襲和遷移能力實驗
按照細胞分組分別處理24 h后對細胞進行消化,用基質膠檢測侵襲能力和不鋪基質膠檢測遷移能力。將消化獲得細胞調整濃度為5×105后接種在24孔Transwell小室中,每孔200 μl,下室加入10%胎牛血清的DMEM培養液,繼續培養24 h,取出小室,用無菌棉簽擦拭去除上室內的細胞,用4%甲醛固定10 min,用0.1%結晶紫染液染色30 min,沖洗干凈后倒置顯微鏡下觀察細胞,拍照。計數紫色染色的穿膜細胞,即細胞侵襲和遷移能力。各劑量組設3個平行樣。
四、實時熒光RT-PCR檢測SRPX2和MMP-2 mRNA的表達
按照細胞分組分別處理48 h后對細胞進行消化,消化后取5 mL細胞液(細胞濃度為5×106/mL),5000 r/min、5 min離心,根據RNA提取試劑盒操作說明書進行總 RNA提取,測定mRNA濃度和純度,將提取的總RNA根據反轉錄試劑盒說明合成cDNA,根據SYBR Premix Ex Taq TM Ⅱ熒光定量PCR試劑盒說明,用制備20 μl反應體系,在CFX-96 PCR擴增儀中進行擴增。反應條件為預變性95℃ 30 s、 變性 95℃ 5 s、60℃ 44 s、40個循環,61 ℃時采集熒光,用實時熒光定量 PCR儀檢測對其表達量進行結果分析,以GADPH作為內參,采用 2-△△Ct法計算 SRPX2和MMP-2 mRNA 的相對表達量。各劑量組設3個平行樣。
五、Western Blot法檢測SRPX2和MMP-2蛋白水平
按照細胞分組分別處理48 h后對細胞進行消化,消化后加2 ml無血清培養基終止消化,5 000 r/min、5 min離心,洗滌2次,加入1 μl PMSF,根據細胞量加入胞蛋白抽提液,冰浴2 h;4℃、10 000 r/min、15 min,取上清,進行蛋白定量;調整蛋白濃度,加入1/5體積的5×緩沖液,沸水進行變性,-80℃保存備用。采用 BIO-RAD 濕轉系統SDS-PAGE 膠進行電泳、切膠;孵育一抗、 4℃下孵育相應條帶過夜、孵育相對于二抗,于暗室內用ECL 法發光觀察蛋白表達,采集圖像,用凝膠成像儀對免疫印跡條帶灰度值進行分析,計算目的蛋白與內參蛋白條帶的灰度值比值。各劑量組設3個平行樣。
六、統計學分析
結 果
一、Transwell侵襲和遷移實驗檢測人肝癌細胞MHCC97H侵襲和遷移能力變化
由圖1~2可見陰性對照組MHCC97H侵襲和遷移能力與空白對照組比較差異無統計學意義(P>0.05),干擾SRPX2組人肝癌細胞MHCC97H侵襲和遷移能力較陰性對照組降低,差異有統計學意義(P<0.05)。
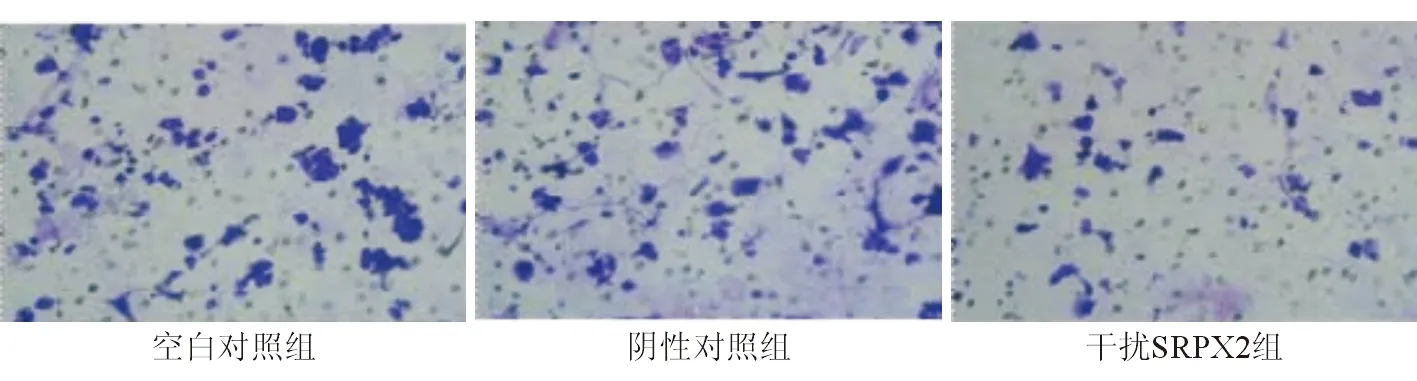
圖1 人肝癌細胞MHCC97H侵襲情況
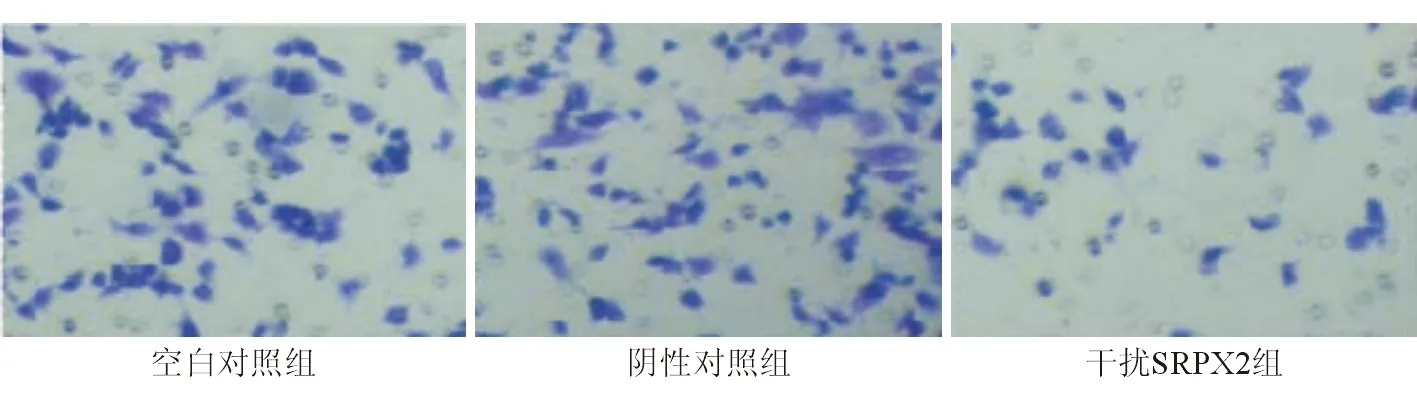
圖2 人肝癌細胞MHCC97H遷移情況
二、人肝癌細胞MHCC97H內SRPX2和MMP-2 mRNA表達的影響
由表1可見陰性對照組人肝癌細胞MHCC97H SRPX2和MMP-2 mRNA相對表達量較空白對照組比較降低不顯著,差異無統計學意義(P>0.05),干擾SRPX2組人肝癌細胞MHCC97H SRPX2和MMP-2 mRNA相對表達量較陰性對照組降低,差異有統計學意義(P<0.05)。

表1 人肝癌細胞MHCC97H內SRPX2和MMP-2 mRNA表達的影響(±s)
注:*表示與空白對照組相比差異有統計學意義,P<0.05;#與陰性對照組相比差異有統計學意義,P<0.05
三、人肝癌細胞MHCC97H內SRPX2和MMP-2蛋白表達的影響
由圖3可見陰性對照組人肝癌細胞MHCC97H SRPX2和MMP-2蛋白表達量較空白對照組降低不顯著,差異無統計學意義(P>0.05),干擾SRPX2組人肝癌細胞MHCC97H SRPX2和MMP-2 蛋白表達量較陰性對照組降低,差異有統計學意義(P<0.05)。

A:空白對照組、B:陰性對照組、C:干擾SRPX2組
討 論
SRPX2最先在癌細胞中被發現,隨著研究的深入,發現在正常組織中均有低表達[6]。在對結腸癌的研究中發現,SRPX2在癌癥組織中高表達,且與患者的不良預后密切相關,提示SRPX2 蛋白在癌癥組織中高表達[7]。SRPX2可以和組織蛋白酶B、半胱氨酸蛋白酶及金屬蛋白酶等結合,影響細胞外基質(extracellular matrix,ECM)蛋白的水解,而 ECM 結構的改變是影響細胞侵襲遷移的重要因素之一[7]。RNA 干擾(RNAinterference,RNAi)是基因轉錄后沉默的重要機制之一,通過破壞靶基因的mRNA使其基因不表達,siRNA是RNAi的效應分子。本研究發現,通過將SRPX2特異性siRNA干擾片段轉入人肝癌細胞MHCC97H后,SRPX2 mRNA和蛋白的表達量都降低,同時使MMP-2 mRNA和蛋白的表達量也降低。MMP2是MMP家族的重要一員,MMP家族成員幾乎都能降解ECM中的各種蛋白成分,MMP-2基因5′旁側序列促進子區域含有2個GC盒,活化的MMP-2定位于細胞穿透基質的突出部位,在酶解細胞間基質成分及基底膜的主要成分Ⅳ型膠原中有“鉆頭”的作用,是ECM代謝過程中最主要的蛋白水解酶類。在裸鼠肝癌模型的研究發現,MMP-2的表達量增加可以影響肝癌細胞的輕型遷移能力,增加了肝癌細胞向裸鼠肺部轉移的機會;同時,門靜脈受到侵犯是肝癌發生轉移的重要環節,MMP-2可以破壞狄氏間隙的網狀結構,為肝癌細胞的遷移創造了條件[8]。本研究發現,通過干擾SRPX2表達,進而使MMP-2的表達降低,人肝癌細胞MHCC97H侵襲和遷移能力降低。
綜上所述,SRPX2與肝癌細胞的侵襲遷移密切相關,SRPX2的表達降低,MMP2的表達也隨之降低,其侵襲遷移能力也明顯下降,SRPX2可能通過調節MMP2而影響人肝癌細胞MHCC97H侵襲和遷移,為肝癌靶向治療提供一定的理論依據。

