不同釀造因子對酵母菌β-葡萄糖苷酶活性的影響
陳彥雄,馬騰臻,李 蔚,潘陸霞,韓舜愈
(1.甘肅祁連葡萄酒業有限公司,甘肅高臺 734304;2.甘肅農業大學食品科學與工程學院,甘肅省葡萄與葡萄酒工程學重點實驗室,甘肅省葡萄與葡萄酒產業技術研發中心,甘肅蘭州 730070)
香氣是構成葡萄酒品質的主要因素之一,決定著產品的品種典型性和產地風格[1]。葡萄汁和葡萄酒中呈花香和果香味的萜烯類、C13降異戊二烯類和苯衍生物等品種香氣物質以游離態和糖苷鍵合態形式存在,且以鍵合態形式存在的風味前體物含量遠高于游離態形式[2-3]。這些糖苷鍵合態香氣物質可在釀造過程中通過酸水解或酶水解作用轉化成揮發性的、可被感知的游離態香氣物質,但酸水解在葡萄酒釀造條件下相當緩慢,作用有限;酶水解則因其作用條件較為溫和,且迅速受到廣泛關注。因此,糖苷酶在分解風味前體物及調控葡萄酒香氣品質方面具有重要作用[4-5]。
β-葡萄糖苷酶(β-glucosidase,EC3.2.1.21)能夠水解結合于非還原性末端的β-葡萄糖苷鍵,釋放出β-D-葡萄糖和相應的糖苷配基,是水解鍵合態糖苷前體物質的關鍵酶[5-6]。有學者研究表明,來源于黑曲霉的商品酶制劑可使處理酒樣中的單萜類物質含量顯著增加,花香和果香味也更加濃郁,風味品質顯著提高[7-8],但純化該酶制劑所需成本較高,很難大規模應用于葡萄酒生產中。近年來研究表明,部分釀酒酵母和非釀酒酵母也能產生β-葡萄糖苷酶[9],從而使葡萄原料的風味特征在酒體中得到充分表達[10],對葡萄酒的風味形成具有十分重要的意義。
酵母β-葡萄糖苷酶存在于細胞外、細胞膜表面和細胞內,但只有胞外酶和胞膜酶才能水解糖苷鍵合態香氣前體物,胞內酶的作用十分有限[11-12]。發酵結束后,酵母細胞在重力作用下沉降,作為酒泥除去,而胞外酶活性則可維持較長時期,是葡萄酒品種香氣調控的關鍵酶。然而在酒精發酵過程中,具有 β-葡萄糖苷酶活性的釀酒酵母在葡萄酒環境條件下的產酶能力及糖苷酶活性均較低[8],葡萄醪中碳源、氮源、pH值、多酚、SO2等釀造因子對酵母β-葡萄糖苷酶活性的影響是葡萄酒釀造過程中品種香氣調控亟需解決的關鍵問題之一。
試驗以一株β-葡萄糖苷酶活力較高的商品釀酒酵母為出發菌株,通過單因素試驗研究了不同釀造條件對該菌株酒精發酵過程中β-葡萄糖苷酶活性的影響,以期為葡萄酒釀造過程中酵母糖苷酶的增香應用提供理論依據和技術支持。
1 材料與方法
1.1 材料與試劑
商業釀酒酵母,Vintage Red(VR),意大利Enartis公司提供。
對硝基苯基β-D-吡喃葡萄糖苷(p-NPG,4-Nitrophenyl β-D-glucopyranoside,純度 >98%),美國Sigma公司提供;胰蛋白胨、蛋白胨、酵母浸粉,北京奧博星生物技術有限責任公司提供;檸檬酸、無水磷酸氫二鈉、無水碳酸鈉、肌醇、偏重亞硫酸鈉、對硝基苯酚(p-NP)、葡萄糖、纖維二糖、D-麥芽糖、蔗糖、D-果糖、麥芽浸膏粉、糊精、葡萄皮、硝酸鈉、硫酸銨、磷酸氫二銨(DAP)、尿素、酒石酸氫鉀、L-蘋果酸、檸檬酸、硫酸鎂、氯化鈣等,以上試劑均為國產分析純。
YPD液體培養基:葡萄糖20 g/L,蛋白胨20 g/L,酵母浸粉10 g/L,超純水,pH值5.0,在121℃下滅菌20 min。
1.2 儀器與設備
HH-S型電熱恒溫水浴鍋,金壇市恒豐儀器制造有限公司產品;H2050R型高速冷凍離心機,長沙湘儀離心機儀器有限公司產品;CP214型電子天平,奧豪斯儀器(上海)有限公司產品;紫外-可見分光光度計,Thermo Fisher scientific公司產品;SYQDSX-280B型手提式不銹鋼壓力蒸汽滅菌器,上海申安醫療器械廠產品;SPX-150-Ⅱ型生化培養箱,上海躍進醫療器械有限公司產品;SW-CJ-2FD型潔凈工作臺,蘇凈集團蘇州安泰空氣技術有限公司產品;18100摩爾型超純水機,重慶摩爾水處理設備有限公司產品;NRY-200型空氣恒溫搖床,上海南榮實驗室設備有限公司產品;單道移液器,德國Eppendorf公司產品;PHS-3C pH計,上海雷磁有限公司產品。
1.3 試驗方法
1.3.1 菌株的活化與培養
按推薦用量(0.2 g/L)稱取于4℃下保存的紅佳釀活性干酵母,于38℃下復水活化30 min后接種至含有200 mL模擬葡萄汁的250 mL三角瓶中,在28℃下靜置培養,每天搖瓶6次,發酵結束后(殘糖量小于4 g/L)取樣測定OD600值和上清液酶活,每個樣品重復3次。
1.3.2 模擬葡萄汁的配制
模擬葡萄汁[13]:葡萄糖、果糖各100 g/L,酒石酸氫鉀2.5 g/L,L-蘋果酸3.0 g/L,檸檬酸0.2 g/L,氨基態氮1.5 g/L(酵母浸粉,含3.75%氨基態氮,折算后加入量為 16 g/L),K2HPO41.14 g/L,MgSO4·7H2O 1.23 g/L,CaCl2·2H2O 0.44 g/L, MnCl2·4H2O 0.2 mg/L,ZnCl20.135 mg/L,肌醇100 mg/L,偏重亞硫酸鈉120 mg/L,煙酸 2 mg/L,吡哆醇2 mg/L,泛酸鈣1 mg/L,維B10.5 mg/L,葉酸 0.2 mg/L,核黃素0.2 mg/L,維H 0.125 mg/L;超純水,于121℃下滅菌20 min。
1.3.3 標準曲線繪制
準確稱取對硝基苯酚(p-NP)139.0 mg,溶解于蒸餾水并定容至1 000 mL,分別吸取0.1,0.2,0.3,0.4,0.5,0.6 mL于10 mL容量瓶中,用濃度為1 mol/L Na2CO3溶液定容后混勻,以蒸餾水為空白,于波長400 nm處測定吸光度并繪制標準曲線[13]。
對硝基苯酚標準曲線見圖1。
1.3.4 β-葡萄糖苷酶活性測定
取5 mL培養液于4℃條件下以轉速8 000 r/min離心10 min,收集上清液。取100 μL上清液,加入200 μL p-NPG(濃度為40 mmol/L溶于pH值5.5檸檬酸-磷酸氫二鈉緩沖溶液中,P-C緩沖液)混勻,于50℃下反應10 min,立即加入濃度為1 mol/L Na2CO3溶液2 mL終止反應并顯色,于波長400 nm處測定吸光度[13],以加熱失活的酶液按照同樣的處理作為空白。β-葡萄糖苷酶的酶活定義為pH值5.5,溫度50℃條件下,每分鐘1 mL酶液催化生成的對硝基苯酚的μmol數。
酶活力計算方式如下:

式中:U——酶活力單位,U/mL;
C——對硝基苯酚的濃度,μmol/mL;
V——反應體系的體積,mL;
N——稀釋倍數;
t——反應時間,min;
0.1 ——所取上清液或細胞液的體積,mL。
β-葡萄糖苷酶酶活力單位(U)定義為,在上述反應條件下,1 min時間內底物被釋放出1 μmol的p-NP所需要的酶量[14]。
1.3.5 酵母細胞OD600值測定
收集1.3.4中的酵母細胞,用無菌水清洗2次,將酵母細胞重新懸浮于5 mL的無菌水中,于波長600 nm處測定其吸光度。
1.3.6 釀造條件對酵母產β-葡萄糖苷酶的影響
(1)初始碳源濃度。分別配制初始碳源質量濃度為150,175,200,225,250 g/L的模擬葡萄汁,按1.2.1方法活化并接種酵母,于28℃下靜置培養10 d,取樣測定OD600值及上清液酶活,重復測定2次。
(2)復合碳源種類。分別向模擬葡萄汁中加入1%以下碳源:葡萄糖、蔗糖、麥芽糖、麥芽浸膏粉、纖維二糖、糊精、果糖、葡萄皮,按1.2.1方法活化并接種酵母,于28℃條件下靜置培養10 d,取樣測定OD600值及上清液酶活,重復測定2次。
(3)氮源種類。將模擬葡萄汁中的酵母浸粉換成以下氮源:硫酸銨、磷酸氫二銨(DAP)、硝酸鈉、尿素、酵母浸粉、蛋白胨、胰蛋白胨,其余成分不變,按1.2.1方法活化并接種酵母,于28℃下靜置培養10 d,取樣測定OD600值及上清液酶活,重復測定2次。
(4)有機氮與無機氮之比。以酵母浸粉和磷酸氫二銨為試材,根據有機氮與無機氮之比分別為1∶1,1∶2,2∶1,1∶3,3∶1配制模擬葡萄汁,按1.2.1方法活化并接種酵母,于28℃條件下靜置培養10 d,取樣測定OD600值及上清液酶活,重復測定2次。
(5)初始pH值。用檸檬酸-磷酸氫二鈉緩沖溶液配制初始pH值分別為3.5,4.0,4.5,5.0,5.5,6.0的模擬葡萄汁,按1.2.1方法活化并接種酵母,于28℃下靜置培養10 d,取樣測定OD600值及上清液酶活,重復測定2次。
(6)SO2添加量。分別配制 SO2質量濃度為10,30,60,90,120 mg/L的模擬葡萄汁,按1.2.1方法活化并接種酵母,于28℃下靜置培養10 d,取樣測定OD600值及上清液酶活,重復測定2次。
(7)多酚濃度。分別配制多酚(一水合沒食子酸)質量濃度為0,0.5,1.0,1.5,2.0 g/L的模擬葡萄汁,按1.2.1方法活化并接種酵母,于28℃條件下靜置培養10 d,取樣測定OD600值及上清液酶活,重復測定2次。
2 結果與分析
2.1 初始碳源質量濃度對酵母β-葡萄糖苷酶活性的影響
初始碳源質量濃度對酵母β-葡萄糖苷酶活性的影響見圖2。

圖2 初始碳源質量濃度對酵母β-葡萄糖苷酶活性的影響
碳源是維持微生物生命活動的主要能源,是產生各種代謝產物的重要元素。由圖2可知,模擬酒中生物量隨碳源質量濃度的升高而升高;但酶活呈先增大、后減小的變化趨勢,初始碳源質量濃度為175 g/L時達到最大值。這可能是由于碳源質量濃度的升高有利于酵母細胞的生長,但含量過高時使得其他營養物質(如氮源、生長因子等)相對不足,無法提供酶合成所需的營養成分。碳源質量濃度為175 g/L時,菌株酶活最大,這可能是由于在該質量濃度下,菌株生物量較高,同時對各種物質的利用較為充分所致。而當葡萄糖質量濃度達到225 g/L和250 g/L時,酶活明顯降低,這可能是由于高質量濃度的碳源對糖苷酶的酶活有抑制作用[15]。
2.2 復合碳源對酵母β-葡萄糖苷酶活性的影響
復合碳源對酵母β-葡萄糖苷酶活性的影響見圖3。

圖3 復合碳源對酵母β-葡萄糖苷酶活性的影響
β-葡萄糖苷酶是誘導酶,碳源是該酶合成的誘導物質,復合碳源一般比單一碳源更有利于酶的合成[16]。由圖3可知,與以葡萄糖為單一碳源相比,以麥芽浸膏粉為復合碳源的模擬葡萄汁進行模擬發酵時,菌株生物量和β-葡萄糖苷酶活性均有所提升,這可能是因為麥芽浸膏粉含有豐富的低聚糖及生長因子,在促進酵母菌生長的同時可誘導其糖苷酶的合成。
2.3 不同氮源種類對酵母β-葡萄糖苷酶活性的影響
不同氮源對酵母β-葡萄糖苷酶活性的影響見圖4。

圖4 不同氮源對酵母β-葡萄糖苷酶活性的影響
氮源亦會影響細胞的正常生長繁殖和代謝產物的分泌[17],由圖4可知,不同氮源對模擬發酵中酵母細胞生物量及β-葡萄糖苷酶活性影響很大。在上述8種氮源中,酶活性最高的是以DAP(磷酸氫二銨)為唯一氮源的模擬葡萄汁,這可能是因為DAP本身是酵母細胞生長及次級代謝產物積累過程中的優良氮源,其所含的磷酸鹽是酵母細胞壁及酶合成的重要前體物[17]。模擬葡萄汁中酵母浸粉和蛋白胨等有機氮源酶活較低的可能原因是氮含量差異所致,酵母浸粉中氨基態氮的含量約為3.75%,而相同質量情況下DAP中氮含量則更高。
2.4 有機氮與無機氮比值對酵母β-葡萄糖苷酶活性的影響
有機氮與無機氮比值對酵母β-葡萄糖苷酶活性的影響見圖5。

圖5 有機氮與無機氮比值對酵母β-葡萄糖苷酶活性的影響
由圖5可知,有機氮與無機氮比值對模擬酒中酵母細胞生物量及β-葡萄糖苷酶活性影響很大,隨著有機氮與無機氮比值的增大,酶活逐漸增大,而菌體生物量逐漸降低。這可能與酵母浸粉不僅用作氮源,而且也是生長因子、多種維生素和微量元素等的來源有關[17]。
2.5 初始pH值對酵母β-葡萄糖苷酶活性的影響
初始pH值對酵母β-葡萄糖苷酶活性的影響見圖6。
由圖6可知,隨著pH值的增大,酶活呈先增加后減小趨勢,其中pH值為5.0和5.5時酶活均較高,但此時菌體生物量卻較低。這可能與β-葡萄糖苷酶是一種酸性蛋白[18],在弱酸性條件下更有利于菌體產酶所致。
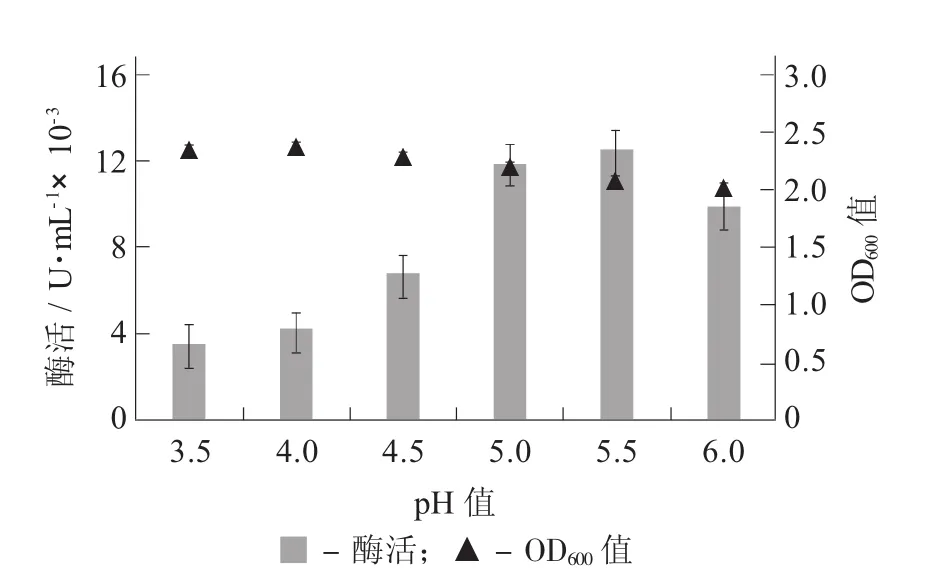
圖6 初始pH值對酵母β-葡萄糖苷酶活性的影響
2.6 SO2濃度對酵母β-葡萄糖苷酶活性的影響
SO2濃度對酵母β-葡萄糖苷酶活性的影響見圖7。

圖7 SO2濃度對酵母β-葡萄糖苷酶活性的影響
由圖7可知,不同濃度SO2對紅佳釀酵母生物量的影響較小,而對其β-葡萄糖苷酶產量的影響較大,隨著SO2濃度的增大,酶活先減小后增大,當SO2濃度為30 mmol/L時酶活最低,這可能是由于在低濃度(10 mmol/L)時,其對釀酒酵母的生長無影響;而當SO2濃度較高時,酵母細胞處于一種抗性環境中,其生長和繁殖周期延長所致[19]。
2.7 多酚質量濃度對酵母β-葡萄糖苷酶活性的影響
多酚質量濃度對酵母β-葡萄糖苷酶活性的影響見圖8。

圖8 多酚質量濃度對酵母β-葡萄糖苷酶活性的影響
由圖8可知,多酚含量對酵母菌生物量的影響較小,但隨著多酚質量濃度的增加,酵母菌酶活力呈增大趨勢,其中多酚質量濃度為0.5 g/L時酶活最低,這可能是由于多酚抑制酵母特定的酶或與金屬離子結合,抑制了β-葡萄糖苷酶的合成;而當多酚質量濃度較高時,其對酵母細胞的生長及繁殖有抑制作用,該環境條件下可能更有利于糖苷酶的合成[20]。
3 結論
試驗結果表明,初始碳源質量濃度為175 g/L,以1%麥芽浸膏粉為附加碳源,DAP為單一氮源,有機氮(酵母浸粉)與無機氮(DAP)比例為3∶1,模擬汁初始pH值為5.5時更有利于釀酒酵母β-葡萄糖苷酶的分泌,SO2和多酚在較低濃度時對酵母產酶無影響,但較高濃度時有促進作用。

