膳食營養素與炎癥性腸病關系研究進展
楊小冰,金明玉,吳小禾,尹 輝,吳小勇*
(1.廣東藥科大學公共衛生學院,廣東 廣州 510310;2.中山火炬職業技術學院生物醫藥系,廣東 中山 528436;3.廣東藥科大學生命科學與生物制藥學院,廣東 廣州 510006;4.廣東藥科大學食品科學學院,廣東 中山 528453)
蛋白質、脂類、碳水化合物是人體必需的三大宏量營養素,在機體的免疫和代謝調節中發揮著至關重要的作用,并日益成為疾病膳食營養干預治療及保健食品研發的主要焦點[1-2]。炎癥性腸病(inflammation bowel disease,IBD)是一組病因尚不明確的腸道慢性炎癥病變,包括潰瘍性結腸炎(ulcerative colitis,UC)和克羅恩氏病(Crohn’s disease,CD),近年來在我國的發病率大幅上升,且IBD的發病機制復雜,主要包括遺傳因素和環境因素,其中飲食是重要的環境因素之一[3]。本文對近年來膳食脂肪、蛋白質、碳水化合物三大營養素對IBD發病機制影響及IBD的飲食干預治療策略等方面的研究進行綜述。
1 炎癥性腸病
1.1 炎癥性腸病的概述
IBD是一組以腸道炎癥性細胞浸潤、腸黏膜受損為主要表現的腸道慢性炎癥病變,包括UC和CD[4]。在病理上UC以結腸黏膜的彌漫性炎癥為特征[5],而CD主要表現為潰瘍、慢性腸道貫壁性破壞及增殖性炎癥改變[6]。這兩種疾病均可見于兒童及成年人,20~40 歲患者較多。IBD的發病多數緩慢,隱匿病史常數月或數年,交替出現于活動期與緩解期,亦有持續活動而不緩解者,少數急性發病類似急性闌尾炎[7-8]。
在過去25 年里,高收入國家IBD的流行性已經增加了2~3 代[9]。在北美和歐洲,分別有超過150萬、200萬 人患有IBD[10]。最新的流行病學研究表明,南美洲、東歐、亞洲和非洲的發病率可能正迅速上升;在發展中國家,IBD也已成為主要的健康問題之一[10]。例如,在中國,IBD已從罕見變為常見,且已占用胃腸和結直腸手術病床的1/4[9]。IBD嚴重危害患者的健康,且發生惡變的概率明顯高于正常人,因此,尋求其科學有效的診斷、預后以及治療手段至關重要[11]。目前IBD的藥物治療以抗炎劑及免疫抑制劑為主,常見的研究如抗腫瘤壞死因子治療、靶向淋巴細胞轉運到胃腸道的抑制劑等,但以藥物治療為靶點的研究結果喜憂參半,且IBD的藥物治療未滿足醫療需求的問題仍然存在[12]。此外,營養療法也已用于IBD的治療,但其作用機理尚不明[13]。進一步深入研究IBD的發病機制對日后探索更為有效科學的干預治療策略有重大意義。
1.2 炎癥性腸病的致病因素及發病機制
目前認為IBD是由遺傳、免疫及環境等多個因素相互作用所致的[14]。由遺傳、環境及腸道菌群的改變結合起來刺激引起的異常免疫反應,進而導致慢性腸道炎癥,被認為是IBD的發病機制(圖1)[15-16]。IBD的遺傳分析已經確定了與UC或CD風險相關的200多個基因座[11]。腸道免疫系統對腸道病原菌的過激反應被認為是IBD發生的原因之一[4](表1)。此外,流行病學和臨床證據表明,IBD與多種環境因素有關[15]。其中飲食在腸道功能和免疫活動中起著重要的作用,且食物成分在腸道內的微生物代謝可影響腸道上皮屏障及黏膜免疫系統(圖2)。飲食在腸道菌群、腸道屏障功能、免疫系統及表觀遺傳方面起著重要的作用,并有望為日后探索IBD飲食干預措施提供理論依據。
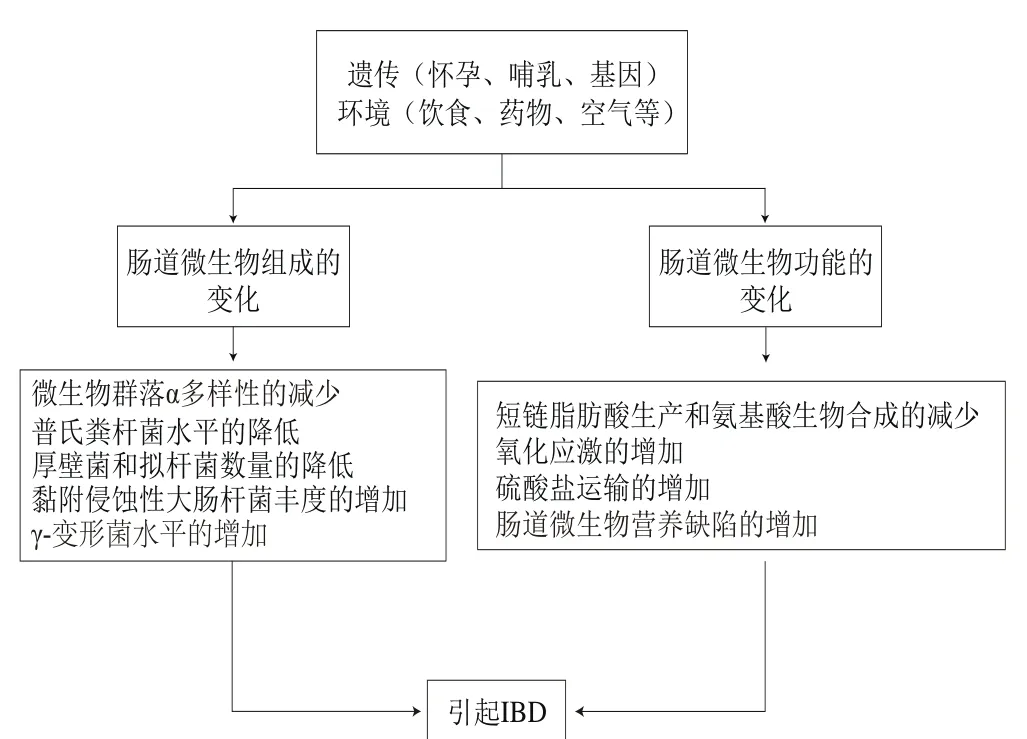
圖1 遺傳、微生物、飲食等聯合作用于腸道內穩態[15-16]Fig.1 Combination of genetics, microbiology and diet plays a role in intestinal homeostasis[15-16]

表1 腸道微生物與炎癥性腸病Table1 Intestinal microorganisms and inf l ammatory bowel disease
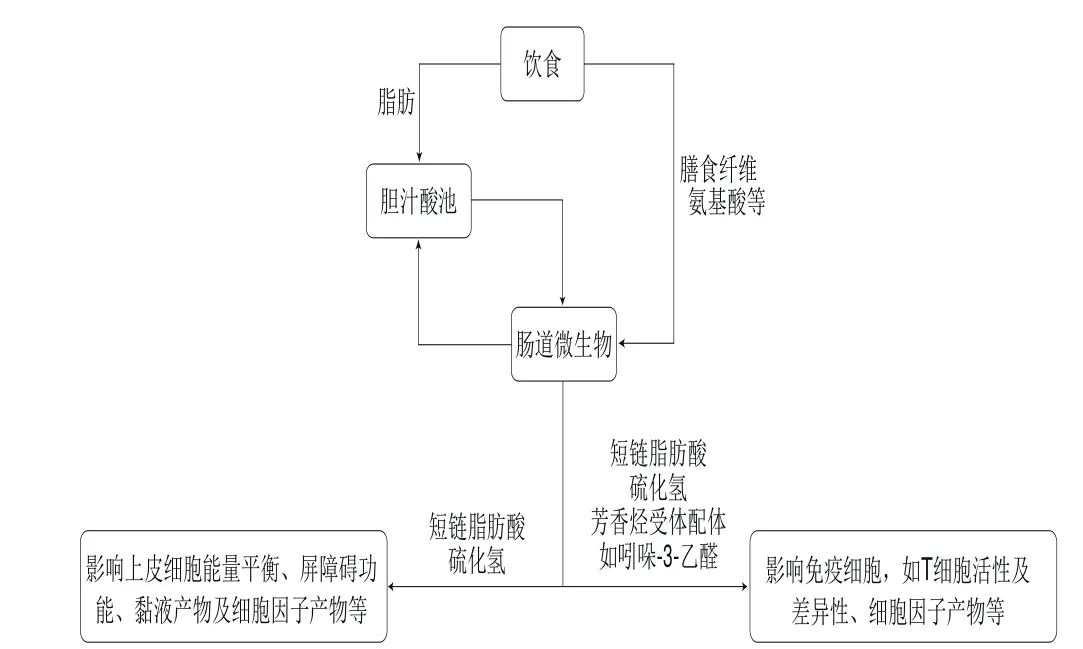
圖2 食物成分與腸道微生物群落的關系[11,28-30]Fig.2 Relationship between food composition and intestinal microbial community[11,28-30]
2 膳食營養素對炎癥性腸病影響的流行病學證據
IBD在北美和歐洲始終保持高發病率趨勢[10]。近年來,隨著人們飲食習慣逐漸西方化(即高脂、高糖、高蛋白低纖維飲食),IBD在亞洲多數發展中國家的發病率也在不斷上升,與許多其他復雜的免疫疾病一樣,IBD的發生與膳食營養、飲食習慣及生活方式關聯密切[3]。流行病學調查結果顯示:高脂攝入增加IBD的發病風險(表2),膳食動物蛋白攝入量的增加可能促進IBD的發生(表3),膳食纖維攝入量與IBD發病率呈負相關(表4)。

表2 膳食脂肪對炎癥性腸病影響的流行病學證據Table2 Epidemiological evidence for the effect of dietary fat on inf l ammatory bowel disease

表3 膳食蛋白對炎癥性腸病影響的流行病學證據Table3 Epidemiological evidence for the effect of dietary protein on inf l ammatory bowel disease

表4 膳食碳水化合物對炎癥性腸病影響的流行病學證據Table4 Epidemiological evidence for the effect of dietary carbohydrate on inf l ammatory bowel disease
3 膳食營養素對炎癥性腸病發病機制影響
3.1 膳食脂肪對炎癥性腸病發病機制的影響
膳食脂肪的類型對IBD的發病機理可能有特定的影響(表5)。高脂飲食通過使腸道菌群失調、破壞腸道屏障、改變固有免疫及其與遺傳風險的組合作用導致IBD的發生[3]。
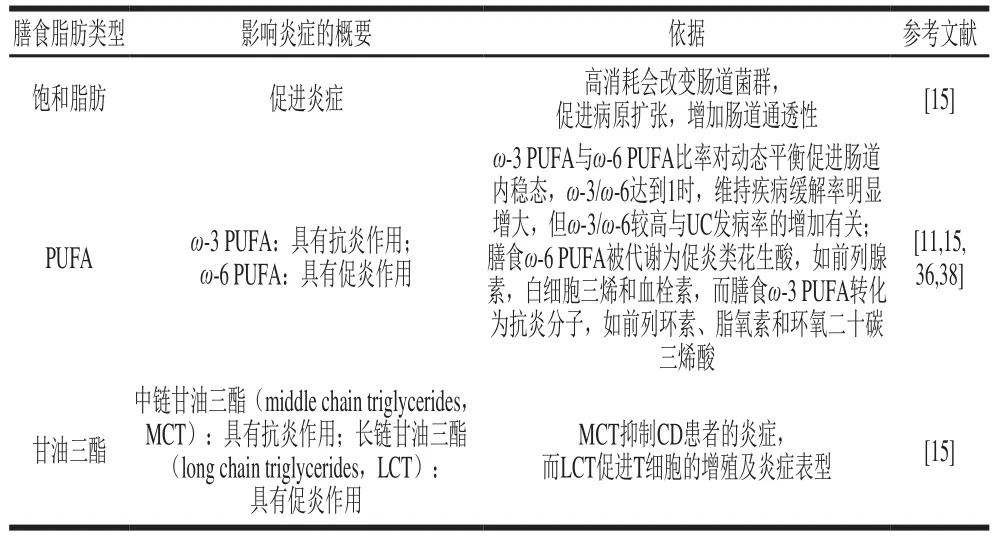
表5 膳食脂肪對腸道內穩態的影響Table5 Effect of dietary fat on homeostasis in the intestine
不合理的飲食結構(尤其是飽和脂肪酸的攝入增加)與腸道菌群失調密切相關[11]。而腸道菌群紊亂可引發腸道炎癥及激活腸道大麻素系統,進而增加腸道通透性,導致腸腔中脂多糖(lipopolysaccharide,LPS)大量入血,引發全身慢性低度炎癥[39]。研究發現,攝入ω-3 PUFA有助于減輕高脂飲食對腸道屏障的損傷,進而減少LPS入血,有效改善全身慢性低度炎癥狀態[39]。
腸道屏障是半滲透性的,可通過管腔內負載的微生物保護機體。研究表明,長期高脂飲食可破壞小鼠腸道屏障的完整性,引起緊密連接蛋白(如閉鎖小帶蛋白1(zonula occuludens-1,ZO-1))表達下降,進而增加腸道通透性,最終導致LPS進入體循環引起低度炎性反應[3]。此外,乳化劑作為高脂食物中的主要添加劑,可促進腸道菌轉運穿過腸道屏障,進而損害腸黏膜完整性,導致大量腸腔微生物轉移至上皮層,最后引起腸道慢性低度炎性反應[3]。高脂飲食常見的后果就是肥胖,與IBD一樣由炎癥引起,其中IL-1β、IL-6和腫瘤壞死因子-α(tumour necrosis factor-α,TNF-α)等炎癥因子水平在肥胖和IBD患者中均升高[4]。此外,在IBD患者的血清中發現脂肪組織分泌的炎癥介質,如脂聯素、抵抗素和瘦蛋白[4]。其中瘦蛋白通過產生IL-6、IL-1p以及趨化因子激活免疫反應,促進UC的發生[3]。
據小鼠模型的研究表明,僅高脂飲食不足以導致IBD,需要組合高脂飲食與遺傳風險才會加劇對IBD的影響。研究表明,涉及PUFA代謝的基因與PUFA代謝物的內源性水平相關[40],且ω-3 PUFA與ω-6 PUFA的比例對IBD易感性的影響可能由脂肪酸代謝基因的遺傳變異調節,如CYP4F3和FADS2[11]。這些發現均表明高脂飲食-基因的相互作用與IBD發病機制有一定的關聯性,因此,進一步深入研究高脂飲食、基因及IBD三者間的關系網極其重要。
3.2 膳食蛋白對炎癥性腸病發病機制的影響
食物中蛋白質的消化產物主要是氨基酸及一些小肽,約有95%經過胃和小腸被消化吸收,未吸收的氨基酸及未消化的蛋白質在大腸下部被大腸桿菌分解,進而導致IBD[41]。小鼠模型研究表明,UC與硫化物生產率相關。硫化物是含硫氨基酸到達結腸,然后通過硫酸細菌或硫酸鹽還原細菌的作用轉化生成的;含硫氨基酸的主要來源是高蛋白食物,如紅肉、魚、牛奶、雞蛋等[15]。據以往研究,素食者的腸道菌群中擬桿菌屬、雙歧桿菌及大腸桿菌的數量較非素食者少,而攝食富含蛋白質食物者,腸道中以大腸桿菌為主的腐敗菌數量明顯增加,進而增加IBD的發病風險[41]。此外,蛋白質的代謝產物可能為腸道細菌提供可改變微生物組成(如導致病原體擴張)的發酵底物,進而影響腸上皮細胞功能[15]。
蛋白攝入量高,尤其是動物蛋白,與IBD的風險相關。其中動物蛋白衍生的生物活性肽可能是有益的,如蛋黃、牛奶衍生的活性肽可以減少腸道上的氧化應激,而這種抗氧化活性對IBD可能是有益的[42]。一項高蛋白膳食對限食大鼠腸道抗氧化功能影響的研究表明,高蛋白膳食通過增強機體及腸道組織局部的超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽過氧化物酶(glutathione peroxidase,GSH-Px)的活性,進而減輕限食引起的氧化應激損傷達到保護腸道屏障功能的效果[43]。
膳食蛋白的消化產物氨基酸及一些肽可通過影響腸道黏膜免疫系統,進而影響IBD。研究表明,膳食丙氨酸-谷氨酸二肽通過減少炎癥介質的表達,進而提高黏蛋白2和熱休克蛋白72的表達,加快葡聚糖硫酸鈉(dextran sulfate sodium,DSS)誘導的UC小鼠模型黏膜的恢復[42]。牛乳蛋白κ-酪蛋白衍生的糖巨肽在UC淋巴細胞轉移小鼠模型中發揮抗炎作用[44]。此外,一些氨基酸在腸道系統中可能具有抗炎和抗凋亡作用,如色氨酸在DSS誘導的豬IBD模型中顯示出有益的作用;以及變構調節劑作用,如谷氨酰胺二肽、芳香族氨基酸,可通過使TNF-α信號傳導通路的衰減引起有效的抗炎作用,進而調節鈣敏感受體(calcium sensing receptor,CaSR)的活性[44]。因此,胃腸道表達的CaSR有望成為可增強腸道健康的飲食肽或氨基酸的新型治療靶標[44]。
3.3 碳水化合物對炎癥性腸病影響的機制
碳水化合物可根據是否被小腸吸收利用分為:可消化碳水化合物(如葡萄糖、果糖、淀粉等)、不可消化碳水化合物(又稱抗性淀粉,如膳食纖維、菊粉、低聚果糖及低聚半乳糖等)。與膳食脂肪觀察到的結果相似,攝入碳水化合物的類型對于確定IBD發病機制的陽性或陰性作用是至關重要的[15]。
可消化碳水化合物促進IBD發生,可能是通過影響腸道的吸收機制,進而增加腔內糖濃度,促進細菌在腸道中的過度生長有關。IBD患者經常有果糖吸收不良或乳糖不耐受的現象證實了以上這一假設[11]。在小鼠研究中,高糖飲食被證明可以促進腸道發育不良、細菌病原體的膨脹、腸道通透性和炎癥的增加[11]。適當調整可消化碳水化合物與不可消化碳水化合物的比例可影響腸道菌群,如降低可消化碳水化合物比例、增加不可消化碳水化合物比例能降低食物的消化吸收速率,增加到達結腸的碳水化合物數量,為結腸益生菌生長提供充足的碳源,誘導腸道菌群向有利于健康的方向轉變[45]。
不可消化的碳水化合物被結腸中的微生物群發酵,以促進細菌多樣性、保持黏膜屏障,并增強有利于維持腸內穩態的短鏈脂肪酸(short chain fatty acid,SCFA)的產生。有研究表明,廣泛細胞類型表達的G蛋白偶聯受體(G protein-coupled receptor,GPR)是SCFA的內源性受體,如GPR41、GPR43和GPR109a,對IBD的調節有著重要的作用(圖3)[37,46-47]。膳食纖維是不可消化的碳水化合物,分為3 類:可溶性(如果膠)、不溶性(如纖維素)和混合(如麩皮)。來自水果的膳食纖維通常是可溶性或可發酵的纖維,且這種可發酵纖維被腸細菌代謝為SCFA,進而抑制NF-κB和促炎介質的轉錄[46]。研究發現,IBD與膳食纖維相關,特別是一些水果和十字花科蔬菜的膳食纖維,且這種關聯是通過廣泛分布在小腸上皮淋巴細胞內芳香烴受體(aryl hydrocarbon receptor,AhR)介導的,而被激活的AhR可保護腸上皮細胞免受抗原及異物的侵害[47-48]。
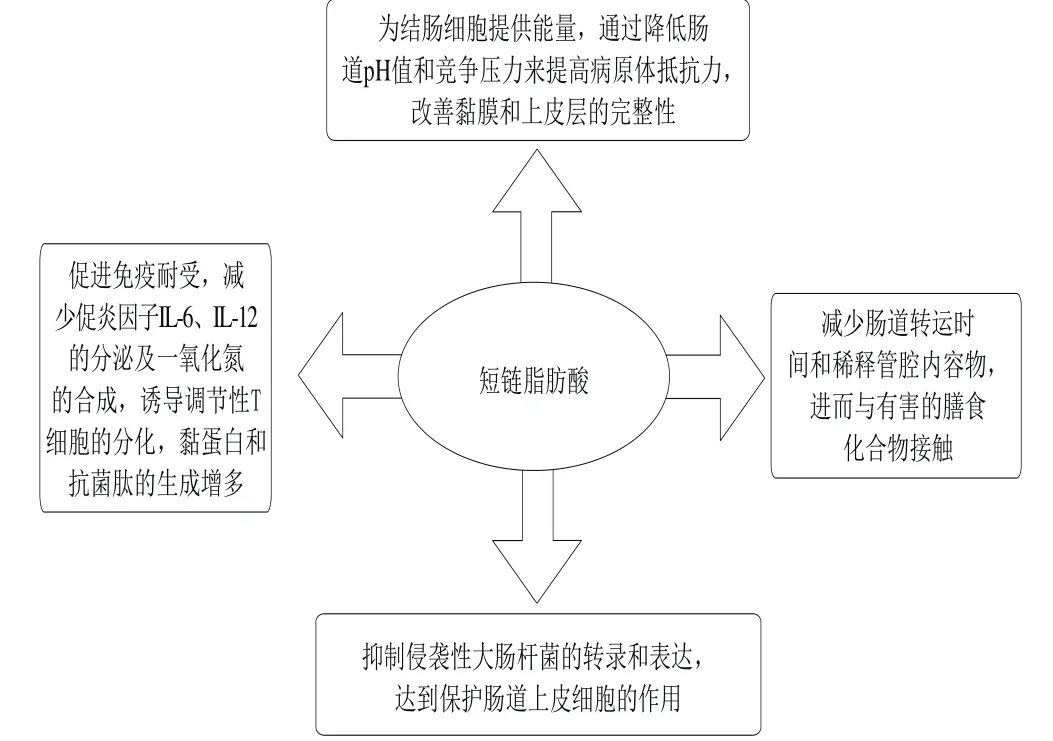
圖3 短鏈脂肪酸對IBD的調節作用[37,46-47]Fig.3 Effects of short chain fatty acids on the regulation of IBD[37,46-47]
4 基于飲食干預的炎癥性腸病防治策略
IBD患者普遍存在營養不良的癥狀,主要是蛋白質-能量、各種維生素、礦物質及微量元素的吸收不良導致的,且膳食成分可能通過影響氧化應激直接影響腸內平衡,影響參與調節腸道炎癥的轉錄因子的表達[34,49-50]。因此,加強IBD的飲食干預對于預防或控制相關的營養不良,進而降低發病率和死亡率,提高生活質量至關重要[51]。
高纖維飲食可減少動物模型的結腸炎,并對IBD有積極的保護作用[52]。此外,高膳食纖維的攝入可能對結直腸癌具有保護作用。水果和蔬菜的攝入量與炎癥標志物呈負相關,如C反應蛋白(C reactive protein,CRP)、IL-6、TNF-α等[52];而可發酵的膳食纖維經腸道菌群的作用生成的有益成分(如丁酸),可通過提高過氧化物酶體增殖物激活受體-γ(peroxisome proliferators-activated receptor-γ,PPAR-γ)的活性來降低結腸通透性,進而預防IBD的發生[3]。
研究表明,益生菌及益生元的治療策略旨在恢復胃腸道微生物群落的平衡,以預防或減少IBD;益生菌含量豐富的食物對IBD有一定的緩解作用[53]。研究已證明,益生菌可操縱有益和有害細菌物種的平衡,進而調節體內平衡與炎癥反應[53]。且益生菌可結合特定的腸細胞受體,定植于結腸,通過產生細菌素、乳酸、丁酸以及過氧化氫等物質抑制病原菌生長[3]。此外,益生菌在腸黏膜中與腸上皮細胞和免疫細胞相互作用,增加黏液的產生,通過緊密連接蛋白生成量的增加以及免疫反應的過表達,如免疫球蛋白A(immunoglobulin A,IgA)的生成量增加、自然殺傷細胞活性和吞噬能力的增強,進而增強腸黏膜屏障功能[3]。而益生元是一種難以消化的碳水化合物(如菊粉、低聚果糖等),能刺激宿主中特殊菌種的生長,具有改善腸道菌群的功能。這些難以消化的食物成分主要是通過增加腸道中某些細菌的數量,從而改變微生物群,當到達結腸時,它們被厭氧細菌發酵,產生有利于維持腸內穩態的SCFA[53]。綜上所述,食用富含益生菌的食物及益生元類食物可改善腸道菌群,進而達到預防和治療IBD的效果。
除宏量營養素外,微量營養素對IBD的預防及治療也有積極的作用,可維持腸道上皮屏障、或直接影響腸免疫應答與腸微生物組成[16]。Scalabrino[54]回顧了目前關于維生素的文獻發現,維生素可以對某些細胞因子和生長因子的合成具有一定的調節作用,因此,使用維生素來治療疾病的方法可能是合理的,包括與細胞因子或生長因子合成的不平衡相關的疾病,如UC和CD[55]。且在IBD營養方案設置中所提及主要起作用的是脂溶性維生素,如VA、VD、VE和VK[56]。研究發現,VD缺乏可能促使IBD的發生,如相關研究所示,VD通過限制促炎細胞因子TNF-α和IL-12的過量產生來抑制炎癥[57]。此外,VD可刺激抗微生物蛋白、導管素和一些防御素的合成來促進先天免疫,而這些抗菌肽是位于胃腸道上皮表面的先天免疫系統分子,具有抗細菌、抗病毒和抗真菌作用以及趨化細胞因子的功能[34]。以上研究均證實VD的一個關鍵功能是通過腸道生產抗菌因子來增強免疫力。同時,也有研究表明VA對免受腸道病原體的影響至關重要的,在VA代謝生成的維甲酸作用下,樹突狀細胞(dendritic cell,DC)誘導調節性T細胞,而在沒有視黃酸的情況下,DC誘導輔助性T細胞17(T helper cell 17,Th17)分泌IL-17導致炎癥反應。且在VA缺乏的大鼠中已經發現B細胞和T細胞向腸道的遷移受損[34]。此外,有研究者認為VK可能在IBD患者的疾病活動和骨骼健康維持中起重要作用[55]。脂溶性維生素對IBD的影響是好還是壞,仍需進行規模更大、更長期的研究[58]。
5 結 語
據流行病學及臨床研究所述,飲食的單一作用不足以引起IBD的發展,而是與其他危險因素(如微生物群組、遺傳學)聯合作用,進而引起IBD[15]。最近研究表明,食物成分可以調節表觀遺傳機制,因此,深入理解不同食物成分在腸道內穩態和微生物群組中的作用可能對于揭示IBD發病機制表觀遺傳和環境相互作用的復雜分子基礎相當重要[59]。IBD相關多態性與黏膜屏障功能、先天性細菌殺傷、免疫調節和微生物功能的改變有關[60]。飲食危險因素也對這些功能有一定的影響,并可能與遺傳因素相結合,進而擴大原發性缺陷(劑量效應)或損害多種腸內穩態機制。例如,具有ECM1遺傳多態性個體的上皮滲透性增加,且其可在高脂飲食的情況下進一步增加[61]。另外,飲食可以影響微生物的功能特性,導致上皮黏附和侵襲的增加,與先天細菌殺死(ATG16L1或NOD2多態性)的遺傳缺陷結合時,會導致慢性炎癥的持續感染[62]。且食物是影響腸道微生物群和微生物組基因相對豐度的主要因素,與此同時,微生物群組及其結構會影響食物的營養價值[63-64]。因此,研究飲食、微生物群組及遺傳因素對IBD的影響時,進一步的動物模型研究不同遺傳易感背景的個體飲食成分、腸道微生物群組與飲食的相互作用是必不可少的。此外,在IBD飲食干預研究中應納入基因及微生物分析[15],為日后探索IBD個體化營養干預及治療提供理論基礎。
飲食不是影響IBD易感性及其進展唯一的環境因素,但它是最易確定和控制的因素之一;且飲食與基因組、腸道微生物組間的相互作用的研究將為探索IBD更有效的、個體化的治療方法提供有力的依據。此外,在此基礎上予以合理的飲食管理和飲食指導治療IBD,有助于減輕與IBD相關的炎癥癥狀和腸道損傷,對預防和控制IBD具有重要意義,并為日后研發可預防及緩解IBD的保健食品提供理論依據。

