酶解大豆分離蛋白的抗原活性變化及其抗原表位分析
王章存,袁路陽,張 露,胡金強,安廣杰,趙學偉
(1.鄭州輕工業大學食品與生物工程學院,河南 鄭州 450001;2.食品生產與安全河南省協同創新中心,河南 鄭州 450001)
大豆蛋白是最重要的植物蛋白來源,具有蛋白質含量高、氨基酸組成合理等優點,被廣泛應用于食品工業中[1-2]。然而,大豆被公認為世界“八大”過敏原之一[3],目前已從大豆中確認出38 種蛋白質具有抗原性,其中大豆中的主要儲藏蛋白β-伴大豆球蛋白(7S)和大豆球蛋白(11S)是主要的抗原性蛋白[4]。大豆導致的主要癥狀表現為胃部不適或過敏性皮炎,嚴重時導致人體和動物毛細血管滲透性增加、腹瀉等,嚴重影響人體健康[5-6]。在世界范圍內均對大豆蛋白的抗原性給予高度重視。
食品加工中最常用加熱處理并不能有效消除大豆蛋白的抗原性,其原因是加熱處理僅能破壞其構象型抗原表位(又稱抗原決定簇),很難破壞其序列型抗原表位[7]。酶解處理不僅可破壞蛋白質的空間構象,也可水解序列型抗原表位,能有效降低甚至消除蛋白質的抗原性。近年來國內外對此進行了較多研究,發現用堿性蛋白酶水解降低抗原性的效果比其他蛋白酶較好[8-11]。但有研究表明,即使堿性蛋白酶也無法完全消除其抗原活性,而且酶解過程產生新的肽段對酶解具有一定的抵抗作用[12-15]。這些抗酶解肽段是否具有抗原活性、其氨基酸是否存在序列性抗原表位、它們來源于大豆蛋白的哪些亞基及其抗酶解的原因等問題,尚鮮見文獻報道。
本研究用堿性蛋白酶水解大豆分離蛋白后,在分析蛋白質分子成分和抗原性變化的基礎上,采用基質輔助激光解析串聯飛行時間質譜(matrix-assisted laser desorption/ionization time of flight mass spectrometry,MALDI-TOF-MS)分析酶解后新產生的抗酶解成分的序列特征,并與抗原數據庫數據及大豆分離蛋白的各亞基序列進行匹配,從分子水平上解釋酶解不能完全消除大豆蛋白抗原性的原因,為有效酶解大豆蛋白去除其抗原性提供科學理論。
1 材料與方法
1.1 材料與試劑
大豆分離蛋白 河南陽光油脂公司。
堿性蛋白酶(2.4 AU/g) 丹麥諾維信公司;大豆酶聯免疫吸附測定(enzyme-linked immunosorbent assay,ELISA)試劑盒 上海紀寧公司;蛋白膠微量回收試劑盒 北京百奧萊博科技有限公司;低分子質量標準蛋白(分子質量14~97 ku) 上海生物化學研究所;十二烷基硫酸鈉 美國Sigma公司;三羥甲基氨基甲烷、甘氨酸、溴酚藍、丙烯酰胺、二硫蘇糖醇、N,N’-亞甲基雙丙烯酰胺 生工生物工程(上海)股份有限公司。以上試劑均為分析純。
1.2 儀器與設備
TDZ5-WS型低速離心機 湖南湘儀儀器公司;冷凍干燥機 北京博醫康實驗儀器公司;DYY-6C型電泳儀北京六一儀器廠;5800 MALDI-TOF-MS儀 美國AB SCIEX公司。
1.3 方法
1.3.1 大豆分離蛋白的水解
取10 g大豆分離蛋白加水配制成5%溶液,加熱至55 ℃,用2 mol/L NaOH溶液調至pH 8.0。然后按照酶-底物為0.5%的比例加入堿性蛋白酶,反應開始并計時,整個反應過程中通過滴加2 mol/L NaOH溶液維持反應體系中pH值的穩定,反應達到一定時間后,取適量樣品于沸水浴中保溫10 min進行滅酶。然后將滅酶后的樣品冷凍干燥并于-20 ℃保存。
1.3.2 十二烷基硫酸鈉-聚丙烯酰氨凝膠電泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)分析
根據Laemmli[16]的方法采用不連續垂直凝膠電泳系統。濃縮膠5%,電泳電壓80V。分離膠12%,電泳電壓110 V。采用14~97 ku低分子質量的標準蛋白,電泳結束后,采用考馬斯亮藍R-250進行染色,脫色后,采用Gel-PRO ANALYZER軟件分析。
1.3.3 競爭法ELISA對酶解物抗原活性的測定[17]
采用競爭法ELISA檢測酶解產物的抗原性,具體操作按照ELISA試劑盒說明書的步驟進行,計算出樣品濃度,以抗原剩余率(%)表示酶解效果。每個樣品重復3 次,數據采用Origin 8.0軟件處理。
1.3.4 胰蛋白酶的膠內酶解
將21 ku和23 ku SDS-PAGE蛋白條帶分別進行膠內酶解,方法參照文獻[18]相關步驟進行操作。酶解后的樣品經C18Cartridge脫鹽后,凍干并于-20 ℃貯存備用。
1.3.5 MALDI-TOF-MS分析[19]
采用配有N2激光(337 nm,3 nm脈沖間隔)的MALDI-TOF-MS對所得肽段進行分析。取1 μL肽樣品點加到專用不銹鋼盤中,以α-氰基-4-羥基肉桂酸作為基質(用量1 μL,配制方法為取5 mg固體基質試劑,溶解到0.5 mL 0.1%三氟乙酸和50%乙腈溶液中),點樣后室溫下干燥。用Sigma公司標準分子質量肽進行外標分析。
采用正離子模式和自動獲取數據的模式采集數據,一級質譜(MS)掃描范圍為800~4 000 Da,選擇信噪比大于50的母離子進行二級質譜(MS2)分析,二級質譜(MS2)累計疊加2 500 次。數據圖譜由FlexControl軟件采集,采用Data Explorer V4.5軟件分析。
1.3.6 數據庫檢索
質譜測試原始文件用Mascot 2.2軟件檢索相應的數據庫。檢索參數如下:數據庫:uniprot Glycine max;搜索類型:(MS+MS2)相結合;水解用酶:胰蛋白酶;質量值:單同位素;蛋白質質量:無限制;肽質量允許量:+100×10-6;肽片段質量允許誤差范圍:±0.4 Da;酶切位點數:1。
1.3.7 肽鏈抗原活性測定
SDS-PAGE膠片上的目的條帶(未染色),采用蛋白膠微量回收試劑盒按照說明書步驟分別將膠中蛋白進行回收。回收的蛋白經C18Cartridge脫鹽后用N2吹干于-20 ℃保存。將回收的樣品用10 μL水復溶,按照1.3.3節方法進行抗原性的測定。
2 結果與分析
2.1 酶解過程中大豆分離蛋白成分的變化
大豆分離蛋白經堿性蛋白酶水解不同時間后,通過SDS-PAGE方法分析酶解物中組分的變化,結果如圖1所示。
從圖1可以看出,隨著酶解時間的延長,蛋白質譜帶發生了規律性的變化。酶解10 min 時,7S蛋白中的α’、α和β三個亞基都已完全消失,11S球蛋白中的38 ku酸性亞基(圖1A)和21 ku堿性亞基(圖1B)含量也明顯減少,與此同時,新產生了大量23 ku組分及大量的分子質量小于14 ku組分。30 min時,21 ku不僅沒有繼續減少,而且相對于10 min時有少量增加的跡象,表明酶解過程中有新生成的21 ku組分。90 min時,38 ku的酸性亞基已完全消失。直到120 min時,21 ku和23 ku組分含量基本保持不變。從30~120 min酶解的趨勢看,21 ku和23 ku組分始終沒有將被酶解減少的跡象。
以上結果表明,大豆分離蛋白中的7S蛋白很容易被堿性蛋白酶水解,而11S球蛋白的堿性亞基不易被水解,新生成的21 ku和23 ku肽段對堿性蛋白酶的抗酶解現象更明顯。
2.2 酶解物抗原活性分析
蛋白質的抗原性取決于其分子結構,酶解被認為是消除蛋白質抗原性的有效手段。但大量研究表明,抗原蛋白質分子中的抗原表位分為構象型和序列性兩種類型[20-21]。構象型抗原表位隨著蛋白質空間構象的變化消失明顯,而序列性表位則相對穩定,即使蛋白質分子受到酶解處理,只要該氨基酸序列不被切斷,則仍可能具有抗原活性。
為了解大豆分離蛋白酶解過程中抗原活性的變化,采用競爭法ELISA專用試劑盒測定不同酶解時間后大豆分離蛋白酶解物的抗原活性(圖2)。之所以采用競爭法ELISA分析,是基于大豆蛋白經過酶解后分子質量降低,該法可以測定出樣品中小分子抗原的存在,而且靈敏度很高。

圖2 不同酶解時間大豆分離蛋白抗原活性的變化Fig. 2 Changes in antigenicity during the hydrolysis of soybean protein isolate
從圖2可以看出,在酶解開始10 min后,抗原活性有明顯下降的趨勢,此階段也是7S蛋白中α’、α和β三個亞基被迅速酶解的時間(圖1),可能在酶解的前10 min,抗原蛋白的空間結構發生明顯變化,破壞了構象表位。在10~30 min時,抗原活性下降的趨勢有所減弱,可能是隨著構象表位的減少,酶與抗原蛋白的結合位點也隨之減少,酶解速率下降減弱了抗原活性的下降趨勢,也可能是在構象表位進一步遭到破壞后暴露出了抗原蛋白空間內部的線性表位,在一定程度上抑制了抗原活性下降的趨勢[22]。在30~120 min時,抗原活性下降的趨勢進一步減弱,并逐漸趨于平緩,此變化規律與酶解過程中蛋白質分子亞基的變化趨勢相似,可能此時只剩余抗原蛋白中的線性表位,且這些線性表位不易被堿性蛋白酶快速水解破壞。直到酶解120 min時,大豆分離蛋白的抗原活性也未完全消失,意味著酶解物分子中可能仍有線性表位的存在。據報道,大豆11S球蛋白堿性亞基(圖1中B條帶)很少能與過敏者血清的IgE抗體發生結合而引起過敏反應[23-25]。所以酶解過程中抗原性的變化基本與該亞基沒有關系,水解120 min后酶解物所殘留的抗原活性都來源于新生成的組分。
2.3 MALDI-TOF-MS肽段分析
為進一步探討酶解過程中新形成的具有抵抗堿性蛋白酶解特點的21 ku和23 ku肽分子特征與酶解物中殘留抗原性的關系,分別對SDS-PAGE中21 ku和23 ku譜帶(圖1)進行切膠回收,并采用胰蛋白酶對回收的兩個膠條分別進行膠內酶解,將膠內酶解物用MALDI-TOF-MS進行分析,見圖3。將肽段的氨基酸序列與抗原數據庫http://www.immuneepitope.org中抗原表位的氨基酸序列進行匹配,結果見表1、2。
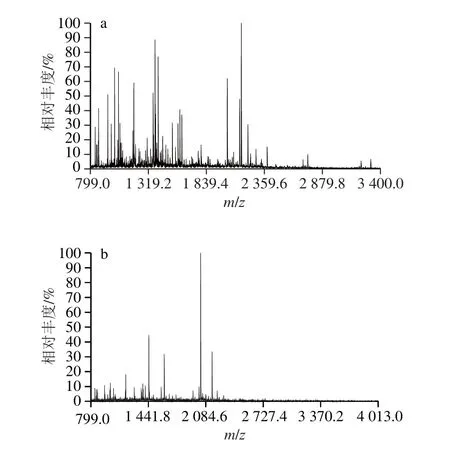
圖3 酶解120 min時21 ku(a)和23 ku(b)的MALDI-TOF-MSFig. 3 MALDI-TOF-MS of 21 ku (a) and 23 ku (b) peptides obtained in the 120 min hydrolysate
從圖3a可以看出,21 ku經胰蛋白酶膠內酶解后產生了很多肽段。通過Mascot軟件將MALDI-TOF-MS檢測到的肽段序列與抗原數據庫中抗原表位序列匹配發現:MALDI-TOF-MS檢測到21 ku中有16 條肽段(共檢測到25 條)的氨基酸序列與抗原表位序列有部分序列重合,此結果說明:21 ku肽鏈經胰蛋白酶進行膠內酶解后,大部分完整的抗原表位都已被破壞。

表1 肽段21 ku中檢測到的氨基酸序列和對應抗原序列Table 1 Identi fied peptide sequences in 21 ku fragment and corresponding antigen sequences

表2 肽段23 ku中檢測到的氨基酸序列和對應抗原序列Table 2 Identifified peptides sequences in 23 ku fragment and corresponding antigen sequences
為進一步分析未經胰蛋白酶水解的21 ku肽鏈中是否存在完整的抗原表位序列,根據胰蛋白酶水解位點是賴氨酸(K)和精氨酸(R)羧基端的特點,將已檢出抗原序列片段進行拼接,并與蛋白質數據庫(http://www.uniprot.org)中大豆蛋白氨基酸序列進行匹配確定出其所在原大豆分離蛋白氨基酸序列的位置,再與抗原數據庫的抗原表位氨基酸序列匹配,結果發現2 個完整的序列表位(圖4):一個是表1中含有部分抗原序列的VLQRFNQR和SPQLQNLRDYR拼接后的氨基酸序列,與β-伴大豆球蛋白α-亞基中的VLQRFNQRSPQLQNLRDYR(序號為216~234)氨基酸序列重合。經抗原數據庫查詢,這個序列中包含有完整的抗原表位序列LQRFNQRSPQLQNLR。另一個是表1中TISSEDKPFNLR、SRDPIYSNK、LGKFFEITPEK和FFEITPEKNPQLR肽段經胰蛋白酶水解位點拼接后的氨基酸序列,與β-伴大豆球蛋白中α-亞基中的TISSEDKPFNLRSRDPIYSNKLGKFFEITPEK NPQLR(序列為398~434)的氨基酸序列重合。經抗原數據庫查詢,此序列中包含有完整的抗原表位序列SEDKPFNLRSRDPIYSNKLGKFFEITPEKN。以上結果說明:酶解物中仍殘留抗原性的原因之一是酶解新產生的21 ku肽鏈中含有2 個完整的抗原表位,且此21 ku肽鏈來源于β-伴球蛋白的α-亞基。

圖4 21 ku亞基中鑒定出包含完整抗原的肽段序列以及所在大豆分離蛋白的亞基位置Fig. 4 Complete antigen sequence in 21 ku peptide and its location in soybean protein
從圖3b可以看出,23 ku肽鏈經胰蛋白酶膠內酶解后也產生了很多肽段。按照前述相同的分析方法處理后發現,有12 條肽段(共檢測到17 條)含有抗原表位部分序列,其中有3 條肽段(表2中相對分子質量為1 010、1 051和1 618對應的肽段)均分別與兩個以上的抗原表位部分序列重合。但是,將胰蛋白酶水解位點拼接后再與抗原數據庫中的抗原序列進行匹配,未發現含有完整抗原表位序列的肽段。意味著未經胰蛋白酶水解的23 ku肽鏈中,沒有與完整抗原表位序列相匹配的氨基酸序列。推測大豆分離蛋白經堿性蛋白酶水解120 min后所產生的23 ku組分中不存在抗原活性。
另外,在該蛋白酶解產物中還存在一些相對分子質量小于21 ku的組分(圖1)。由于SDS-PAGE中這些組分的顏色較淺(意味著蛋白含量較少)且譜帶特征不明顯(分散),暫未對這些組分進行研究。這些組分是否含有序列型抗原表位,有待于進一步深入分析。
2.4 肽鏈抗原性分析
為驗證21 ku和23 ku肽段是否存在抗原性,本研究采用蛋白膠微量回收試劑盒對膠內21 ku和23 ku蛋白分別回收,并采用競爭法ELISA試劑盒對其進行抗原活性的測定,計算其抗原剩余率分別為15.7%和2.1%。
21 ku組分有相對較高的抗原性(為大豆分離蛋白抗原性的15.7%),這與該組分中檢測到存在完整抗原表位的結果一致。在23 ku組分的抗原剩余率僅為2.1%,而質譜分析中未檢測出表位序列,這與兩個因素有關:一是23 ku中可能存在未知的序列表位,相關數據庫中沒有列入,所以無法比對;二是可能與大豆蛋白分子中糖鏈的存在有關。β-伴大豆球蛋白是一類糖蛋白[26],有些糖蛋白的糖鏈本身就是抗原[27-29],且有研究表明大豆抗原蛋白經N-糖苷酶脫去糖鏈后其抗原性降低[30-31]。上述23 ku組分抗原性是否與糖鏈有關,本課題將進一步深入研究。
3 結 論
隨著酶解時間的延長,大豆分離蛋白各組分及其酶解物的抗原活性發生規律性變化,且二者存在很大的相似性。酶解前30 min時,7S蛋白中α’、α和β三個亞基迅速被降解,且產生了21 ku和23 ku新組分,直至120 min,這些組分依然存在。競爭法ELISA分析表明:在酶解最初的30 min內抗原活性快速降低,之后降低趨勢減緩,直到酶解120 min時,依然有28%的抗原剩余率。將21 ku和23 ku的電泳譜帶分別經胰蛋白酶水解后采用MALDITOF-MS分析,其結果與抗原數據庫、大豆蛋白數據庫中相關氨基酸序列進行匹配表明:21 ku組分中含有兩個完整的序列型表位,且這兩個序列型表位均來自β-伴大豆球蛋白的α-亞基;在23 ku經胰蛋白酶水解后雖有片段與抗原表位部分序列相同,但未發現有完整的序列型表位存在。經對21 ku和23 ku組分單獨進行抗原性測定發現,21 ku組分中有相對較高的抗原性,與上述21 ku中存在完整抗原表位的實驗結果基本吻合,而23 ku依然表現出微弱的抗原性,是否與糖蛋白中糖鏈有關,有待進一步研究。上述結果一定程度解釋了酶解物仍有抗原活性存在的部分原因,也揭示了新生成的具有抗原活性表位肽鏈的分子來源。

