氨基化Fe3O4-SiO2固定化磷脂酶A1
李進紅,操麗麗,龐 敏,潘麗軍,侯志剛,水龍龍,鮑 賽,姜紹通*
(合肥工業大學食品與生物工程學院,安徽省農產品精深加工重點實驗室,安徽 合肥 230009)
磷脂廣泛存在于植物油脂中,隨著植物油存放時間的延長,會使油脂變得不穩定,促使氧化酸敗加劇,顏色加深[1],增加過濾和操作的難度,造成設備結焦、脫色脫酸效果不佳、煉耗和輔助劑的用量增大等問題。因此菜籽油的脫磷對精煉工藝變得尤為重要[2-4]。隨著對菜籽油品質的要求提高以及節能環保的理念增強,酶法脫膠具有廣闊的研究前景[5-6]。磷脂酶主要包括磷脂酶A1、A2、B、C和D,它們能夠特異性水解磷脂內部酯鍵,生成對應的溶血磷脂和脂肪酸。溶血磷脂具有良好的水分散性,易在水化工藝階段去除[7-8]。磷脂酶A1熱穩定性良好,酶活力高,反應穩定,適合用于科學研究和工業應用[9]。磷脂酶具有高效性和高度專一性,應用于油脂脫膠中具有反應條件溫和、耗能低,幾乎不會產生廢水的優點。
固定化酶的方法和材料豐富多樣,隨著綠色發展的腳步加快,經濟環保的材料成為科學研究的熱門話題。水龍龍[10]、劉倩倩[11]等以離子交換樹脂吸附固定化磷脂酶。以大孔樹脂固定化酶會隨著反應次數的增加,底物和產物的積累,使傳質阻力增加,反應效率降低。經物理吸附的固定化酶結合穩定性差,造成酶較易泄露。陳麗萍[12]、占劍峰[13]等以天然高分子材料包埋固定化磷脂酶。天然高分子材料無毒無害,傳質性好,但機械強度低,易溶解,容易受金屬離子的影響。于殿宇等[14]以纖維素為載體,得到結合牢固,穩定性好的共價固定化磷脂酶。
磁性Fe3O4納米離子具有較大的比表面積,同時具有的超順磁性,即在外加磁場中具有磁性,當外加磁場消失時其磁性也會消失,因此可以很方便的將固定化酶從反應體系中回收重復利用[15]。雖然磁性Fe3O4納米粒子具有純度高,磁性穩定,比表面積大等優點,但作為金屬粒子,在溶液中易與氫離子結合使其表面帶有較強的正電荷,相比其他有機材料更容易團聚,因此對Fe3O4納米粒子表面進行改性,成為制備固定化載體重要的一步[16]。用有機試劑對磁性納米粒子進行改性,不僅可以使其表面擁有特定的活性基團,同時還保留了無機磁性材料的磁響應優點。楊兆壬[17]、談昭君[18]等通過高錳酸鉀氧化得到表面羧基化的磁性Fe3O4載體。李曄[19]、阮貴華[20]等以γ-氨丙基三乙氧基硅烷改性得到氨基化的磁性Fe3O4載體。Fe3O4作為無毒無害的環保材料,在食品加工處理領域具有重要的意義[21-22]。使用Fe3O4磁性納米粒子作為載體進行固定化反應,能實現固定化酶與反應體系的高效分離,提高酶的重復使用率,降低生產成本,有利于實現連續化生產[23]。
1 材料與方法
1.1 材料與試劑
Lecitase? Ultra磷脂酶A1(酶活力5 000 U/mL)丹麥諾維信公司;大豆卵磷脂 上海藍季科技發展有限公司;Fe3O4納米粒子、硅酸乙酯(ethyl silicate,TEOS)、戊二醛(50%) 阿拉丁試劑有限公司;乙醇、氨水、聚乙烯醇(polyvinyl alcohol,PVA)、95%乙醇溶液 展望化工試劑有限公司;3-氨基丙基三乙氧基硅烷(3-aminopropyltriethoxysilane,3-APTES) 上海麥克林生化科技有限公司;其他試劑均為國產分析純。
1.2 儀器與設備
HitachiS-4800場發射掃描電子顯微鏡 日本日立公司;Tecnai G2-T20場發射透射電子顯微鏡 美國FEI公司;Nicolet-8700傅里葉變換紅外光譜儀 美國尼高力儀器公司;MiniFlex-600 X射線衍射儀 日本株式會社理學公司。
1.3 方法
1.3.1 載體的制備
Fe3O4-SiO2磁性復合載體的制備:取2 g Fe3O4納米粒子,加入到含有160 mL乙醇、40 mL水、5 mL氨水的混合液中,超聲處理1 h后,然后將5 mL TEOS緩慢加入到該溶液體系,室溫、350 r/min連續機械攪拌反應12 h。用去離子水將沉淀洗滌數次,然后用0.1 mol/L鹽酸處理沉淀12 h,以去除未包裹上SiO2的Fe3O4納米粒子,將沉淀物在室溫下真空干燥24 h。
3-APTES改性的Fe3O4-SiO2磁性復合載體的制備:在250 mL圓底燒瓶中,加入1 g磁性Fe3O4-SiO2載體,超聲處理1 h,使載體均勻分布在60 mL乙醇中。然后加入6.0 mL NH3·H2O,繼續超聲10 min,隨后向反應液中緩慢加入4.0 mL 3-APTES,在50 ℃持續攪拌反應8 h。反應用永久性磁鐵將載體和溶液分離,并分別用乙醇和水充分洗滌至中性。最后,將3-APTES改性的Fe3O4納米顆粒在常溫下真空干燥24 h,獲得含有氨基官能團的Fe3O4-SiO2磁性復合載體[24-25]。
Fe3O4-SiO2磁性復合載體的交聯:在50 mL錐形瓶中加入2 g改性后的復合載體,加入一定質量分數戊二醛(使用pH 7.0,0.1 mol/L磷酸鹽緩沖液稀釋)進行交聯,室溫下,放置在搖床上以轉速150 r/min,反應12 h。反應完成后,用去離子水將載體反復洗滌,得到交聯復合載體[26-27]。
1.3.2 磷脂酶的固定化
稱取交聯后的Fe3O4-SiO2復合載體50 mg放入錐形瓶中,加入預定量0.02 g/mL磷脂酶A1液(一定pH值的磷酸緩沖液稀釋)。在水浴搖床中,于設定的溫度、150 r/min反應預定的時間。隨后把固定化好的磷脂酶A1用永久性磁鐵分離,用磷酸鹽緩沖液(pH 7.0)反復洗滌直到上清液中檢測不到游離酶為止,固定化磷脂酶置于4 ℃冰箱中保存備用[28-29]。
1.3.3 固定化磷脂酶活力的測定
參照文獻[30]方法。將15.0 mL底物溶液于100.0 mL錐形瓶中,將錐形瓶放置50 ℃氣浴搖床上,預熱8.0 min。加入固定化磷脂酶,在160 r/min、50 ℃條件振蕩下反應10.0 min后,立刻加入10.0 mL的95%乙醇溶液終止反應。用0.1 mol/L NaOH標準液,采用自動電位滴定儀滴定反應后的溶液,通過實驗組和空白組計算NaOH標準液消耗量,測得固定化磷脂酶活力。酶活力回收率和蛋白固載率的計算見公式(1)和(2):

式中:A1為固定化酶總活力/(U/mL);A2為原酶液總活力/(U/mL)。

式中:C1為加入載體中蛋白含量/(mL/mg);C2為殘液中蛋白含量/(mL/mg)。
1.3.4 固定化載體的表征
場發射掃描電子顯微鏡采用電子槍為冷場發射電子源,加速電壓20 kV,分辨率1.4 nm,放大倍數30~80萬倍;透射電子顯微鏡采用的電子槍為LaB6,加速電壓200 kV,線分辨率0.144 nm,點分辨率0.248 nm,放大倍數25~110萬 倍;傅里葉紅外光譜儀掃描區間為4 000~400 cm-1;X射線衍射儀采用的X射線源為Cu靶Kα射線,石墨單色器,管壓力15 kV,管電流30 mA,掃描速率5 °/min,掃描范圍2θ為20°~70°。對樣品的形態結構、粒徑大小、化學組分進行檢測分析。
2 結果與分析
2.1 磷脂酶A1固定化單因素試驗結果
2.1.1 pH值對固定化的影響
在溫度4 0 ℃、戊二醛質量分數4%、加酶量4 mL/50 mg、固定化時間6 h條件下,考察pH值(5.0、6.0、7.0、8.0、9.0)對磷脂酶A1固定化的影響,結果如圖1所示。
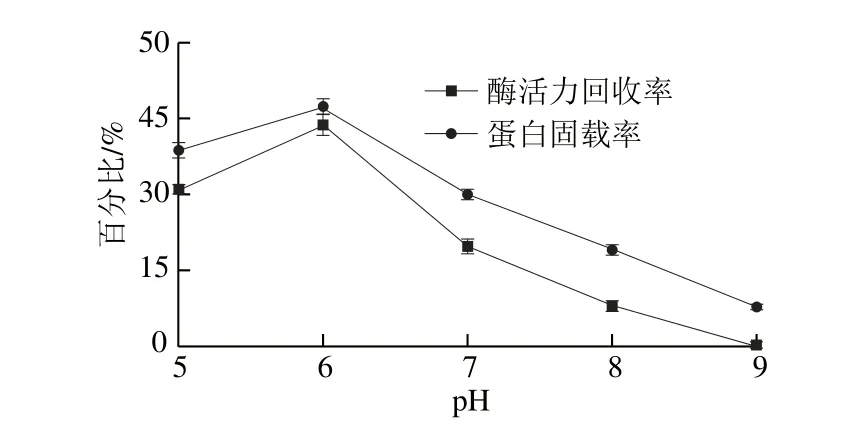
圖1 pH值對磷脂酶A1固定化的影響Fig. 1 Effect of pH on the immobilization of phospholipase A1
由圖1可知,隨著固定化pH值的增加,固定化磷脂酶A1的酶活力回收率和蛋白固載率均先增大后減小。在pH 6.0時回收率和固載率都達到最大,當pH值繼續增加時,回收率和固載率持續降低。其原因是pH值改變能影響酶的活性部位和載體上相關官能團的解離,在一定的解離程度下,適合酶和載體發生固定反應。另一方面,磷脂酶的化學本質是蛋白質,當pH值過低或過高時,蛋白質的次級鍵和空間結構被破壞,從而使酶的生物活性喪失,酶活力降低。
2.1.2 固定化溫度對固定化的影響
在固定化pH 6.0、戊二醛質量分數4%、加酶量4 mL/50 mg、固定化時間6 h的條件下,考察固定化溫度(25、30、35、40、45 ℃)對磷脂酶A1固定化的影響,結果如圖2所示。

圖2 固定化溫度對磷脂酶A1固定化的影響Fig. 2 Effect of temperature on the immobilization of phospholipase A1
由圖2可知,隨著固定化溫度的升高,酶活力回收率增大,當溫度達到30 ℃時,酶活力回收率達到最高,隨著固定化溫度的繼續升高,酶活力回收率反而下降。原因是溫度升高使酶分子活化,碰撞次數增加,酶與載體接觸機會上升,從而有利于固定化反應,當溫度過高時,使酶分子的構象發生變化,影響酶活力。溫度對固載率影響不大,在35 ℃時固載率達到最大。綜合考慮酶活力回收率和蛋白固載率,最后選擇最適固定化溫度為30 ℃。
2.1.3 固定化時間對固定化的影響
在固定化pH 6.0、固定化溫度30 ℃、戊二醛質量分數4%、加酶量4 mL/50 mg的條件下,考察固定化時間(4、8、12、16、20 h)對磷脂酶A1固定化的影響,結果如圖3所示。

圖3 固定化時間對磷脂酶A1固定化的影響Fig. 3 Effect of time on the immobilization of phospholipase A1
由圖3可知,酶活力回收率在初始階段隨著時間的延長而提高,在8 h時達到最高,繼續延長固定化時間,酶活力回收率基本保持不變。原因是在初始階段隨著時間的延長,酶分子不斷固定到載體上,當載體上活性基團連接的酶分子達到飽和后,繼續延長時間,酶分子與載體也不會發生有效的固定化反應,酶活力回收率和蛋白固載率基本保持不變。
2.1.4 戊二醛質量分數對固定化的影響
在固定化pH 6.0、固定化溫度30 ℃、固定化時間8 h、加酶量4 mL/50 mg的條件下,考察戊二醛質量分數(2%、4%、6%、8%、10%)對磷脂酶A1固定化的影響,結果如圖4所示。

圖4 戊二醛質量分數對磷脂酶A1固定化的影響Fig. 4 Effect of glutaraldehyde concentration on the immobilization of phospholipase A1
戊二醛作為常用的交聯劑,本身所具有的醛基能與載體上游離的氨基反應生成亞胺基團(-RC=N-),使載體與載體連接起來,從而增大酶與載體的接觸面積,有利于酶的固定化反應。由圖4可知,酶活力回收率隨戊二醛質量分數的增加,先升高后降低。在戊二醛質量分數小于8%時,磁性載體表面的醛基隨著戊二醛的質量分數增大而變多。當戊二醛質量分數高于8%時,載體表面過度醛基化,使酶與載體交聯過度,空間位阻變大,酶活力位點受限。戊二醛質量分數對蛋白固載率影響較大,隨著戊二醛質量分數增加,載體提供的結合位點增多,與磷脂酶結合的機率增大,更利于酶的固定化,但戊二醛質量分數過高也會使酶喪失部分活力。
2.1.5 加酶量對固定化的影響
在固定化pH 6.0、固定化溫度30 ℃、固定化時間8 h、戊二醛質量分數8%的條件下,考察加酶量(2、4、6、8、10 mL/50 mg)對磷脂酶A1固定化的影響,結果如圖5所示。

圖5 加酶量對磷脂酶A1固定化的影響Fig. 5 Effect of enzyme amount on the immobilization of phospholipase A1
由圖5可知,在加酶量較低時,酶活力回收率隨著加酶量的增加而提高,當加酶量達到8 mL/50 mg載體后,繼續加大酶量,固定化酶的酶活力回收率反而會下降。這是由于一定量的載體可以固定的酶量是一定的,當載體固定化位點達到飽和,再繼續添加酶反而會使酶分子聚集成團,使酶分子之間的活性位點彼此覆蓋,空間位阻增大,對酶活力產生抑制作用。在加酶量達到8 mL/50 mg后蛋白固定率持續降低,使酶的利用率下降。在考慮最適加酶量時應考慮蛋白固載率,避免造成不必要的浪費,而且降低成本對酶的固定化經濟效益有利。
2.2 響應面試驗結果與分析
2.2.1 響應面試驗結果
根據單因素試驗結果,設計響應面試驗,確定最佳固定化條件,每組試驗重復3 次,因素與水平如表1所示。

表1 響應面試驗因素與水平Table 1 Variables and their levels used for response surface design

表2 響應面試驗設計與結果Table 2 Experimental design and results for response surface analysis
響應面試驗設計與結果見表2所示,方差分析結果見表3所示。

表3 回歸模型的方差分析Table 3 Analysis of variance of the regression equation
通過Design-Expert 8.0.6分析,可以得到固定化條件與酶活力回收率之間的二次多項式模型為Y=61.34+5.52A+3.83B+6.14C+2.28D-2.02AB-3.50AC+3.91AD-6.08BC-3.64BD-4.06A2-6.21B2-5.53C2-8.97D2。根據二次多項式,可確定固定化磷脂酶A1的最佳固定化pH 6.67、固定化時間7.92 h、戊二醛質量分數8.34%、加酶量8.24 mL/50 mg[31]。
由表3回歸模型的方差分析可知,R2=0.966 3,說明該模型能較好地反映固定化磷脂酶A1的酶活力回收率隨固定化條件的變化規律,模型的P值小于0.000 1,說明此模型極顯著,失擬項P值為0.238 5大于0.05,說明模型擬合良好,可以接受。校正決定系數j=0.937 4,表明此方程能夠解釋響應值93.74%的變化。AC、AD、BC、BD交互作用對固定化磷脂酶A1的酶活力回收率影響較為顯著,且主次順序為BC>AD>BD>AC[32-33],兩因素交互作用的響應面3D圖和等高線圖見圖6。


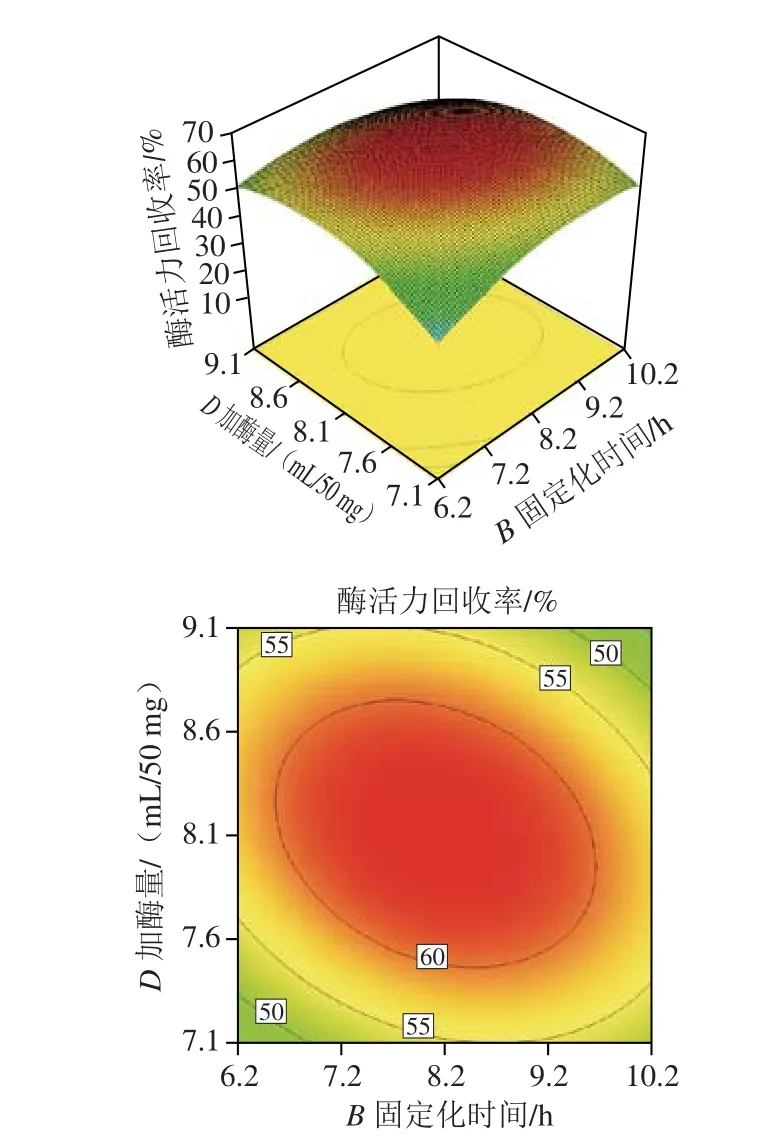
圖6 各因素交互作用對酶活力回收率影響的響應面和等高線Fig. 6 Response surface and contour plots showing the interactive effects of four variables on the recovery of enzymatic activity
2.2.2 驗證實驗結果
根據響應面法獲得的最佳固定化條件,進行3 次平行驗證實驗,根據實驗的可操作性,最終確定的條件為固定化pH 6.7、固定化時間7.9 h、戊二醛質量分數8.3%、加酶量8.2 mL/50 mg。在此條件下固定化加酶量2 mL/50 mg的酶活力回收率為63.6%,蛋白固載率為68%, 落在響應值Y的95%預測區間[56.17%,66.50%]內,說明所建立的回歸模型具有較好的擬合性。
2.3 磁性固定化磷脂酶A1的表征分析
2.3.1 掃描電子顯微鏡分析
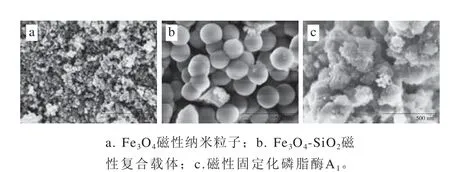
圖7 樣品掃描電子顯微鏡圖Fig. 7 Scanning electron microscope images of samples
由圖7可知,Fe3O4磁性納米粒子基本形貌為球狀,具有良好的分散性,團聚較少,其平均粒徑在15 nm左右。Fe3O4-SiO2磁性復合載體的粒徑較為均一,表面平滑,呈球狀,各載體間分散性良好,載體的平均粒徑為200 nm左右,比表面積大。復合載體平均粒徑大于Fe3O4納米顆粒,表明SiO2成功地包裹在Fe3O4粒子表面,包裹后的Fe3O4-SiO2復合載體表面含有大量的羥基,可通過改性在其表面添加活性基團。磁性固定化磷脂酶A1之間交聯效果良好,同樣具有較好的分散性,有利于固定化酶與底物接觸反應[34]。
2.3.2 透射電子顯微鏡分析
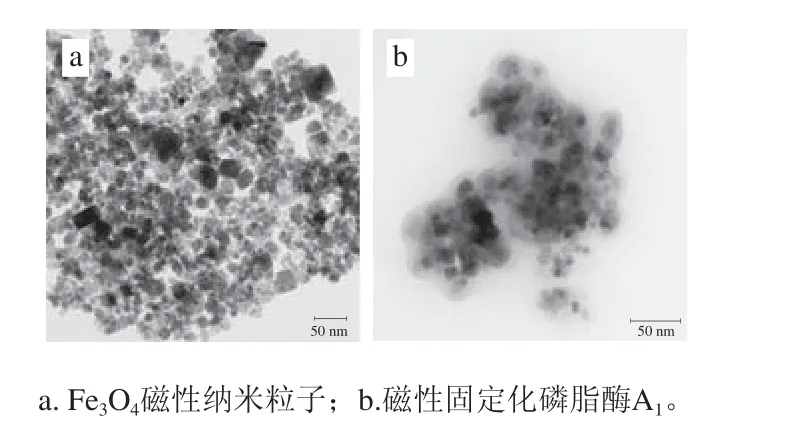
圖8 樣品的透射電子顯微鏡圖Fig. 8 Transmission electron microscope image of samples
從圖8可知,Fe3O4納米顆粒的分散性較好,極少團聚,有利于TEOS均勻地包裹在磁性納米材料表面。磁性固定化磷脂酶A1與Fe3O4納米粒子形態相似,各固定化載體之間均勻分散,呈核殼形,中間黑色的實心為Fe3O4納米顆粒,載體周圍呈現出均勻的灰色薄層,可看出SiO2均勻地包裹在Fe3O4納米顆粒表面[35-36]。
2.3.3 傅里葉變換紅外光譜分析

圖9 樣品的傅里葉變換紅外光譜圖Fig. 9 Fourier transform infrared spectraof samples
在圖9b、c中,1 092 cm-1處較強的吸收峰是Si—O—Si鍵的伸縮振動吸收峰,表明SiO2成功地包裹在載體表面,1 544 cm-1處較弱的峰是酰胺特征吸收峰,說明磷脂酶成功地固定到磁性載體上。1 631 cm-1處較強的吸收峰表明水分子物理吸附到載體表面,3 421 cm-1處是—OH的伸縮振動峰。
2.3.4 X射線衍射分析
在圖10a、b、c中均能觀察到獨立的窄的尖銳衍射峰,說明各樣品純度高,為較好的“晶態”物質。與X射線衍射標準卡片(PDF 19-0629)對照得出,衍射圖譜上的2θ為30.15°、35.47°、43.10°、53.44°、56.99°、62.51°的衍射角分別很好地對應材料中反尖晶石型晶體結構磁性Fe3O4的(220)、(311)、(400)、(422)、(511)、(440)晶面。固定化PLA1的特征衍射峰明顯弱于Fe3O4磁性納米粒子,是因為固定化PLA1中的Fe3O4相對含量較低[37-38]。

2.4 固定化磷脂酶的酶學特性分析
2.4.1 最適溫度和pH值
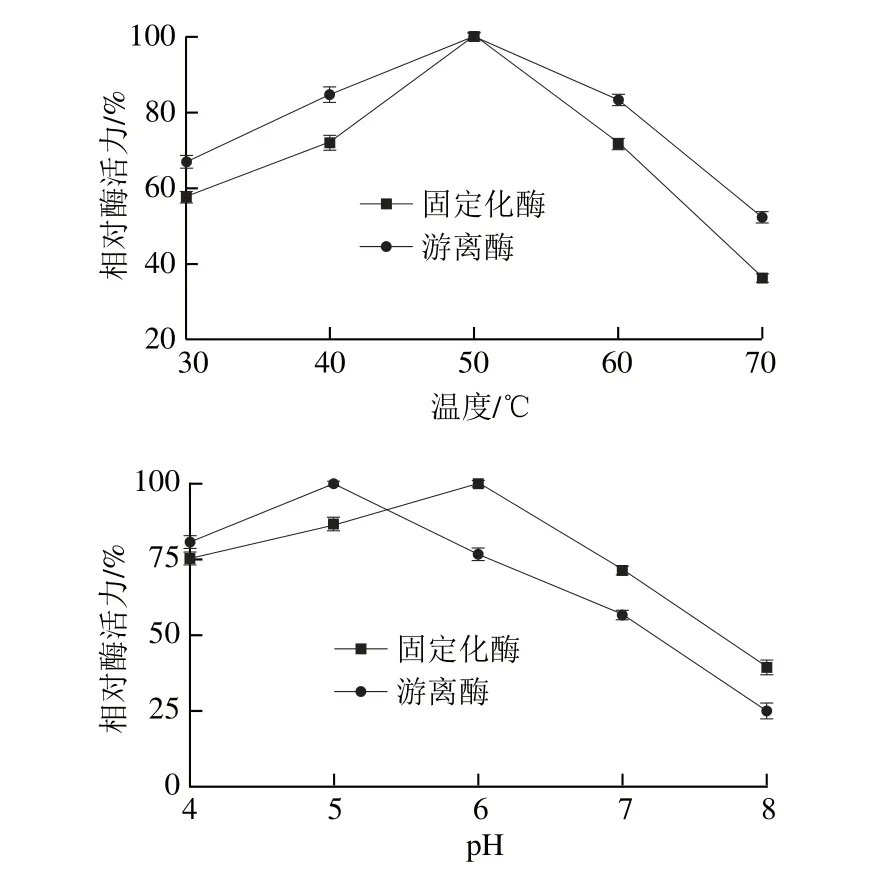
圖11 游離酶和固定化酶的最適溫度和pH值Fig. 11 Optimal temperature and pH for the free and immobilized enzyme
在不同溫度下測定游離酶和固定化酶的酶活力,以酶活力最大的組為100%,其余各組的酶活力與最大酶活力的比值即為相對酶活力。由圖11可知,游離酶和固定化酶的最適反應溫度均為50 ℃,但固定化酶受溫度的影響比游離酶小,在更廣的溫度范圍內可以保持相對較高的酶活力。可能是因為固定化反應使酶的空間結構發生改變,使其對溫度的耐受程度得到提高。游離酶的最適反應pH 5.0,固定化酶的最適反應pH 6.0。相比游離酶固定化酶的最適pH值變大,pH值穩定性更好。可能是固定化使酶的帶電性質改變,或者是固定化載體材料使酶的微觀環境發生變化。
2.4.2 操作穩定性
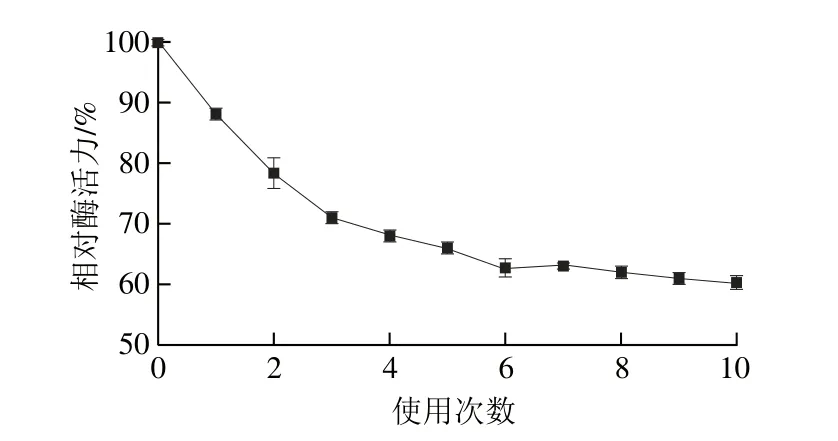
圖12 固定化酶的操作穩定性Fig. 12 Reusability of the immobilized enzyme
固定化酶在50 ℃與底物反應10 min,經過10 次反應后,固定化酶保留61%的初始酶活力。由圖12可知,在前4 次反應中固定化酶活力損失嚴重,可能是由于與載體結合不牢固的那一部分磷脂酶,在反應過程中從載體上脫落,造成酶活力降低幅度較大。

圖13 固定化酶和游離酶的貯藏穩定性Fig. 13 Storage stability of the immobilized and free enzyme
將固定化酶和游離酶貯藏在4 ℃冰箱,每隔5 d定時測酶活力,如圖13所示。固定化酶和游離酶相對酶活力隨貯藏時間的延長,在25 d后,固定化酶相對酶活力保持在83%以上,游離酶在79%左右,相對于游離酶,固定化酶的穩定性得到了改善。
3 結 論
通過響應面試驗,確定Fe3O4納米粒子固定化磷脂酶A1的最優條件:固定化pH 6.7、固定化溫度30 ℃、固定化時間7.9 h、戊二醛質量分數8.3%、加酶量8.2 mL/50 mg,在此最佳條件下制得磁性固定化磷脂酶A1的酶活力回收率能達到63.6%,蛋白固載率為68%。
通過表征分析表明磷脂酶被成功固定到了載體表面。固定化載體分散均勻,粒徑均一,平均粒徑在200 nm左右。固定化酶的最適反應溫度50 ℃,最適pH 6.0,熱穩定性、pH值穩定性和貯藏穩定性均高于游離酶,重復使用固定化酶10 次后,仍保留61%的初始酶活力。
磷脂酶A1具有寬泛的底物專一性,且反應徹底速率快,常被應用于食物油的脫膠處理。本實驗使用價格低廉且無毒害作用的Fe3O4納米粒子作為固定化載體,符合當下倡導的生態文明理念。固定化酶的熱穩定性好,能與產物迅速分離,便于回收重復利用。與其他改性方法相比,使用3-APTES和戊二醛改性得到的載體,表面具有大量的活性基團,能在較為溫和的條件下與酶更好的接觸發生化學反應,所制得的固定化磷脂酶A1不僅酶活力高,而且穩定性好,為食用油酶法脫膠領域的研究和發展提供參考。

