藥物性肝損傷與自身免疫性肝炎
梁慶升 孫穎 鄒正升
近年來隨著對藥物性肝損傷認識的不斷提高和藥品不良反應(Adverse Drug Reaction,ADR)報告系統的日益完善,臨床報道藥物性肝損傷(Drug-induced liver injury,DILI)的病例數逐年增加,目前已知全球范圍內有大約1 100多種上市藥物有潛在的肝毒性[1],且有約20%左右的藥物性肝損傷病例表現為慢性化,病情反復,纏綿難愈,出現類似自身免疫性肝炎表現,如 ANA、SMA、AMA 等自身抗體呈現不同程度的升高,免疫球蛋白升高等。目前對于藥物性肝損傷的發病機制尚不十分明確,研究認為絕大多數藥物性肝損害由免疫反應介導參與其中,與由針對肝細胞的自身免疫反應所介導的自身免疫性肝炎(autoimmune hepatitis,AIH)[2]臨床表現類似,且二者均多見于女性[3],又因自身免疫性肝炎相關的自身抗體檢測特異性差,血清學改變和病理學組織表現相近,而對于可疑藥物性肝損傷的患者更難以確定有何種藥物導致的肝損傷。因此臨床中很難明確對二者進行區分及鑒別。二者有著相似的特點,但治療原則不同,臨床中一旦被誤診,嚴重影響患者的預后。因此如何在初診時給予正確的鑒別診斷和恰當的治療是臨床醫生需要重視的問題。
一、 藥物性肝損傷與自身免疫性肝炎之間的臨床特征交叉
Weiler-Normann和Schramm[4-5]將AIH和DILI的關系分為3類:(1)合并DILI的AIH:即明確診斷的AIH患者同時并發DILI,肝組織學常有纖維化表現。(2)藥物介導的AIH:即患者本身沒有或有輕度的AIH,使用某些藥物誘導后出現或表現明顯而被診斷。(3)免疫介導的DILI:即藥物引發的具有AIH表現(如自身抗體陽性、免疫球蛋白升高、界面性肝炎等)的一類肝損傷疾病,Czaja[6]稱之為伴有自身免疫現象的藥物性肝損傷,并不是真正意義上的AIH。2015年EASL臨床指南提出AIH與DILI之間關系的3種可能:(1)DILI引起強烈的免疫超敏反應,表現類似AIH;(2)AIH患者發病幾周前有用藥史,并且停止用藥后自發緩解,類似于DILI;(3)DILl引發AIH,即藥物誘導的自身免疫性肝炎(DI-AIH)。約有9%~12%AIH患者屬于DI-AIH患者。筆者認為,免疫介導的DILI患者的疾病發作仍依賴于藥物的持續使用,即用藥時疾病的發作具有一定AIH的臨床特征,一旦停用藥物后病情可以自行緩解,仍屬于藥物性肝病范疇,稱之為自身免疫樣藥物性肝損傷更為確切。藥物誘導的AIH診斷往往較困難,因為藥物的使用和疾病發作之間可能相隔較長時間,因果關系較難確定。Bjornsson等[7]報道了24例藥物誘導的AIH病例,其中11例由二甲胺四環素引起,另外11例由呋喃妥英引發,患者在診斷時仍在使用相關藥物,隨后的激素治療效果很好,停藥后無復發。筆者認為,DILI與AIH之間的關系應該分為:(1)合并DILI的AIH:即明確診斷的AIH患者同時并發DILI,肝組織學常有纖維化表現。(2)藥物誘導的AIH:即患者本身沒有或有輕度的AIH,使用某些藥物誘導后出現或表現明顯而被診斷。(3)具有自身免疫現象的DILI:即藥物引發的具有AIH表現(如自身抗體陽性、免疫球蛋白升高、界面性肝炎等)的一類肝損傷疾病。

表1
二、藥物性肝損傷與自身免疫性肝炎之間的區別
(一)起病特點 DILI主要以急性起病,其中6%~20%可發展為慢性。而AIH多起病隱匿,常表現為慢性肝病,約25%的AIH患者表現為急性發作,甚至可進展至急性肝功能衰竭。AIH診斷需要排除用藥史,而DILI恰恰相反,用藥史在診斷DILI中起關鍵性作用。由于DILI患者潛伏期(即藥物治療后發生肝損傷的時間)可能為1~8周,也可延長至12個月[8]。AIH患者亦可有長期用藥史,比如抗結核藥、抗風濕類藥物、化療藥物等,因此要明確藥物和發病的因果關系極為困難。目前通常使用RUCAM量表和臨床診斷標準來評判藥物和肝損傷因果關系。但是由于兩種方法過于復雜,在臨床中廣泛推廣存在一定難度。臨床醫生通過詳盡的病史采集(包括肝功能異常的發生時間、次數,兩次肝功能異常發作之間是否完全恢復正常,藥物包括中藥、營養保健品等使用的療程,肝功能異常與用藥之間的關系等)以及經驗判斷是目前診斷DILI的常用方法[9]。在臨床工作中經常遇到這樣的現象:DILI患者恢復后再次使用相同或相似的藥物可出現AIH樣表現,還有一些病人根據傳統和簡化的AIH診斷積分標準被確診或可能為AIH,但同時又有用藥史,使得明確區分DILI以及AIH變得更為困難。Lucena等[10]從西班牙藥物性肝損中心選取9例兩次出現DILI的患者(9/742),其中8例第二次肝損傷的類型和第一次相同(肝細胞型為主),4例患者兩次肝損傷前后使用藥物的結構相似,2例作用靶點相似。此外,4例患者(4/9)根據傳統和簡化的AIH診斷積分標準被確診或可能為AIH。
(二)發病機制
1、藥物性肝損傷的發病機制
DILI發病機制復雜,往往是多種機制先后或共同作用的結果[3],迄今尚未充分闡明。尤其是特異質藥物性肝損傷的發病機制,是近年來研究的熱點。藥物或其代謝產物與肝細胞特異性蛋白質結合成為抗原,從而激活免疫系統導致肝損傷,特異性肝損傷發病機制具有不可預測性,目前認為特異質肝損傷是由相關代謝酶缺失、活性低及免疫應答異常所導致[11]。研究認為藥物或者藥物的活性代謝產物作為半抗原與肝細胞內特異性蛋白質發生結合形成抗原,通過主要組織相容性復合體(major histocompatibility complex,MHC)II 表達于細胞表面后,被CD4+T細胞識別,刺激產生細胞因子,激活體內效應細胞CD8+T 細胞,釋放大量的炎癥介質或者直接與抗原提呈細胞結合,通過MHC I 激活特異性細胞毒性T細胞導致肝損傷。在前一次服用藥物時機體獲得免疫,再次服用時發生快速的肝臟損傷[12]。還有研究發現當發生藥物性肝損害時,通過肝細胞內模式識別受體(PRR) 去識別病原體相關模式分子(PAMP)的機構發揮免疫效應,其中還有白細胞介素、腫瘤壞死因子(TNF)、趨化因子等細胞因子的參與[13]。高遷移率族蛋白(high mobility group protein box,HMGB)1 是一種損傷相關分子模式(damage associated molecular pattern,PAMP),可誘導炎性細胞的浸潤,而HMGB可與Toll樣受體結合,促進炎癥介質的釋放而加重肝損傷[14]。還有研究發現[15],肝細胞膜上存在一種有機陰離子轉運蛋白(Organic anion transporting polypeptides,OATPS),而0ATP1B1 屬于OATPS 家族的一種亞型,其表達差異性與藥物性肝損傷密切相關。
線粒體損傷常被認為與DILI有關[16]。線粒體提供大部分細胞所需要的ATP,維持著肝細胞內環境的平衡。藥物及其代謝產物可導致線粒體通透性轉換(hypochondria impeccability transition,MPT) 的發生,最后,MPT的發生耗竭了線粒體ATP 的產生,導致肝細胞壞死[17]。
信號轉導與細胞死亡機制是最近研究的熱點。肝細胞死亡存在多條途徑,目前已發現細胞因子TNF-α、ASL 和INF-γ可增加肝細胞的敏感性,在炎癥反應中與細胞內的死亡受體結合激活Caspase8,被稱為死亡誘導信號復合物(death-inducing signaling complex,DISC),加速了肝細胞的死亡。還有As-ASL途徑、c-Jun激酶(JNK)信號通路等的激活,最終均可導致肝細胞的壞死[17]。
2、自身免疫性肝炎的發病機制
自身免疫性肝炎是一組由免疫介導的慢性復發性肝炎,其確切病因及發病機制仍未完全闡明。目前遺傳易感性已被公認與AIH發病相關,但至今仍未找到直接證據解釋它們之間的具體聯系。分子模擬機制已被提出多年,但因AIH患者特異性自身抗體尚未完全闡明,因此其分子模擬機制仍需更深入的研究。現已明確免疫調節紊亂是肝細胞損傷的關鍵因素,包括調節性T細胞(regulaturyTcell,Tregs)、CD4+CD25+Tregs、Toll樣受體(Toll like receptors,TLRs)激活、Th17細胞/Treg細胞平衡、NKT細胞等,因免疫反應牽涉甚廣,要闡明其確切機制仍非常困難。近年來,表位擴展被認為與AIH病情進展、遷延難愈相關,但目前相關研究較少,其具體機制仍不明確[18]。
由此可見,DILI和AIH的發生機制復雜,但免疫介導反應在二者發病機制中均有參與,可能與兩者臨床表現類似有關。
3、組織學表現
臨床上,肝組織病理學是診斷慢性肝病的重要標準之一。雖然目前僅僅依靠組織病理學證據尚不能確定AIH或DILI,但在鑒別這兩種疾病中的價值越來越受到關注和重視。因此,2015年歐洲肝病學會AIH指南提出,在AIH治療前,除非有禁忌證,均應進行肝組織學檢查[19]。
DILI和AIH在組織學上有一定相似之處,包括界面性肝炎,門管區漿細胞、淋巴細胞和嗜酸性粒細胞浸潤及小葉中央3區的壞死[7]。Suzuki等[20]報道在肝組織學上兩者仍存在差異。他們將臨床明確診斷的35例DILI(19例肝細胞型、16例膽管型或混合型)及28例AIH根據Ishak評分、門管區和小葉內炎癥細胞的類型、是否存在穿入現象、玫瑰花環及膽汁淤積等指標進行評分,結果顯示界面性肝炎、局灶壞死及門管區炎癥兩者均可出現,但AIH較DILI更為嚴重。匯管區中性粒細胞的浸潤及肝內膽汁淤積多見于DILI,而漿細胞浸潤、玫瑰花環、穿入現象以及肝細胞腫脹和(或)固縮凋亡則為AIH特有的組織學表現。Ju等[21]發現一些DILI的組織學特征,如單核細胞和嗜酸性細胞浸潤、匯管區擴張、中央帶膽汁淤積和局灶性壞死,但均無特異性。此外,與AIH相比,具有自身免疫現象的DILI中沒有明顯的肝纖維化改變[22]。因此肝穿刺活檢病理學特征在DILI和AIH都重疊現象,但在兩者均有側重,肝穿刺活檢是區分兩者的重要診斷工具。
4、新型標志物
近年來,一些研究報道了可能有助于鑒別AIH和DILI的新型標志物[23]。有研究發現miR-122、miR-192 與肝損傷的發生密切相關。其中miR-122 是一種具有較高肝臟特異性的miRNA, 其在肝臟中的分布豐度約占體內總含量的70%,同時有研究結果表明在miR-122、miR-192適用于檢測對乙酰氨基酚肝損傷, 并且miR-122 在檢測靈敏性和特異性上更加優于ALT。有一些動物實驗研究發現α-谷胱甘肽巰基轉移酶 (α-GSTA)、精氨酸酶1 (ARG1)、4-羥基苯丙酮酸雙加氧酶 (HDP) 用以監測DILI 具有比ALT更高的特異性和靈敏性[24]。線粒體作為肝細胞代謝及細胞活力的主要細胞器,其受損是DILI發生發展的主要原因。線粒體受損的標志物包括谷氨酸脫氫酶(GLDH)、線粒體DNA(mtDNA)以及降解的DNA片段等可作為DILI的診斷指標。細胞凋亡指標角蛋白K18[Keratin-18(cc)]和細胞壞死指標Keratin-18(FL),也可作為DILI的診斷指標。高遷移率族蛋白1(HMGB1)是一種重要的晚期炎癥介質,可作為DILI主要的免疫損傷指標,對于DILI嚴重程度和預后的判斷有重要價值[25]。盡管目前發現了多個DILI生物標志物,但基本都處于實驗室研究階段,而且這類分子所具有的潛在臨床價值是否具有普適性還是僅適用于某種特定的肝毒性藥物等方面仍不明確, 還需開展更加深入的研究。
5、治療及預后
DILI治療原則為停用相關可疑藥物、促進體內藥物代謝并且監測病情的變化。一般而言,經適當治療后大多數DILI在1~3個月內肝功能逐漸恢復。病情嚴重或者因免疫特征明顯與AIH無法鑒別時可使用激素。AIH的治療原則為所有活動性AIH患者均應接受免疫抑制治療,并可根據疾病活動度調整治療方案和藥物劑量。急性甚至重癥、中度以上炎癥活動的AIH患者,應及時啟動免疫抑制治療,療程一般應維持3年以上,或獲得生化緩解后至少2年以上。而DILI使用免疫抑制治療的療程相對較短,通常療程為1~6 個月,直至肝功能持續正常。目前認為,糖皮質激素對AIH伴DILI、DIAIH和具有自身免疫現象的DILI均有較好的療效。Bjornsson等[7]對24例免疫相關的DILI(主要由二甲胺四環素或呋喃妥英引起)與AIH的研究結果顯示,激素對兩者均有緩解作用,區別在于前者在停藥后平均隨訪3年無復發,而后者的復發率為65%。激素治療可作為鑒別兩者的方法之一,與AIH相比,DILI患者激素的初始用量小,起效速度快,而且停藥后AIH患者復發率明顯高于DILI患者,在回顧性分析中,大約60%的AIH患者在完全退出免疫抑制治療后1年需要重新引入免疫抑制,在3年后增加到80%[3]。對于臨床中難以明確區分的AIH和DILI的患者可以使用糖皮質激素進行診斷性治療,2015年歐洲肝病學會臨床指南提出了一套關于臨床疑似AIH或DILI患者的診治流程如下(圖1):
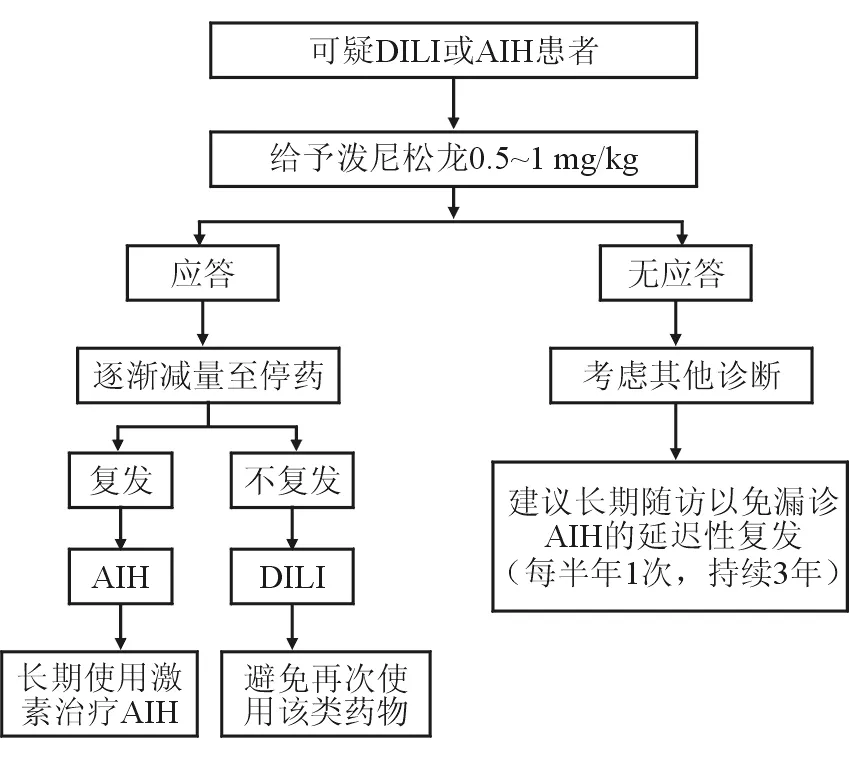
圖1
由此可見,DILI與AIH二者之間在發病機制、臨床特點和實驗室檢查中有很多相似之處,且它們的關系錯綜復雜,兩者的治療原則及預后情況存在差異,因此,臨床中對于兩者的鑒別診斷極為重要。