竹炭對抗生素制藥廠水處理污泥中青霉素降解的作用機制研究
劉浩然,周 俊,鄭子荷,古祺鵬,李 豪,張 園
(蘇州科技大學 環境科學與工程學院,江蘇 蘇州 215009)
1 引言
制藥污泥成分復雜、含有大量水分以及難降解的有機物,如今制藥污泥已被列入《國家危險廢物名錄》。一般的污泥處理方法有直接填埋、海洋傾倒等,這些處理方法不僅存在能源浪費的問題,而且如果處置不當可能會對生態環境造成二次污染同時危及人類健康[1]。
青霉素是日常生活中不可缺少的藥品,而制藥污泥中含有的青霉素有90%無法被人體或動物吸收,最終以原藥的形式排放到環境中。青霉素具有水溶性,可以較為方便的借助各種環境介質在土壤和水體之中擴散,最終導致面源污染并對土壤和地下水造成威脅[2]。青霉素降解的方式有很多種,生物降解是最常見的降解方式[3],本實驗采用的高溫好氧堆肥為青霉素的降解提供了合適的條件,這是對制藥污泥的最佳處理手段之一,可以使處理之后的污泥土質疏松、臭味消除以及有害物質含量大幅度下降。經過堆肥之后的污泥還可以作為肥料,提高農作物品質[4]。
竹炭是竹材料熱解之后產生的多孔性物質,具有較強的吸附性,比表面積可達300 m2/g以上,是一種新型吸附材料[5],對各種污染物質具有較強的吸附能力和促進降解能力[6]。
2 實驗材料和儀器
2.1 實驗材料
3000 g取自蘇州二葉制藥廠并經過風干處理的活性污泥、3種不同類型的碳源(玉米秸稈、蔗糖、葡萄糖)各300 g、充足數量的竹炭粉末(顆粒度:0.074 mm)、200 g木屑(用于調節通風)、甲醇、乙腈、二氯甲烷、鹽酸、Na2EDTA- McIlvaine緩沖液(需配置,包括Na2EDTA水溶液、檸檬酸固體、NaH2PO4·2H2O固體)。
2.2 實驗儀器
恒溫水浴鍋、大體積錐形瓶、BS224S型電子天平、鼓風機、尾氣吸收裝置(包括酸洗瓶和堿洗瓶)、PHS-3E型pH計、WGL-230B型電熱鼓風干燥箱、馬弗爐、抽濾機、TOC測定儀、震蕩儀、TGL-16M離心機、SB25-12DTDN超聲波清洗機、SAX-HLB串聯萃取小柱、氮吹儀。具體實驗裝置如圖1所示。
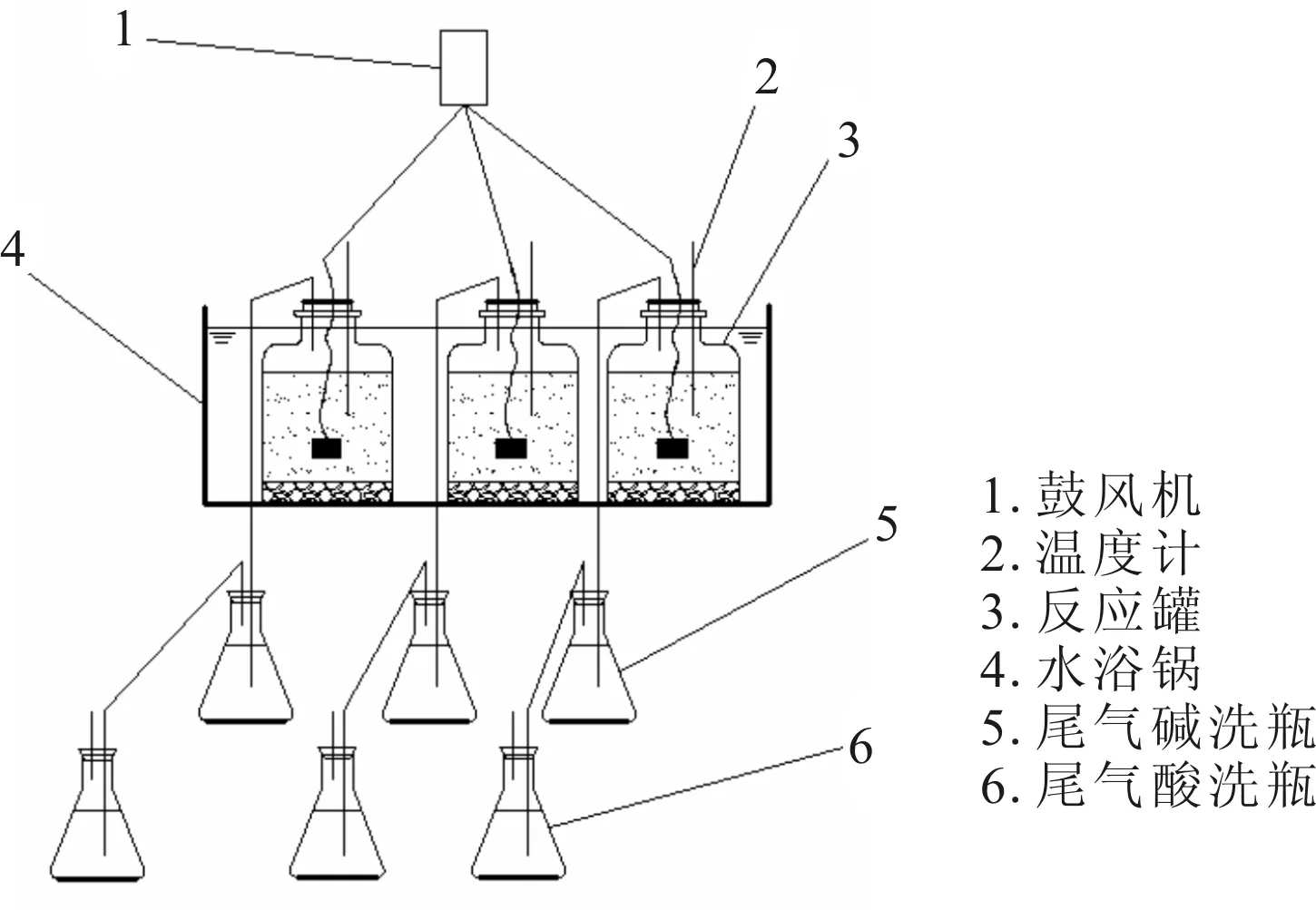
圖1 實驗裝置
3 實驗方法
3.1 實驗組與對照組的確定
為體現竹炭對青霉素降解的促進作用,本實驗設置一個實驗組(編號為CK1T),該組添加竹炭和木屑,木屑用于通風。依據向秋杰等的先期研究[7],設置一個對照組(編號為CK2T),除木屑之外不投加任何物質。
為體現竹炭在添加不同碳源情況下都可以起到對抗生素的降解作用,本實驗設三個實驗組,分別投加等量的玉米秸稈(多糖)、蔗糖(二糖)和葡萄糖(單糖),編號分別為T-1、T-2、T-3,實驗組中均投加木屑促進通風。設置兩個對照組,第一個對照組(編號為CK1T)中除竹炭和木屑外不投加任何其余碳源;第二個對照組(編號為CK2T)除木屑之外不投加任何物質,以作為空白對照組。
高溫好氧堆肥過程對溫度有一定的要求,堆肥期間應連續10 d維持溫度在55 ℃以上。
該堆肥過程持續60 d,在溫室中進行。采用水浴加熱的方式控制堆肥溫度。每日9:00和17:00測量溫度,確保溫度滿足實驗要求[7]。采取持續鼓風機供氣通風+每日人工翻堆的方式確保通風[6]。分別在第1、3、5、7、15、30、60 d取樣。每次取樣50 g。
3.2 樣品基本量和青霉素含量的測定
根據張強等的研究[8],在實驗中選取以下基本理化性質指標對樣品進行測定,并測定堆肥各階段青霉素的含量和用堆肥后污泥培養的綠豆種子發芽率及根長。
3.2.1 pH值
稱取樣品5 g置于25 mL燒杯中,加蒸餾水15 mL,靜置30 min后,用pH計測其pH值。
3.2.2 含水率ω
在高溫好氧堆肥過程中,堆肥的含水率需要控制在60%左右(65%最佳)此時堆肥中的微生物可以較好地繁殖,并完成對堆肥中有機物的消耗和抗生素的降解。
精確稱取2 g樣品放入坩堝之中,使用WGL-230B型電熱鼓風干燥箱在105 ℃下烘烤8 h后取出稱重。根據含水率的不同計算堆肥過程中的加水量,從而調節含水率在60%[9]。
3.2.3 有機質含量
將測完含水率的樣品放入馬弗爐中灼燒8 h,取出樣品準確稱量,計算得出有機質的變化情況。
3.2.4 測量DOC(可溶性有機碳)含量
精確稱取樣品置于離心管中,并加入蒸餾水,放入震蕩儀震蕩后使用TGL-16M離心機高速離心,對上層清液進行抽濾,獲取不少于的液體后,測量其DOC含量[10]。
3.2.5 綠豆種子發芽率及根長的測定
選取普通綠豆種子,分為五組,每組對應3個實驗組和2個對照組。每組的種子中有1/2種子作為對照。將不同組別種子對應放于DOC測定所需提取液中,對照種子置于等量蒸餾水中,恒溫培養并測量其發芽率及其根長,進而判斷堆肥后產物是否適合種子的發芽并是否對發芽存在促進作用[11]。
3.2.6 抗生素含量的測定
依照范維等[12]的測量方法,配置緩沖液和提取液并活化SAX-HLB串聯柱子后使用LC-MS/MS(液相色譜-串聯質譜)法測定每一次取樣樣品中青霉素的含量。
4 實驗結果分析
4.1 基本理化指標
4.1.1 pH值
由圖2分析得出,在堆肥初始階段,T-1,T-2,T-3和CK1T,CK2T的pH值在4~8之間波動,隨著時間的推移,該數值逐漸趨于穩定,其值在6~7左右,即呈現為弱酸性或中性。
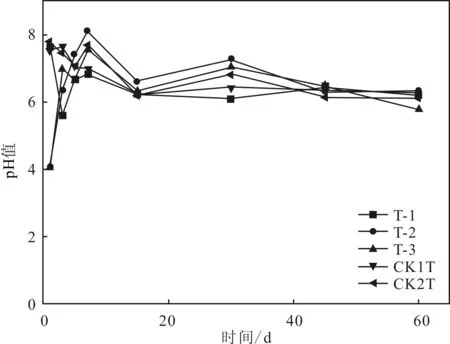
圖2 pH值數據變化
由圖2并根據王月香等的研究[13],在堆肥前期,土壤中微生物活動較為頻繁,有酸性或者堿性物質產生;反應后期,隨著土壤中抗生素的降解和其余有機物質的消耗,微生物活性減弱,生化反應減緩。各個組的pH值變化幅度相似,說明pH值的變化只能表征堆肥過程各階段的演變。
4.1.2 有機質含量
由圖3中分析得出,T-1,T-2,T-3和CK1T的有機質含量從70%~90%下降到30%~45%,并最終在30d以后逐漸趨于平穩;而對照組CK2T由于本身未投加任何碳源,因此其有機質含量較少,在整個實驗過程期間維持在30%左右。

圖3 有機質含量變化
在堆肥前期,土壤中微生物活動頻繁,大量有機物被降解和吸收,所以有機質含量的下降速率較快,而反應后期,微生物活動減弱,由于土壤中可能含有微生物尸體和植物殘留,所以不同組的土壤中有機質含量不同,但變化趨勢最終都趨于穩定[14]。
4.1.3 DOC含量
由圖4中分析得出,T-2和T-3的DOC含量從120 g/kg下降到30 g/kg,而其余組變化趨勢較小,并最終在30 d以后逐漸趨于平穩。
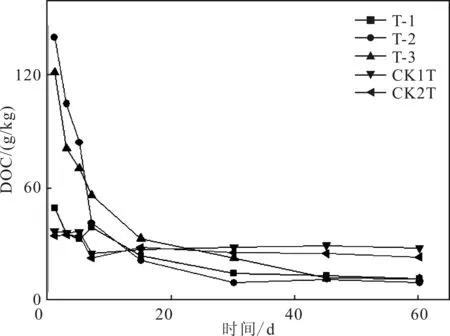
圖4 DOC含量變化
可溶性有機碳(DOC)會和土壤中的有機質形成動態平衡。DOC含量變化和有機質含量變化趨勢相同,可以相互證明并最終表征土壤中有機質的變化。由于土壤初始時所含有的有機物不同,所以各組的DOC初始含量不同,并最終趨于平衡[15]。
4.2 綠豆種子根長
由圖5分析可知,各組培養的綠豆種子發芽率分別為:T-1(95%),T-2(90%),T-3(100%),CK1T(90%)和CK2T(100%),而只加入清水的控制對照組(Control Group)為90%,所有組的種子發芽率都大于或等于控制對照組。
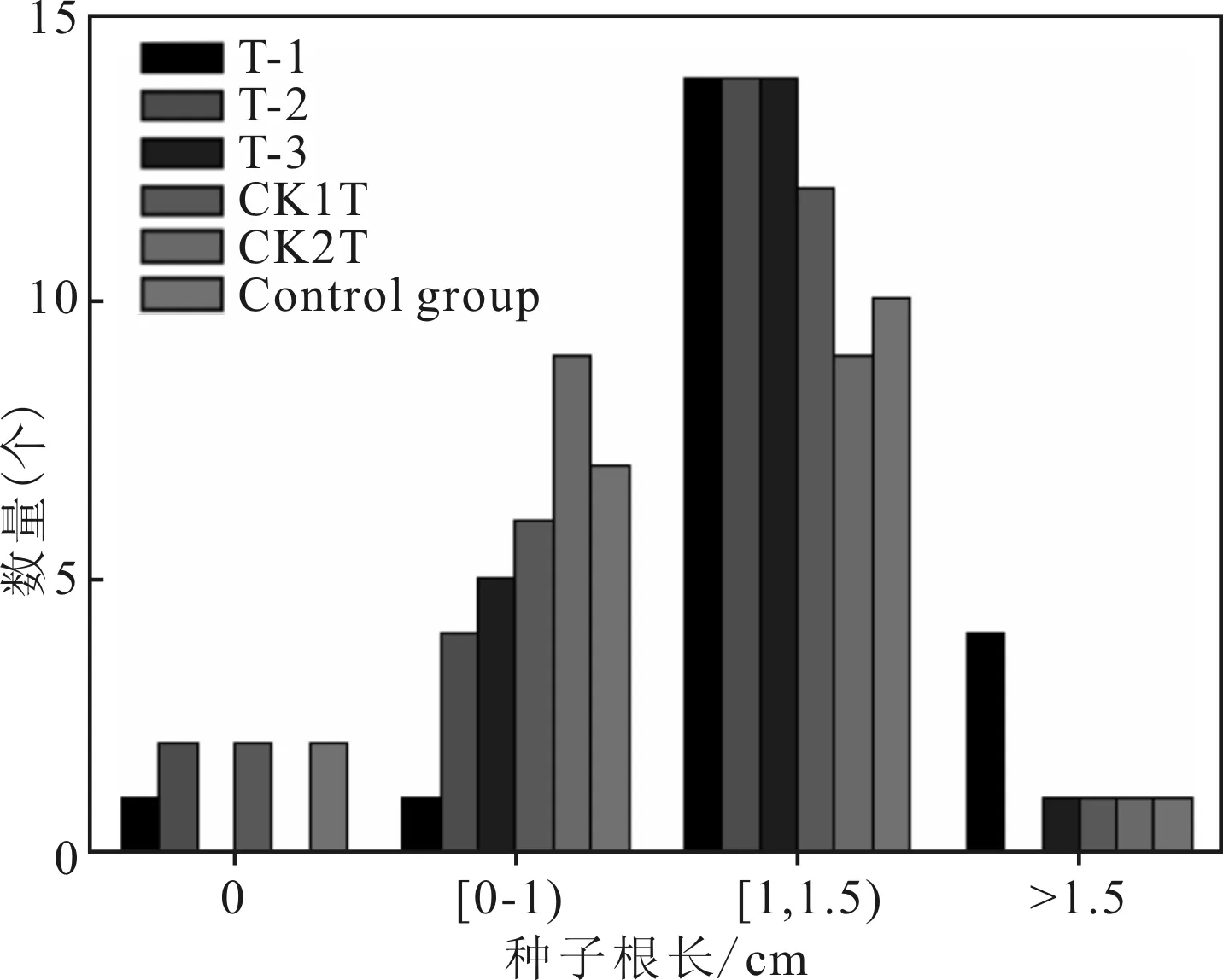
圖5 綠豆種子根長統計
各組綠豆種子根長大于1 cm的比例分別為:T-1(90%),T-2(70%),T-3(75%),CK1T(65%)和CK2T(50%),而只加入清水的控制對照組(Control Group)為55%,除CK2T外所有組的種子根長大于1 cm的比例都大于控制對照組。
綠豆種子的發芽率和根長可以表征添加竹炭和不同碳源的污泥經高溫好氧堆肥處理后對綠豆種子生長的安全性和營養效果[16,17]。
4.3 抗生素降解的測定
由圖6的分析可得,在30 d左右,T-1,T-2和T-3的青霉素含量已經下降到0.561、0和0.313 μg/kg,趨近于無或已經完全降解。而CK1T和CK2T相對應的青霉素含量為2.596和3.331 μg/kg,即依然存在一定數量的青霉素,并且到45d后,CK2T依然有0.03 μg/kg的青霉素存在。
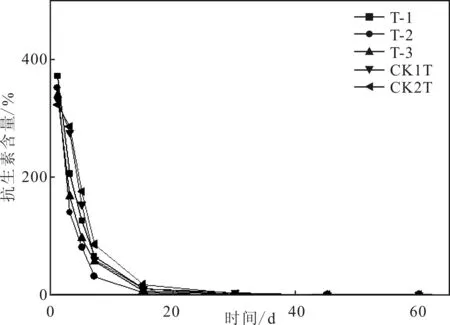
圖6 青霉素含量
根據沈怡雯等的研究[18],堆肥中抗生素的降解和微生物的活動有關。本研究做出的青霉素含量圖和DOC含量圖以及有機質含量圖中曲線變化趨勢相似,可以證明青霉素先隨微生物的頻繁活動而快速降解,10 d后,微生物活動減弱,青霉素降解速度隨之減慢,30 d內基本降解,60 d內全部降解。
在30 d內,污泥中的青霉素降解速率(99.20%)比不添加任何物質的污泥中青霉素降解速率(98.97%)更高。若碳源為蔗糖,高溫好氧堆肥處理30 d后制藥廠污泥中青霉素的降解速率(100%)會優于不添加碳源時的降解速率(99.2%)、碳源為葡萄糖時的降解速率(99.8%)和碳源為玉米秸稈時的降解速率(99.9%)。
5 實驗結論
(1)竹炭對制藥廠污泥中青霉素的降解有促進作用。對加入竹炭和不加入竹炭的高溫好氧堆肥中青霉素含量進行測定后發現,加入竹炭的污泥經過高溫好氧堆肥處理30 d后,污泥中的青霉素降解速率(99.20%)比不添加任何物質的污泥中青霉素降解速率(98.97%)更高,并且在開始堆肥的45 d后,前者中青霉素已經完全降解,但是后者仍然存在0.03 μg/kg青霉素。
(2)加入竹炭并經過高溫好氧堆肥處理后的制藥廠污泥對綠豆種子的發芽并無影響,且對種子的生長具有促進作用。當以單糖作為碳源時,污泥培養后綠豆種子發芽并且根長大于1 cm的比例(90%)大于以多糖作為碳源(75%)、以二糖作為碳源(70%)和只加入竹炭(65%)時,且都大于加入清水培養(55%)和不添加竹炭(50%)時。
(3)當碳源為二糖時,投加竹炭后制藥廠污泥中的青霉素降解效果會好于碳源為多糖、碳源為單糖或不添加任何碳源時。對加入不同碳源后的高溫好氧堆肥中青霉素的含量進行測定后發現,若碳源為二糖,高溫好氧堆肥處理30 d后制藥廠污泥中青霉素的降解速率(100%)會優于碳源為多糖時的降解速率(99.9%)和碳源為單糖時的降解速率(99.8%)以及不添加碳源時的降解速率(99.2%)。

