兔包皮來源的上皮細胞與人來源脫細胞羊膜基質(HAAM)組織工程共同培養細胞層片的體外研究
謝雪鋒 陳 剛 吳復躍 侯劍剛
(1復旦大學附屬金山醫院泌尿外科 上海 201508; 2上海睿泰再生醫學臨床應用研究院 上海 200040;3復旦大學附屬華山醫院泌尿外科 上海 200040)
尿道狹窄是泌尿外科臨床較為常見的一類疾病,手術的治療效果不甚理想,尤其是長段尿道狹窄。同時先天性尿道下裂、長段、超長段的尿道狹窄、閉鎖等畸形或創傷疾病都存在尿道缺損,需要再造尿道,這也是醫學界的治療難題[1]。自體組織替代技術雖然廣泛應用,但需要患者付出巨大手術創傷代價,仍深受質疑。最明顯的不足之處在于需要額外手術來獲得移植材料,住院時間延長;取材部位可能會產生疼痛、感染等一系列并發癥;取材有限,患者不可避免受到二次創傷[2]。
我們的前期研究提示小塊兔尿道黏膜和包皮組織利用組織工程學進行擴增培養,能得到適用于長段尿道狹窄替代手術的片狀細胞層片,尤其是包皮組織來源的片狀細胞層生長快,具備一定的厚度、長度和張力[3],為進一步研究組織工程尿道提供了實驗基礎。考慮到細胞層片在手術過程和之后的修復過程中容易破裂等因素,本研究在此基礎上探討包皮來源的上皮細胞與人來源脫細胞羊膜基質(human acellular amniotic membrane matrix,HAAM)共同培養形成細胞層片的效果,為臨床尿道重建尋找理想的修復替代材料。
材 料 和 方 法
試劑和儀器 MCDB153培養基、FBS (美國Sigma公司);青霉素/鏈霉素溶液、CellTrackerTMCM-Dil(美國Thermofisher公司);胰蛋白酶EDTA溶液、Dulbecco磷酸鹽緩沖液(DPBS,上海源培生物科技股份有限公司);細胞培養皿、培養瓶、細胞刮棒(美國CORNING公司)。倒置相差顯微鏡(日本OLYMPUS公司);高速離心機、CO2恒溫培養箱,生物安全柜(美國Thermofisher公司)。
羊膜支架制備 羊膜的選材嚴格遵循供體醫學標準,取材獲取患者知情同意。在獲取健康剖腹產胎膜后,DPBS反復沖洗,鈍性分離羊膜與絨毛膜組織,去除羊膜基底面殘存的絨毛膜和血管組織。實驗組用胰蛋白酶EDTA溶液消化新鮮羊膜上皮層的細胞,振蕩、清洗制成HAAM,甘油保存,以鈷60-γ射線照射滅菌(36 kGy)后備用。對照組將新鮮羊膜上皮面向上貼附在圓形細胞培養皿上,用細胞刮除器刮除羊膜上皮細胞,最后用DPBS清洗后備用(圖1)。
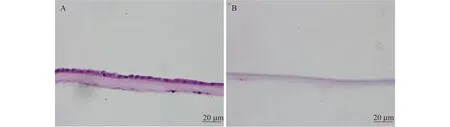
A:General amniotic membrane;B:Acellular amniotic membrane.Hematoxylin-eosin staining ×20.
圖1 人未脫細胞羊膜和脫細胞羊膜的組織形態學
Fig 1 Morphology of human general amniotic membrane and human acellular amniotic membrane
種子細胞制備 將冷凍保存的兔包皮細胞復蘇,培養。用CellTrackerTMCM-Dil標記(37 ℃孵育5 min后,4 ℃孵育15 min)包皮細胞,生長至70%融合的包皮細胞以DPBS清洗2遍,加0.25%胰蛋白酶和0.1%EDTA的混合酶液,充分振蕩消化10 min后加入終止液,然后吸入離心管中,400×g離心5 min,去除上清液,留取細胞備用。
包皮細胞接種到羊膜上 將實驗組和對照組羊膜上皮面向上貼附在圓形細胞培養皿上,用克隆環壓在羊膜上,將標記的包皮細胞按1×105/cm2的密度分別接種于實驗組和對照組羊膜上,置于CO2恒溫培養箱中,每2天換液1次,4天后吸去培養液,用DPBS洗滌去除非黏附細胞,然后將羊膜經甲醛固定、封片,行HE染色。然后通過組織學觀察上皮細胞及其在兩種基質上的黏附及生長情況。
拉伸強度檢測 羊膜、HAAM、單純細胞層片、羊膜+細胞層片及HAAM+細胞層片共5組進行拉力試驗。將樣本裁為20 mm×50 mm 大小,使用拉力機(FR-108C,上海發瑞儀器科技有限公司)進行樣本拉伸檢測,測試速度為10 mm/min,記錄樣本斷裂的最大力及拉伸強度。
結 果
包皮細胞在兩種羊膜基質上均能正常生長,且兩種基質所構建的上皮組織學結構相似。細胞呈單層生長,成熟上皮予以均勻覆蓋羊膜基質表面,活細胞示蹤劑顯示細胞生長良好。共同培養4天后,倒置相差顯微鏡顯示,HAAM上和非羊膜部分的細胞生長良好;熒光顯微鏡顯示,生長在脫細胞羊膜的包皮細胞貼附良好,排列規則,形態規整,存活更多,更有優勢(圖2~4)。HAAM作為基質與上皮細胞共同培養的細胞層片,力學強度優于單純的細胞層片(表1)。

A:Control group;B:Experimental group.By inverted phase contrast microscope×100.
圖2 光鏡下兩組羊膜支架上的包皮上皮細胞
Fig 2 Foreskin-derived epithelial cells seeded on two groups of amniotic membrane scaffolds under microscope

A:Control group;B:Experimental group.By fluorescence microscope×100.
圖3 60 mm培養皿中CM-oil熒光標記的兩組羊膜支架上的包皮上皮細胞
Fig 3 Foreskin-derived epithelial cells labled by CM-oil on two groups of amniotic membrane scaffolds in 60 mm dish (×100)
討 論
尿道下裂和不同原因引起的尿道狹窄閉鎖是泌尿外科常見疾病,由于缺乏理想的尿道修復替代材料,療效往往不佳,尤其是針對超過3 cm 的長段尿道狹窄往往采用自身組織進行替代修補,而無論應用哪種手術方式,術后并發癥均嚴重影響治療效果[4]。處理長段尿道狹窄所面臨的主要問題就是尋找理想的修復替代材料[5]。組織工程技術發展為尿道修復帶來了新希望:將種子細胞在體外種植于天然的或人工合成的細胞外基質上,經過一段時間培養后,將他們移植到體內,與自身尿道及周圍組織融合,以達到對受損尿道修復和重建的目的[6-7],其核心內容是建立由細胞和生物材料構成的三維結構和空間構象。我們的前期研究提示,利用組織工程學進行擴增培養尿道黏膜和包皮細胞,能獲得較大面積的細胞層片,可以適用于長段尿道狹窄替代手術[3]。包皮來源的片狀細胞層生長快,且具備一定的厚度、長度和張力[3],為進一步研究組織工程尿道層片提供了實驗基礎。但我們的后期研究提示,該細胞層片在動物實驗中缺乏足夠的機械強度和厚度,修復結果不甚理想。因此我們期望通過一種支架材料來增強該細胞層片的強度、厚度和生長時間,為臨床提供更好的研究基礎。
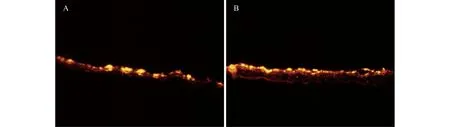
A:Control group;B:Experimental group.Frozen section×100.
圖4 凍切片中熒光標記的兩組羊膜支架上的包皮上皮細胞
Fig 4 Forskin-derived epithelial cells labled by CM-oil on two groups of amniotic membrane scaffolds in frozen section
表1 各組材料力學檢測
Tab 1 Mechanics testing of different materials groups
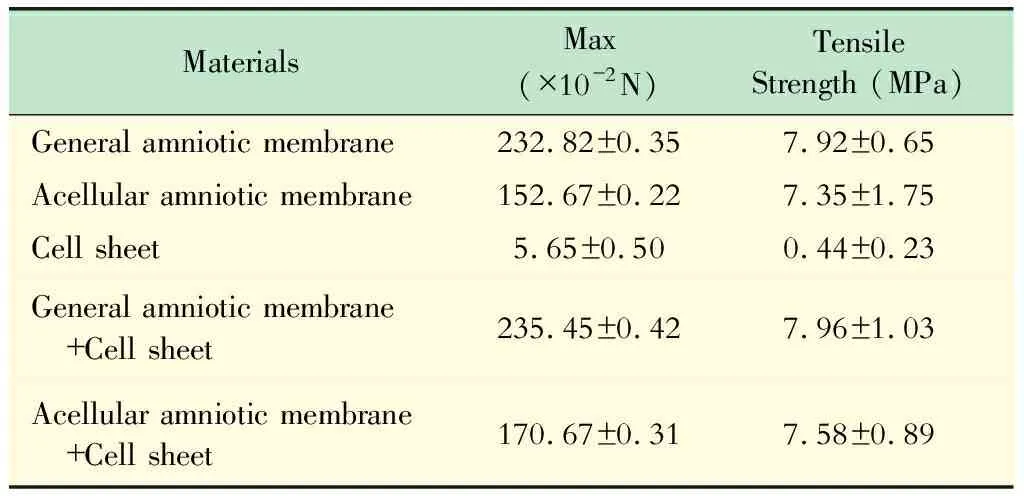
MaterialsMax(×10-2N)Tensile Strength (MPa)General amniotic membrane232.82±0.357.92±0.65Acellular amniotic membrane152.67±0.227.35±1.75Cell sheet5.65±0.500.44±0.23General amniotic membrane +Cell sheet235.45±0.427.96±1.03Acellular amniotic membrane +Cell sheet170.67±0.317.58±0.89
相關文獻認為HAAM是通過生物化學方法,去除組織中的羊膜上皮細胞和抗原成分,保留細胞羊膜基底膜與致密層組成的外基質框架,其特殊的組織結構利于細胞黏附和生長。作為一種天然的細胞外基質,良好的細胞載體材料,在脫除細胞成分后基質無免疫原性,有望在組織器官體內支撐引導種子細胞,并可負載細胞生長、增殖及分化[8]。我們把包皮細胞和羊膜共同培養后,發現無論是在HAAM還是未脫細胞的羊膜上,包皮細胞都能生長良好,可以形成具有一定韌性、厚度和適當大小的細胞層片(圖2、3)。考慮到羊膜上的細胞具有異質性,而脫細胞羊膜具有以下優點:(1)良好的組織相容性;(2)生物可降解性;(3)無免疫原性;(4)多孔性和高空隙率,利于細胞的貼附和生長,誘導組織再生;(5)可塑性;(6)一定的機械強度[9]。范巨峰等[10]研究證實尿道黏膜上皮細胞在人脫細胞羊膜上共同培養后,細胞活性良好,所培養的細胞層生長效果良好。在本研究中,拉力試驗顯示脫細胞羊膜的力學強度是下降的,共同培養上皮細胞后,實驗組力學強度也略低于對照組,但是仍然遠大于單純細胞層片,具備進行縫合操作的條件。HAAM作為培養基質,包皮上皮細胞良好生長,且機械強度優于單純的細胞層片,為臨床應用提供了實驗基礎。
本研究提示利用組織工程技術可以培養出單層細胞層片,在此基礎上通過和HAAM共同培養可以得到更好的細胞層片。在HAAM上包皮細胞生長良好,與支架材料復合良好,并且具有良好的機械強度和較大面積的細胞層片,為今后組織工程化尿道的復合階段研究提供了前期研究基礎。

