從復雜性尿路感染反復發作至確診Ⅱ型原發性高草酸尿癥(PH) 1例
陳 蕓 尚 達 郝傳明 朱彤瑩
(復旦大學附屬華山醫院腎病科 上海 200040)
原發性高草酸尿癥(primary hyperoxaluria,PH)是一種罕見的先天性乙醛酸鹽和草酸鹽代謝異常性疾病,其特征是草酸鹽產生過量,導致草酸鹽在各器官沉積[1],疾病后期易導致終末期腎臟疾病。目前發現3種PH亞型:Ⅰ型最常見,約占PH病例的80%,Ⅱ型和Ⅲ型各占10%。國內鮮有關于Ⅱ型PH病例的報道,復旦大學附屬華山醫院現確診1例PH,患者反復尿路感染30余年,伴雙腎多發結石,肌酐進行性升高,確診時已進展至慢性腎臟病(chronic kidney disease,CKD)Ⅳ期,現報告如下。
病例資料 男性患者,41歲,2011年10月在無明顯誘因下出現尿頻尿急,嚴重時約20~30次/天,每次約50 mL,色混濁,無發熱,無尿痛,遂于我院就診。尿常規:白細胞1 890/μL,紅細胞36/μL,蛋白(++);B超提示雙腎多發結石,右腎萎縮;血肌酐113 μmol/L;腎小球濾過率(glomerular filtration rate,GFR):右腎21.8 mL/min,左腎61.7 mL/min;完善免疫相關檢查:抗環瓜氨酸多肽抗體(anti-cyclic peptide containing citrulline,抗-CCP抗體)、抗心磷脂抗體、抗核抗體、類風濕因子等結果均為陰性;尿培養提示念珠菌,診斷為“CKD Ⅲ期,復雜性尿路感染,雙腎多發結石”,予氟康唑300 mg/qd靜滴聯合氟胞嘧啶1 g/tid口服抗真菌治療,聯合哌拉西林他唑巴坦4.5 g/q12 h抗感染,后尿頻尿急癥狀改善,尿白細胞及蛋白尿轉陰。出院后患者繼續口服氟康唑400 mg/qd、氟胞嘧啶1 g/tid抗真菌感染,療程5周,暫停2周,囑患者重復該方案,后患者自行于外院隨訪治療。患者自訴此后尿頻、尿急反復發作,癥狀明顯時查尿常規可見滿視野白細胞,外院抗感染治療后降至50/μL左右。自2014年10月起,患者尿白細胞長期持續在600/μL,年底遂于外院行左腎體內碎石術,術后尿路感染癥狀仍時常復發,無明顯改善。
2016年4月,患者因“右腎萎縮,反復尿路感染伴結石”于外院行腹腔鏡下右腎切除術,術后予卡泊芬凈抗感染治療。術后1個月,患者尿頻、尿急癥狀再次發作,繼續抗感染治療后好轉,停藥1個月左右復發,反復住院治療。2016年5月復查肌酐191 μmol/L,9月肌酐升至254 μmol/L。患者自我院就診出院后規律治療、預防用藥(口服氟康唑400 mg+氟胞嘧啶1 g/tid)并隨訪,但緩解后均短期內復發。
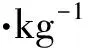

The genetic diagnosis showed the base deletion of TG onGRHPR(c.862_863delTG).
圖1 患者GRHPR基因診斷結果
Fig 1 The results of gene diagnosis forGRHPRof the patient
確診后患者尿路感染仍間斷發作,均在高草酸尿癥基本支持治療(大量飲水、服用枸櫞酸鉀)基礎上予以對應抗感染治療,發作周期較前延長(2~3個月)。但由于存在PH的原始病因,治療效果仍較局限。
既往史及家族史:患者自訴3歲起時有尿路感染發作并確診雙腎結石,于外院抗感染對癥治療,但未予重視,具體用藥不詳;1991年曾行右腎切開取石術;1992年行左輸尿管切開取石術;2014年12月行左側輸尿管軟鏡激光碎石術;2016年4月行腹腔鏡下右腎切除術,均為外院手術。患者否認家族遺傳病史,其父母為表兄妹近親婚配,育有一女,體健。
討論
發病機制及臨床表現 PH是一種常染色體隱性遺傳疾病,目前已知3種亞型:Ⅰ型由AGXT基因介導,基因突變導致其編碼調控的肝臟特異性過氧化物酶體丙氨酸-乙醛酸氨基轉移酶(alanine-glyoxylate aminotransferase,AGT)缺乏;Ⅱ型系由于GRHPR基因突變,導致GRHPR表達缺陷;Ⅲ型則主要由編碼肝臟特異性線粒體4-羥基-2-酮戊二酸醛縮酶的HOGA1基因突變導致[2]。其中,引起Ⅱ型的GRHPR基因定位于染色體9p11,至今已發現關于該基因的30個突變[3],最常見的是外顯子2中單個堿基對的缺失(c.103delG),約占40%。
3種亞型不同的基因突變均導致相關酶的表達缺陷,使得乙醛酸鹽代謝障礙,機體產生大量草酸鹽。由于草酸鹽主要以草酸鈣的形式通過腎臟排泄,過飽和的草酸鈣晶體易在腎間質和腎小管細胞沉積,引起腎實質炎癥和纖維化,最終導致終末期腎病[4];而結石引起的感染和梗阻也會進一步導致腎臟損害。隨著腎功能下降,腎臟對草酸鹽的排泄能力不斷降低,過飽和的草酸鹽則在各組織中沉積,引起系統性疾病。
PH臨床表現復雜多變,因分型、基因型、患者年齡和診斷時疾病的嚴重程度而異。3種亞型中以Ⅰ型最為嚴重,大部分患者在幼兒時即出現癥狀并在確診后15年內發展至終末期腎病[5];Ⅲ型癥狀最輕,常隱匿或僅限于結石形成,盡管患者仍存在高尿酸血癥,但少有慢性腎衰竭發生,迄今為止無系統受累病例[6];相比于Ⅰ型,Ⅱ型PH草酸鹽排泄量相對較少,癥狀相對較輕,腎鈣質沉著癥的發生率低,隨著時間的推移腎功能進展也相對緩慢。因而Ⅱ型PH的早期診斷及干預對防止腎功能損傷至關重要,臨床表現主要與復發性尿路結石有關,包括肉眼血尿、腎絞痛、尿路感染、尿路梗阻等[7]。
病例分析 本例患者臨床上表現為反復發作的復雜性尿路感染,因尿路感染不良感受就診,病程30余年,確診時腎功能不全已進展至CKD Ⅳ期。國內目前僅報道1例Ⅱ型PH類似病例[8]:6歲起病,12歲腎功能即發展至尿毒癥期,入院行透析治療時確診,其腎功能不全進展快,除導致PH2的GRHPR基因位點的突變,還合并有PKHD1基因的雜合突變,該基因可致常染色體隱性遺傳的多囊腎病。相比之下,同樣是幼年起病,本例患者從發現臨床癥狀至疾病確診總病程近40年,早期無嚴重不適,近期尿路感染頻繁發作,肌酐進行性上升,提示病情進展,病程中腎功能進展相對緩慢。經基因分析提示本病例為單一GRHPR基因點突變,因而疾病癥狀、進展更為典型。
以下原因均易導致PH的誤診、漏診:臨床上PH病例(尤其Ⅱ型、Ⅲ型)極為少見,臨床醫師對疾病的認識和實踐較少;PH患者臨床表現局限,以泌尿系統結石最為直觀,易誤導醫務人員僅對“癥狀”治療,忽略根本病因;早期診斷方法有限。本例患者首次因“復雜性尿路感染”來我院就診而未能予以準確診斷,一方面是由于醫務人員對于該病經驗不足,另一方面則由于未能充分了解其30余年病史的特殊性,未深入探究病因,且患者在2011年首次于我院治療前雖曾行取石術,但當時未能提供結石成分分析結果,忽略了結石成分對診斷的重要性,病程中主要針對尿路感染癥狀予以治療,忽略了病因診斷,導致治療欠規范。
診斷和治療 PH(尤其是Ⅱ型)在臨床上罕見,但由于患者體內草酸鹽產生過剩,草酸鹽成分的結石在臨床上具有高度診斷價值,通過明確結石性質來鑒別普通機械性結石經濟且有效。對于尿鈣、尿酸排泄正常而尿沉渣中存在草酸鹽結晶,反復發作雙腎多發性結石或者復雜性尿路感染的年輕患者,應考慮PH可能。對于此類患者,在臨床上基因遺傳學分析尚不普及的情況下,應盡早明確結石性質以輔助診斷;一旦基因診斷明確,應同時評估潛在受累器官(腎臟、心臟、甲狀腺)的功能和草酸鹽沉積量。目前臨床醫師對PH的警惕性仍不夠高,易誤診、漏診,進而影響預后。
目前對Ⅱ型PH的治療主要包括基礎支持、透析以及器官移植,近期也有學者提出相關的分子療法,包括酶替換和藥物分子療法等[9]。基本支持治療最常用,具體措施包括大量飲水、使用鈣劑及中性正磷酸鹽等,目的在于減少草酸鹽的過飽和;在器官移植之前,可行血液透析和腹膜透析,以控制血草酸鹽在30~45 μmol/L[10];不同于Ⅰ型PH,對于進展為終末期腎病的Ⅱ型PH患者,主要推薦單獨腎臟移植,目前沒有證據表明肝移植能夠糾正Ⅱ型PH患者乙醛酸鹽代謝的先天性異常[11],但是一些患者在接受腎移植后依然發生草酸鹽相關的移植腎失功[12],具體機制還有待研究。
PH作為一種罕見的遺傳性疾病,由于起病隱匿,其診斷和治療常常被延誤。盡早診斷并予以相應治療對患者的腎功能維持和預后有重要意義。該病例提示對于反復發作的復雜性尿路感染伴泌尿系統結石患者應考慮到PH的可能。盡早的結石成分分析對于普通機械性結石與高草酸尿癥的鑒別至關重要,尤其是幼年起病患者,應盡早明確結石性質輔助診斷,在腎功能進行性下降前予以積極干預;對于有高遺傳疾病患病率風險的人群(本例患者父母近親婚配),應更加注重篩查,而最終確診和分型則仍需要基因檢測以明確。對于PH患者,治療泌尿系統多發性結石應慎行腎切除手術,盲目的腎臟切除治療可能進一步加重另一側腎臟的草酸鹽排泄負擔,從而導致腎功能不全進展加快。

