腸內營養聯合腸外營養對胰腺癌患者術后康復的影響
吳春玲,蔡玉玲,李麗佳
遼陽市中心醫院普外科,遼寧遼陽111000
胰腺癌發病隱匿,進展迅速,是惡性程度較高的腫瘤之一,5年生存率不足3%[1]。其中胰頭癌最為多見,占胰腺癌的70%~80%,胰十二指腸切除術(又稱Whipple手術)聯合化療是胰頭癌的主要治療手段[2],然而Whipple手術操作復雜、手術時間長、切除組織多,對患者造成極大創傷。相關研究表明,88%的胰頭癌患者術后會發生營養不良[3],嚴重影響患者的治療耐受性、術后康復進程和生存質量。因此,改善胰腺癌患者的術后營養狀況一直是研究熱點之一[4]。腸內營養(enteral nutrition,EN)因其符合生理[5]、營養素全面、給藥方便、價格低廉等優點,已成為目前主要的營養支持方案,但患者術后早期胃腸道功能尚未恢復,EN加重患者消化道負擔,甚至增加胰瘺的發生風險[6]。本研究選取了96例行Whipple手術的胰腺癌患者,并探討EN聯合腸外營養(parenteral nutrition,PN)對胰腺癌患者術后康復的影響,現報道如下。
1 對象與方法
1.1 研究對象
選取2015年1月至2018年1月于遼陽市中心醫院診斷并經檢查評估擬進行Whipple手術的胰腺癌患者96例。納入標準:①經經皮細針穿刺細胞學檢查確診為胰腺癌,并經評估需行Whipple手術;②一般情況尚好,生活可基本自理,無嚴重惡病質或肝腎功能不全,預計生存期>3個月;③體重指數[體重(kg)/身高(m)2]不超過正常值[7(]18.5~23 kg/m2)的±30%。排除標準:①因任何原因想出院、退出研究者;②不能耐受治療方案者。采用隨機數字表法將患者隨機分為腸外營養組和聯合營養組,每組48例。其中腸外營養組患者中,男33例,女15例;年齡43~68歲,平均(57.05±10.24)歲;有遠處轉移39例,無遠處轉移9例。聯合營養組患者中,男31例,女17例;年齡42~70歲,平均(59.15±12.83)歲;有遠處轉移41例,無遠處轉移7例。兩組患者的性別、年齡、遠處轉移情況比較,差異均無統計學意義(P>0.05),具有可比性。本研究經醫院倫理委員會審核通過,所有患者均于術前被告知相關研究內容,并簽署了知情同意書。
1.2 治療方法
兩組患者均行Whipple手術,術前均常規置入中心靜脈營養導管并安置鼻胃管,術中將鼻胃管末端置于胃腸吻合口下端約20 cm處。參考Harris-Benedict公式[8]計算患者每日需要的熱量,按照25 kcal(/kg·d)提供熱量,其中脂肪熱量占40%,熱氮比約為120 kcal∶1 g,同時添加常規劑量的礦物質與微量營養素。本研究使用的PN液為脂肪乳氨基酸(17)葡萄糖(11%)注射液,EN液為腸內營養乳劑(TPF),輸注溫度均為37℃,所有患者營養支持療程均為10天。
腸外營養組患者術后12天開始進行靜脈營養支持,每日給予對應體重劑量脂肪乳氨基酸(17)葡萄糖(11%)注射液,控制滴速在16~20 h滴注完畢,注意觀察靜脈穿刺部位和輸液管,及時處理輸液管堵塞。對所有應用靜脈營養液的患者監測輸注過程中的血糖、血清甘油三酯及電解質水平,血糖過高時使用胰島素控制血糖低于11.1 mmol/L。
聯合營養組患者術后采用PN聯合EN支持,并逐漸加大EN的比例,總熱量與腸外營養組患者保持一致。術后第1天,PN與EN的比值為4:1,EN輸注速度為50 ml/h,并密切觀察患者的耐受情況;術后第2天,PN與EN的比值為3:2,EN輸注速度為50~100 ml/h,根據患者情況逐漸加速;術后第3天,PN與EN的比值為2:3,EN輸注速度為100 ml/h;術后第4天,PN與EN的比值為1:4;術后第5天,全部營養經腸內給予。注意輸注腸內營養素前用20 ml溫水經鼻胃管注入腸道,若患者無明顯不適,過2 h再注入溫水50 ml,若患者無明顯不適,再過2 h則可以開始輸注EN。
1.3 觀察指標
術后記錄患者首次排氣時間和住院天數。在術前和術后1、2、3周,分別采集患者的清晨空腹靜脈血。其中血常規檢查重點記錄患者血紅蛋白(hemoglobin,Hb)變化;生化檢查采集后靜置15 min,3000 r/min離心10 min分離血清,保證2 h內檢測完畢,重點記錄患者前白蛋白(prealbumin,PA)、白蛋白(albumin,ALB)、甘油三酯(triglyceride,TG)、免疫球蛋白A(immunoglobulin A,IgA)、免疫球蛋白M(IgM)和免疫球蛋白G(IgG)水平。給予患者一級護理,密切觀察患者的并發癥發生情況,如胃潴留、胰瘺、腹腔出血和感染征象,及時回應患者及家屬訴求。
1.4 統計學分析
采用SPSS 20.0軟件對數據進行分析。正態分布的計量資料以均數±標準差(±s)表示,組間比較采用兩獨立樣本t檢驗,組內比較采用配對t檢驗;重復測量的計量資料比較采用重復測量方差分析。計數資料以例數和率(%)表示,組間比較采用χ2檢驗。以P<0.05為差異有統計學意義。
2 結果
2.1 術后恢復指標的比較
腸外營養組患者的術后首次排氣時間為(6.62±1.41)d,明顯長于聯合營養組患者的(4.48±1.06)d,差異有統計學意義(t=8.405,P<0.01);腸外營養組患者的住院時間為(25.36±5.58)d,明顯長于聯合營養組患者的(21.73±5.82)d,差異有統計學意義(t=3.119,P<0.01)。
2.2 不同時間點營養指標的比較
兩組患者手術前后不同時間點(術前和術后1、2、3周)PA、ALB、Hb、TG水平比較,差異均有統計學意義(F時間=237.244、3.056、3.618、47.225,P<0.05),其中術后隨著時間延長,兩組患者的PA、Hb水平呈現增高趨勢,TG水平呈現降低趨勢;兩組患者的PA水平組間比較,差異有統計學意義(F組間=5.627,P<0.01);兩組患者的PA水平在時間和組間存在交互效應(F時間×組間=131.838,P<0.01)。兩組患者的ALB、Hb、TG水平組間比較,差異均無統計學意義(F組間=2.144、2.041、4.010,P>0.05);兩組患者的ALB、Hb、TG水平在組間和時間不存在交互效應(F時間×組間=2.018、2.139、3.970,P>0.05)。(表1)
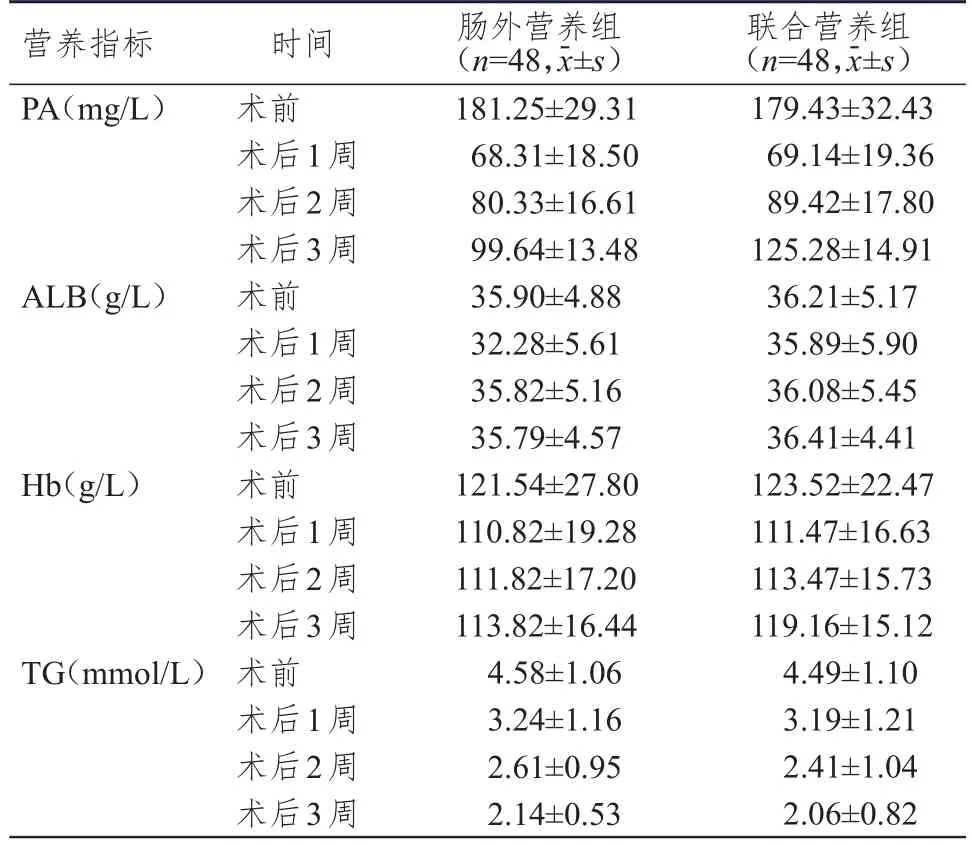
表1 不同時間點兩組患者的營養指標水平
2.3 血清免疫球蛋白水平的比較
術前,兩組患者的IgA、IgM、IgG水平比較,差異均無統計學意義(P>0.05);術后2周,聯合營養組患者的IgA、IgM、IgG水平均高于腸外營養組,差異均有統計學意義(P<0.05)。腸外營養組患者術后2周的IgA、IgM、IgG水平均低于本組術前,差異均有統計學意義(P<0.05),而聯合營養組患者術后2周的IgA、IgM、IgG水平與本組術前比較,差異均無統計學意義(P>0.05)。(表2)
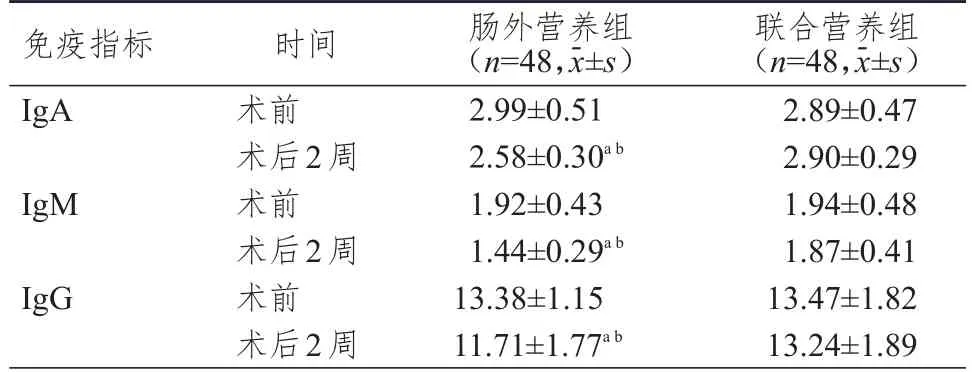
表2 兩組患者手術前后免疫指標水平的比較
2.4 并發癥發生情況的比較
腸外營養組患者中,19例(39.58%)患者術后出現并發癥,其中胃排空障礙9例,胰瘺2例,術后腹腔出血2例,感染2例,排空障礙合并胰瘺1例,胰瘺合并腹腔感染3例;聯合營養組患者中,17例(35.42%)患者術后出現并發癥,其中胃排空障礙9例,胰瘺3例,術后腹腔出血1例,胰瘺合并腹腔感染4例。兩組患者的并發癥發生情況比較,差異無統計學意義(P>0.05)。
3 討論
胰腺癌的發病率和病死率接近,根治性手術是唯一可能治愈胰腺癌的手段[2]。然而手術切除對消化系統的創傷較大,常導致早期EN供給困難,因而術后營養不良的發生率居高不下,嚴重影響患者的治療耐受和生存質量[9]。胰腺癌術后給予合理的營養支持早已成為臨床共識,但營養方案的選擇目前仍存在較大爭議[10]。
目前,胰腺癌術后主要的營養支持途徑分為PN和EN。由于患者術后早期消化道功能尚未恢復,全EN方案無法耐受,且過早、過于劇烈的消化道刺激不利于手術切口的愈合[11],因此本研究選擇了EN循序漸進的供給方式,結果顯示,聯合營養組患者的術后首次排氣時間明顯短于腸外營養組(P<0.01),提示聯合營養供給方式有利于患者更快地恢復腸道功能,促進傷口愈合。相關研究表明,術后早期全EN方案會明顯增加患者腹瀉、腸痙攣及胰瘺等并發癥的發生率[12]。本研究選擇在術后12 h先以溫水試驗胃腸反應的做法,無明顯不適再進行EN輸注,結果發現兩組患者的并發癥發生情況比較,差異無統計學意義(P>0.05)。提示聯合營養供給和逐步增加胃腸道負擔的做法是安全的。
PA與ALB均為血清中重要的營養蛋白、組織修復蛋白,參與術后患者傷口組織蛋白的合成,術后消耗增多,故水平降低[13],而術中出血可導致Hb水平降低。上述3種指標的術后恢復情況反映了患者術后的營養狀況[14]。本研究結果顯示,兩組患者手術前后不同時間點PA、ALB、Hb水平比較,差異均有統計學意義(P<0.05)。兩組患者的ALB、Hb水平組間比較,差異均無統計學意義(P>0.05),且組間和時間不存在交互效應(P>0.05);兩組患者僅PA水平組間比較,差異有統計學意義(P<0.01),且組間和時間存在交互效應(P<0.01)。可能是因為ALB的半衰期較長,受外源性蛋白的影響較大,因此不夠靈敏[15-16],而Hb合成周期較長,故多在術后2周開始升高,一般2個月才能恢復正常水平[17]。兩組患者的TG水平組間比較,差異無統計學意義(P>0.05),且組間和時間不存在交互效應(P>0.05),可能是由于腸外營養液脂肪直接入血,TG水平升高較快所致。
Panova等[18]研究指出,消化道手術后禁食會引起胃腸道黏膜免疫相關淋巴組織的數量和功能降低,而營養不良也會引起患者免疫力降低。本研究結果顯示,術后2周,聯合營養組患者的IgA、IgM、IgG水平均高于腸外營養組(P<0.05),且聯合營養組患者的IgA、IgM、IgG水平與本組術前比較,差異均無統計學意義(P>0.05),表明聯合營養組患者已恢復至術前水平。提示聯合營養方案更利于患者術后免疫功能的恢復,減小手術造成的免疫抑制。Song等[19]研究也得出類似結果。
然而本研究仍存在以下幾點不足之處:①樣本量較小,可能不足以觀察到細微的差別,如并發癥的發生率[20];②由于國內醫療環境的原因,本研究的觀察時間不夠長,僅1個月,未觀察到ALB、TG和Hb指標組間改善情況的差異,因此仍有待進一步研究。
綜上所述,胰腺癌患者術后采取EN聯合PN,EN比例逐漸增加的方案安全可靠,有利于胰腺癌患者術后康復,值得更大規模的臨床研究和推廣。

