H2S通過誘導Klotho基因啟動子去甲基化改善單側輸尿管梗阻(UUO)小鼠腎臟纖維化
顧玉露 陳 靜 張 函 沈子妍 徐靈菡 呂詩琦 章曉燕△
(1復旦大學附屬中山醫院腎內科 上海 200032; 2上海市腎病與透析研究所 上海 200032;3上海市腎臟疾病與血液凈化重點實驗室 上海 200032)
腎臟纖維化是腎組織在慢性持續性損傷過程中出現的以腎小球硬化、腎小管萎縮和腎間質纖維化為特點的病理性修復現象[1],是各種慢性腎臟病進展為終末期腎臟病的共同途徑[2],而目前仍缺乏有效的治療手段[3]。硫化氫(hydrogen sulfide,H2S)是繼NO和CO之后被發現的第3種內源性氣體信號分子,具有抗纖維化、抗衰老、抗炎、抗氧化應激、調節血管活性等多種生物學功能[4]。研究表明腎臟富含合成H2S的關鍵酶:胱硫醚-β-合酶(cystathionine β-synthase,CBS)和胱硫醚-γ-裂合酶(cystathionine γ-lyase,CSE)[5]。在多種急慢性腎臟損傷后,腎組織內源性H2S生成減少,外源性給予H2S可有效減輕腎臟損傷[4]。且H2S對于腎臟纖維化的減輕作用已得到證實[6],但具體機制仍不清楚。Klotho基因與人類衰老密切相關,已在多種腎臟纖維化動物模型中證實,腎臟Klotho低表達參與腎臟纖維化的發生發展[7]。本研究擬通過建立單側輸尿管梗阻(unilateral ureteral obstruction,UUO)小鼠模型,觀察外源性給予H2S是否能通過調控腎組織Klotho表達而減輕腎臟纖維化,并探索相關機制。
材 料 和 方 法
實驗動物及主要試劑 健康6~8周齡C57BL/6雄性小鼠,體質量18~23 g,購自上海靈暢生物科技有限公司,自由進食飲水。NaHS(美國Sigma公司);抗Klotho抗體、抗DNA甲基轉移酶1 (DNA methyltransferase 1,DNMT1)抗體、抗α平滑肌肌動蛋白(α-smooth muscle actin,α-SMA)抗體、抗GAPDH抗體、抗5-羥甲基胞嘧啶 (5-hydroxymethylcytosine,5hmC)抗體(Abcam);抗胱硫醚β合酶(cystathionine-β-synthase,CBS)抗體和抗胱硫醚γ裂合酶(cystathionine-γ-lyase,CSE)抗體(美國Santa Cruz公司);抗纖連蛋白(fibronectin,FN)抗體(美國Cell Signaling公司);基因組DNA提取試劑盒(北京天根生化科技有限公司);甲基化DNA檢測試劑盒(北京百奧萊博科技有限公司);Qiagen Pyro Mark PCR試劑盒和PyroGold試劑盒(QIAGEN);小鼠硫化氫ELISA試劑盒(上海仁捷生物科技有限公司);核蛋白-胞質蛋白提取試劑盒(Thermo Scientific);5mC-羥化酶TET活性/抑制分析試劑盒(Epigentek)。
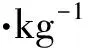
血清H2S濃度測定 全血標本經1 000×g離心20 min,取上清即為血清。根據試劑盒說明,每個樣本取50 μL血清進行ELISA檢測。
腎臟病理分析 腎組織置于4%中性甲醛溶液中固定24 h,常規石蠟包埋,切片(厚度為4 μm),行HE和Masson染色。光鏡(×200)下觀察Masson染色結果,每只小鼠隨機選取10個不重疊視野,采用ImageJ測定腎小管間質纖維化面積占總面積的百分比。
Western blot檢測 提取腎臟組織蛋白后BCA法測蛋白質濃度。取20~50 μg總蛋白,經6%SDS-PAGE,濕轉至PVDF膜上,PVDF膜用5%脫脂奶粉室溫封閉1 h,一抗4 ℃孵育過夜;TBST洗膜3次,室溫下二抗孵育1 h;ECL發光顯影。用ImageJ分析條帶灰度值,以GAPDH作為內參校正。
免疫組織化學染色 腎組織切片經二甲苯脫蠟和乙醇水化后,微波修復抗原,10%正常山羊血清封閉,一抗4 ℃孵育過夜,加入生物素標記的二抗在37 ℃孵育15 min,DAB顯色,蘇木精復染。光鏡下(×200)觀察腎組織切片,胞質呈棕黃色為陽性。
RT-PCR檢測 向組織勻漿中加入Trizol,經氯仿、異丙醇分離沉淀RNA,溶于DEPC水中,測RNA濃度。取500 ng RNA,按PrimeScript RT Master Mix試劑盒(TaKaRa)說明進行逆轉錄,用SYBR Premix Ex Taq (TaKaRa)進行PCR反應。TET1上游引物:5’-TGAAGATGACAAGCAGC-AAACC-3’,TET1下游引物:5’-TTGTTGAGCG-GAAGGTGTGT-3’;TET2上游引物:5’-GACT-CAACGGTTATCAGGCTTTT-3’,TET2下游引物:5’-CATTGCTCTTTATTCTTCCTCT-GTAA-3’;TET3上游引物:5’-CTCCCCTGCTGTCTTC-AGA-3’,TET3下游引物:5’-CCTGAGGCTCTG-TGGAAGTA-3’。
雙加氧酶活性 采用核漿蛋白提取試劑盒提取組織核蛋白并檢測濃度。取6 μg核蛋白按照5mC-羥化酶TET活性/抑制分析試劑盒說明操作,于450和655 nm波長下讀取吸光度(D)值,計算公式:TET活性=(D樣品-D空白)×1 000/(6×90)。
焦磷酸測序 根據Klotho啟動子區CpG島位置(-431~-401)設計引物(上游引物:5’-TGG-GAGAGCTCCCTTTGATGGTTT-3’,下游引物:5’-CCCAAATCAAATTCATTCTCACCTACCTT-T-3’)。測序引物:5’-AGTGAAGAGTAGGTG-3’。按照DNA提取試劑盒說明提取腎組織基因組DNA,測定DNA濃度,根據甲基化檢測試劑盒說明對DNA進行亞硫酸鹽修飾,未甲基化的胞嘧啶變成尿嘧啶。修飾后的DNA經PCR擴增。根據說明使用PyroMark Q96 MD焦磷酸測序系統對產物進行定量焦磷酸測序。某一位點甲基化率為甲基化胞嘧啶占總胞嘧啶的比例,結果為啟動子區6個CpG位點的平均值。
羥甲基化DNA免疫共沉淀聯合實時定量PCR檢測 取2 μg腎組織DNA經Bioruptor超聲儀(Diagenode)超聲破碎為200~1 000 bp,取10 μL記為內參(input),剩余DNA中加入5hmC一抗4 ℃孵育過夜;4 ℃下抗體-DNA結合物與G蛋白磁珠旋轉混合過夜,1×IP緩沖液洗滌3次,向磁珠中加入蛋白酶K和蛋白酶消化緩沖液,50 ℃震蕩孵育3 h,即得到羥甲基化產物。以產物與內參為模板,進行qPCR擴增(結果以%input表示)。取5 μL PCR產物進行瓊脂糖凝膠電泳。
結 果
UUO小鼠血清H2S濃度和腎組織H2S合成關鍵酶表達的變化 通過ELISA方法對UUO造模后第7天小鼠血清H2S濃度進行檢測,結果顯示Sham組和UUO組血清H2S水平分別為(5.18±0.34) nmol/mL和(4.23±0.21) nmol/mL。與Sham組相比,UUO組血清H2S水平顯著降低(P=0.032 5,圖1A)。免疫組化染色結果顯示,CBS、CSE主要表達于腎皮質,梗阻7天后CBS(P=0.002 7)、CSE(P=0.018 0)表達均顯著下降(圖1B)。Western blot結果顯示,UUO組腎皮質CBS(P=0.000 3)、CSE蛋白表達較Sham組顯著降低(P=0.001 5,圖1C)。


圖1 UUO小鼠血清H2S濃度和腎組織H2S合成關鍵酶表達的變化
Fig 1 Change of the concentration of serum H2S and renal expression of H2S synthetase in mice with UUO

NaHS對UUO小鼠腎臟Klotho表達和基因啟動子甲基化的影響 免疫組化染色顯示:Klotho主要表達于腎皮質,免疫組化染色(圖3A)和Western blot(圖3B)均顯示UUO小鼠梗阻側腎臟Klotho表達顯著低于Sham組(P分別為0.001 4和0.001 9),NaHS組Klotho表達較UUO組顯著升高(P分別為0.000 3和0.002 7)。通過焦磷酸測序和hMeDIP-qPCR檢測各組Klotho基因啟動子區甲基化和羥甲基化水平,結果顯示Sham 組、UUO組、NaHS組腎組織Klotho基因甲基化率分別為3.65%±0.26%、11.83%±0.53%和7.39%±0.70%。與Sham組相比,UUO組Klotho甲基化率顯著升高(P<0.0001);與UUO組相比,NaHS組Klotho甲基化率顯著降低(P=0.000 5,圖3C)。Sham組與UUO組Klotho羥甲基化水平差異無統計學意義,NaHS組Klotho羥甲基化水平顯著高于UUO組(P=0.038 7,圖3D)。


圖2 NaHS減輕UUO小鼠腎臟纖維化
Fig 2 NaHS ameliorates renal tubulointerstitial fibrosis in mice with UUO

討 論
腎臟纖維化是各種病因引起的急慢性腎損傷進展為終末期腎臟病的共同通路,其發生發展機制與表觀遺傳修飾密切相關[8]。H2S可抑制成纖維細胞增殖與腎上皮細胞間充質轉分化,減輕腎臟纖維化,改善腎功能,但具體機制仍不清楚。本研究通過建立UUO模型,證實外源性補充小劑量H2S可通過升高腎組織TET活性誘導Klotho基因啟動子羥甲基化,減輕Klotho基因啟動子甲基化而上調Klotho表達,從而改善UUO小鼠腎臟纖維化。


圖3 NaHS對UUO小鼠腎臟Klotho表達和基因啟動子甲基化的影響
Fig 3 Effects of NaHS on expression of renal Klotho and methylation level inKlothopromoter region in mice with UUO


圖4 NaHS誘導腎組織Klotho基因啟動子去甲基化的機制
Fig 4 Mechanism of NaHS inducing hydroxymethylation in renalKlothopromoter region
UUO模型是以腎小管間質纖維化為特點的腎損傷模型。通過對C57BL/6小鼠進行單側輸尿管結扎,既往研究[9]和本實驗均發現小鼠腎小管間質損傷伴有膠原纖維沉積和間質增寬,證明UUO模型成功。同時我們發現,UUO小鼠血清H2S濃度下降,腎組織內源性H2S合成關鍵酶CBS和CSE表達降低。這種現象也在多種腎臟纖維化動物模型中得到證實[6],還有研究證實CSE基因敲除可加重輸尿管梗阻引起的腎臟損傷[10]。既往研究與我們的結果均證實外源性小劑量補充H2S可顯著減輕腎臟纖維化[6]。以上研究結果說明腎臟纖維化的發生發展與內源性H2S缺乏密切相關。
Klotho可通過抑制促纖維化相關蛋白表達、RAS系統、TGF-β/Smad通路和Wnt/β-catenin通路等多種機制而發揮其抗腎臟纖維化的作用[11-14]。Klotho缺乏可引起腎臟纖維化,而Klotho過表達或外源性補充Klotho可減輕腎臟纖維化[15]。DNA甲基化是一種調節基因表達的重要表觀遺傳方式,由DNMTs將S-腺苷甲硫氨酸的甲基團轉移至胞嘧啶的第5位C原子上,從而形成5-甲基胞嘧啶,且啟動子區發生甲基化可沉默基因轉錄[16-17]。Klotho表達與其啟動子甲基化狀態密切相關,啟動子超甲基化可沉默Klotho表達。既往研究提示腎臟Klotho基因啟動子甲基化是腎臟Klotho低表達的重要機制,Klotho基因啟動子區的CpG島可在DNMT1作用下發生甲基化,沉默Klotho表達而參與腎臟纖維化的發生[18-19]。腎臟纖維化患者和多種腎臟纖維化動物模型腎組織中均發現Klotho啟動子超甲基化,且與腎臟纖維化嚴重程度呈正相關[19-20]。本研究發現UUO小鼠腎組織Klotho表達明顯降低,同時伴有Klotho基因啟動子甲基化水平顯著升高,而補充H2S可升高Klotho基因啟動子羥甲基化水平而降低Klotho基因啟動子甲基化水平,同時上調Klotho表達。此結果提示,H2S可通過誘導Klotho基因啟動子去甲基化水平而上調Klotho表達,改善腎臟纖維化。
研究證實,體細胞中的DNA甲基化是一個可逆的過程,DNA雙加氧酶TET蛋白家族能夠催化DNA中的5-甲基胞嘧啶氧化成為5-羥甲基胞嘧啶,從而完成DNA的主動去甲基化過程[21]。文獻報道TET1、TET2和TET3在腎臟均有表達[22]。我們推測NaHS可能通過TET依賴的方式調控Klotho基因啟動子甲基化水平,為證明這一推測,我們檢測了各組腎組織TET1、TET2和TET3的表達水平。結果顯示UUO組TET1、TET2和TET3表達均顯著高于Sham組,這可能是由于機體為維持體內甲基化和羥甲基化水平相對平衡而出現的代償性結果,而補充H2S后并不能上調UUO小鼠腎臟TET1、TET2和TET3的表達。由于TET發揮羥甲基化作用依賴酶的催化活性,我們檢測了各組腎組織TETs活性,發現雖然UUO小鼠腎組織TETs蛋白質水平上調,但其活性顯著低于Sham組,因此Klotho羥甲基化水平仍處于較低水平,而外源性補充H2S后TET活性明顯升高,Klotho羥甲基化水平相應顯著升高。以上結果說明H2S主要通過調節TET活性而非其表達量調控Klotho基因啟動子的甲基化水平。另一方面,由于H2S可下調UUO小鼠腎臟DNMT1,減輕Klotho甲基化水平,因此給予NaHS治療的UUO小鼠腎臟TET升高不如UUO組明顯。
本研究存在一些局限性:(1)由于NaHS是H2S的一種快釋放劑,難以在體內維持長效、穩定的生理濃度,因此我們使用的NaHS劑量高于文獻劑量;且目前檢測體內H2S濃度的方法不同,檢測值也不同,因此生理性H2S濃度仍需進一步確認。(2)由于腎臟組織成分較為復雜,大多數文獻只觀察腎臟組織TET的轉錄水平表達情況,我們也僅檢測了TET mRNA表達水平。(3)由于缺乏有效的方法檢測TET各蛋白質的酶活性,H2S是通過調控哪種或哪幾種TET酶活性尚不明確。
綜上所述,本研究證實外源性補充小劑量H2S可通過調節TET活性調控Klotho基因啟動子的甲基化水平,誘導Klotho基因啟動子去甲基化,上調Klotho表達而減輕腎臟纖維化。外源性補充小劑量H2S是一種很有前景的抗腎臟纖維化的治療手段。關于H2S調控TET活性的機制將在后續的實驗中進行深入研究。

