知母總皂苷對佐劑型關節炎模型大鼠琥珀酸/GPR91/IL-1β通路的影響?
潘 婷,陳 歡,劉攀旺,徐世軍△
(1.成都中醫藥大學藥學院,成都 611137;2.成都中醫藥大學中醫腦病藥物整合轉化研究所,成都 611137)
關節滑膜增生和成纖維細胞(synovial fibroblast cell,FLS)炎性浸潤是類風濕關節炎(rheumatoid arthritis,RA)的主要病理特征[1-2]。炎癥的發生發展與細胞的能量代謝狀態極為密切[3]。琥珀酸由琥珀酰CoA合成酶催化琥珀酰CoA生成,同時高能硫酯鍵水解生成GTP。研究發現,琥珀酸在RA患者關節滑膜液中大量累積,并被認為是導致滑膜病理變化的關鍵因素之一[4-5]。琥珀酸通過G蛋白偶聯受體91(G protein-coupled receptor 91,GPR91)促進炎性因子IL-1β釋放,啟動并加速關節滑膜病變[6-7]。知母是歷代治療痹癥的常用高頻中藥,也是治痹經方桂枝芍藥知母湯、白虎加桂枝湯、通陽宣痹湯等關鍵藥物,具有顯著的抗炎、免疫調節、影響皮質激素及血糖水平的作用[8-10]。皂苷是其含量最高、種類最多的成分,具有明顯抗炎、抗氧化、降血糖、降血脂的藥理作用[9],但鮮少有關于知母皂苷抗RA的研究。
1 材料
1.1 動物
32只雄性SPF級SD大鼠,體質量160~200 g,購于四川省醫學科學院實驗動物研究所(動物合格證號0010716)。大鼠均飼養于22 ℃~24 ℃,明暗周期為12 h/12 h的環境中,自由攝食飲水。
1.2 藥品與試劑
知母總皂苷(寶雞辰光生物制藥股份有限公司,批號20160917);醋酸地塞米松(浙江仙琚制藥股份有限公司,批號161231);完全弗氏佐劑(complete Freund's adjuvant,CFA)(sigma公司,貨號F5881-10 ml);GPR91抗體(Abcam公司,批號ab140795);IL-1β ELISA試劑盒(MultiSciences,批號2301B71055);琥珀酸(成都曼斯特生物科技有限公司,批號MUST-11052307);富馬酸(成都瑞芬思生物科技有限公司,批號F-016-170426);琥珀酸脫氫酶測試盒(南京建成生物科技有限公司,批號A022)。
1.3 主要儀器
PV-200足趾容積測量儀,成都泰盟;Agilent1260高效液相色譜儀,美國Agilent公司;Ultimate AQ-C18,月旭科技股份有限公司;CX22型顯微鏡(帶數碼成像系統),德國LEICA公司。
2 方法
2.1 造模與分組
動物適應性喂養3 d后,根據體質量和正常足容積完全隨機分成4組,通過抓鬮確定組名,分別為空白組(NG)、模型組(AA)、陽性組(DXMS,0.0875 mg/kg)、知母總皂苷組(TT,200 mg/kg)每組各8只。除NG組大鼠右后足足跖皮下注射0.1 ml生理鹽水外,其余各組大鼠均于同一位置緩慢注射0.1 ml CFA。造模第14天開始藥物干預,給藥體積為10 ml/kg,NG組和AA組給予蒸餾水,每日1次,連續28 d。
2.2 觀察指標與方法
2.2.1 足腫脹度 造模前測定大鼠右后足足容積2次,計算均值作為正常足容積。造模后每隔6 d于同一位置測定足容積1次。以造模后足容積與正常足容積的差值作為大鼠足腫脹度。
2.2.2 足圍 造模前,采用皮尺測量大鼠造模側足跖部周長2次,求取平均值當作正常足圍。造模后每隔6 d測定大鼠足圍1次,以造模后足圍與正常足圍的差值作為足圍變化。
2.2.3 大鼠踝關節滑膜的病理形態學觀察 表1顯示,末次給藥1 h后處死大鼠,剪取大鼠右后足踝關節,注射4%多聚甲醛溶液于關節腔內并浸泡于固定液中。脫鈣后經石蠟包埋、切片,用蘇木精-伊紅進行染色、封片,最后鏡檢。
2.2.4 外周血清IL-1β含量 末次給藥1 h后取腹主動脈血,3500 r/m離心10 min取上清液,按ELISA試劑盒說明書步驟檢測外周血清中IL-1β含量。

表1 滑膜組織病理評分標準
2.2.5 滑膜組織中琥珀酸脫氫酶活性及琥珀酸、富馬酸含量測定 組織勻漿液制備:將滑膜組織用液氮凍硬后立即研磨成粉,按1∶10的比例(W/V)加入生理鹽水進行勻漿。SDH酶活性檢測:取滑膜組織勻漿液,參照說明書檢測SDH酶活性。琥珀酸、富馬酸含量測定:吸取250 μL勻漿液于EP管中,添加等量0.5 mol/L高氯酸混勻。冰浴10 min后,14000 g 4℃離心20 min,取300 μL上清液于進樣瓶。標準品配制:采用雙蒸水配制琥珀酸(1800 μmol/L)與富馬酸(200 μmol/L)標準品。流動相配制:稱量磷酸二氫鉀加超純水定容,調PH至2.5,過0.45 μm的微孔濾膜,超聲15 min。等度洗脫,流速1 ml/min,波長210 nm,柱溫25 ℃,進樣量10 μL。
2.2.6 免疫組化法檢測滑膜組織GPR91蛋白表達 2.2.3項下石蠟切片經脫蠟、水化處理后,采用3%H2O2阻斷內源性過氧化物酶,檸檬酸緩沖液(pH=6.0)修復抗原。隨后加入兔抗GPR91抗體,4 ℃孵育過夜,加入適量生物素標記的二抗室溫孵育15 min,HRP工作液孵育15 min。最后進行DAB染色,蘇木精復染、脫水、透明、封片、鏡檢。以細胞膜出現棕黃色為陽性表達,采用image-pro Plus 6.0軟件測定GPR91蛋白陽性表達的平均光密度,并用IOD值表示。
2.3 統計學方法
3 結果
3.1 知母總皂苷對模型大鼠足腫脹度及足圍的影響
表2、3顯示,致炎后模型大鼠足部出現明顯紅腫,AA組大鼠足腫脹度逐漸增加,第28天達到峰值;經知母總皂苷治療4周后,大鼠腫脹度較模型組明顯降低(P<0.05)。與NG組比較,AA組大鼠足圍顯著增加(P<0.05),TT組大鼠的足圍自造模后第28天起至實驗結束較AA組有降低趨勢,但差異無統計學意義(P>0.05)。
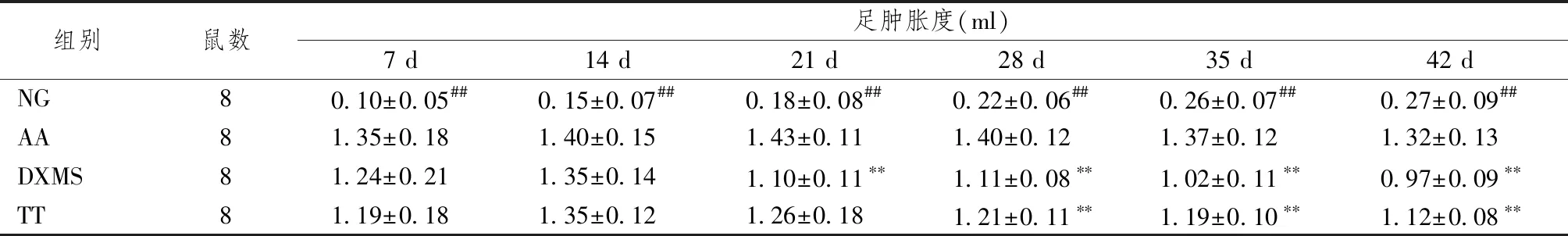
表2 知母總皂苷對AA模型大鼠足腫脹度的影響
注:與空白組比較:##P<0.01;與模型組比較:**P<0.01
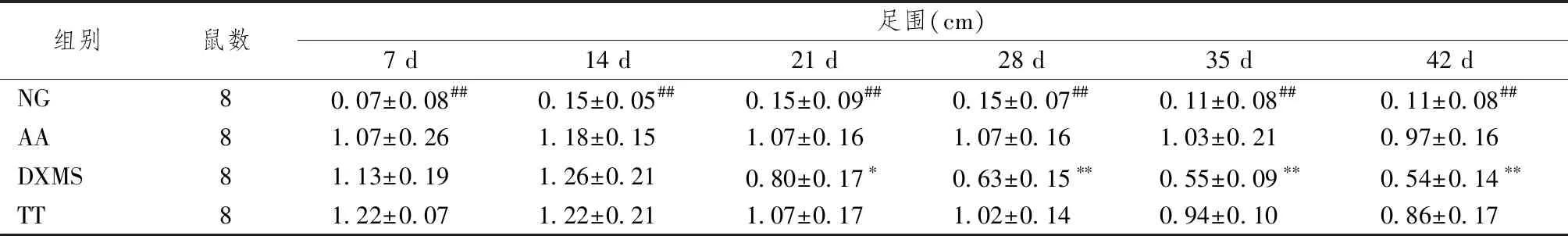
表3 知母總皂苷對AA模型大鼠足圍的影響
注:與空白組比較:##P<0.01;與模型組比較:*P<0.05,**P<0.01
3.2 知母總皂苷對模型大鼠病理形態學影響
圖1表4顯示,NG組踝關節滑膜正常,未見明顯病理改變,AA組大鼠滑膜組織炎性細胞浸潤嚴重,滑膜細胞增生較明顯。藥物干預后,大鼠滑膜炎性細胞浸潤與滑膜細胞增生均明顯減輕(P<0.05)。
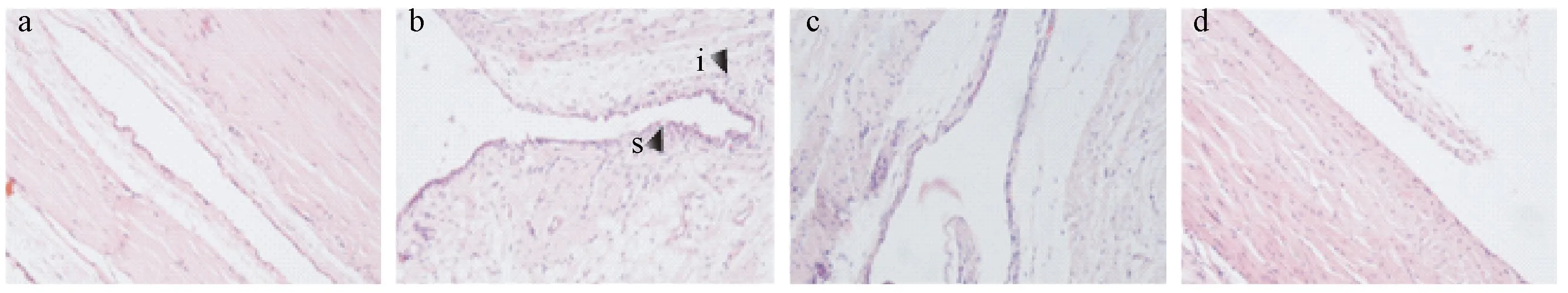
注:a.空白組;b.模型組;c.陽性組;d.知母總皂苷組;s.滑膜細胞增生,i.炎性細胞浸潤圖1 大鼠踝關節病理變化(HE,20×10)
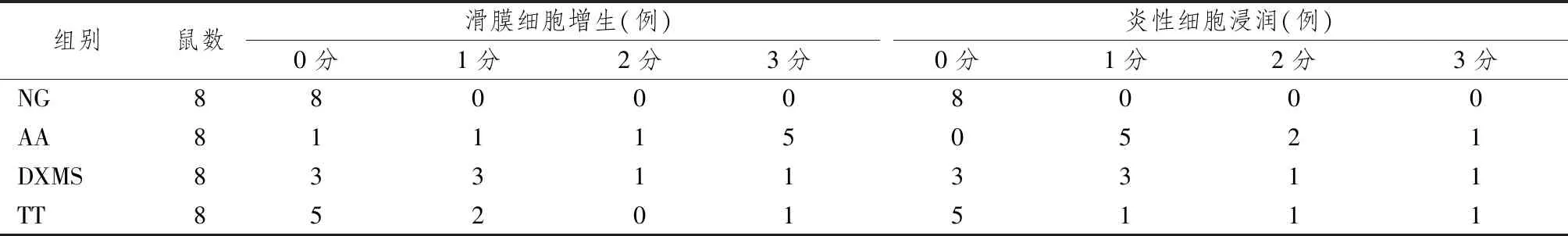
表4 知母總皂苷對AA模型踝關節病理的影響比較(分)
3.3 知母總皂苷對模型大鼠血清IL-1β水平的影響
表5顯示,AA組血清IL-1β水平顯著高于NG組(P<0.01)。與AA組比較,TT組大鼠血清IL-1β水平明顯降低(P<0.05)。

表5 知母總皂苷對大鼠血清IL-1β含量及滑膜組織琥珀酸、富馬酸含量、SDH酶活性的影響
注:與空白組比較:#P<0.05,##P<0.01;與模型組比較:*P<0.05,**P<0.01(n代表例數)
3.4 知母總皂苷對滑膜組織琥珀酸堆積影響
表5顯示,與NG組比較,AA組滑膜組織中琥珀酸含量明顯升高(P<0.05)。與AA組比較,TT組滑膜組織中琥珀酸積累被顯著抑制(P<0.05)。
3.5 知母總皂苷對滑膜組織SDH酶活性及富馬酸含量的影響
表5顯示,與NG組比較,AA組滑膜樣本中的富馬酸含量明顯降低(P<0.05),SDH酶活性雖有降低趨勢,但差異無統計學意義(P>0.05)。與AA組比較,TT組滑膜樣本中SDH酶活性及富馬酸含量均有升高趨勢,但差異無統計學意義(P>0.05)。
3.6 知母總皂苷對滑膜組織GPR91蛋白表達的影響
圖2顯示,與NG組比較,AA組滑膜樣本中GPR91蛋白表達顯著增強(P<0.05)。與AA組比較,TT組GPR91蛋白水平明顯降低(P<0.05)。
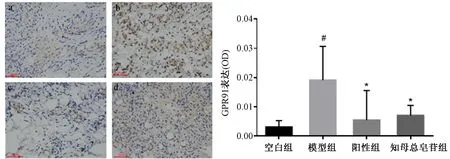
注:與空白組比較:#P<0.05;與模型組比較:*P<0.05。a.空白組;b.模型組;c.陽性組;d.知母總皂苷組。棕黃色代表GPR91,藍色代表細胞核。圖2 知母總皂苷對大鼠滑膜組織琥珀酸含量及GPR91表達的影響(10×10)
4 討論
AA動物模型的病理特征和RA的臨床表現在關節腫脹、滑膜炎癥、炎性細胞浸潤等方面具有高度相似性,且造模方法簡單有效[11]。模型大鼠足腫脹程度和關節滑膜病理形態學的改變,可以反映藥物的療效和作用強度,因此常用于藥物有效性評價和藥物篩選。我們研究發現,知母總皂苷不僅可以拮抗CFA所致的模型大鼠足腫脹和足圍異常增大,而且可以改善關節滑膜細胞增生和炎性細胞浸潤,提示知母總皂苷具有改善AA模型大鼠滑膜免疫性炎癥的作用。現代研究發現,關節局部琥珀酸異常堆積參與了RA的發病進程。具體表現為首先胞外琥珀酸與其受體GPR91的結合,引發炎癥級聯反應,釋放如IL-1β、NO、PG等多種炎性介質,啟動或加劇關節滑膜的炎癥反應[6];同時血管生成異常增加促使外周白細胞向關節滑膜的趨向遷移和黏附,加劇滑膜炎性細胞浸潤[12]。我們研究發現,知母總皂苷可以顯著減少模型大鼠滑膜琥珀酸堆積。GPR91是琥珀酸的特異性細胞膜受體,并且在多種炎性免疫相關細胞中表達,包括巨噬細胞、樹突狀細胞(也稱DC細胞)和FLS,參與后續炎癥反應[13]。琥珀酸可增強DC細胞的遷移和抗原提呈能力,GPR91敲除后該作用消失[13]。琥珀酸激活巨噬細胞GPR91受體可導致IL-1β釋放,GPR91激活后可以活化胞內鈣離子信號通路和蛋白激酶C,導致下游多條炎癥信號途徑的激活,促使多種炎癥介質的釋放而放大炎癥效應[15],因此目前GPR91被認為是治療RA的一個潛在靶標[14]。我們研究發現,AA模型大鼠關節滑膜GPR91蛋白顯著高表達,外周血清IL-1β含量顯著增高,經知母總皂苷干預后GPR91蛋白表達顯著降低,外周血清IL-1β水平顯著降低。綜上,知母總皂苷拮抗類風濕關節炎作用與抑制琥珀酸/GPR91/IL-1β信號途徑有關,但對琥珀酸代謝影響不明顯,具體機制有待進一步研究。

