NMHC-ⅡA蛋白的重組表達、多克隆抗體制備及其功能的初步探討
熊 丹,杜 勇,張 華,武 薇,莫紅梅,張秀明△
(1.深圳大學第三附屬醫院醫學檢驗科,廣東深圳 518001;2.上海市(復旦大學附屬)公共衛生臨床中心醫學檢驗科,上海 200433;3.中山大學附屬腫瘤醫院實驗研究部,廣東廣州 510060)
鼻咽癌是來源于人類鼻咽上皮細胞惡性程度較高的頭頸部腫瘤,北美和其他西方國家的白種人每年的發病率低于1/100 000;然而,在中國南方其年發病率可高達25/100 000~30/100 000,其中又以廣東最為常見[1]。由于具有顯著的地方性,鼻咽癌又被稱為“廣東癌”[2]。在中國的華南等高發區,鼻咽癌的組織類型97%以上為未分化癌(WHO Ⅲ型)[3]。EB病毒感染、環境致癌因素以及抑癌基因和原癌基因的突變等多因素、多步驟共同參與了鼻咽癌的發生、發展過程[1]。EB病毒屬人類γ-皰疹病毒亞科淋巴潛隱病毒屬,1997年世界衛生組織國際癌癥研究機構(LARC)的報告中已將EB病毒列為Ⅰ類致癌原[4]。EB病毒在體內主要感染B淋巴細胞和上皮細胞,與伯基特淋巴瘤、霍奇金病、胃癌和鼻咽癌等腫瘤密切相關[5]。
非肌肉肌漿球蛋白重鏈ⅡA(NMHC-ⅡA)由位于22q11.2染色體上的全長1 960個氨基酸的MYH9基因編碼[6],這是一種廣泛表達在細胞質的肌球蛋白,參與多種過程,包括細胞內化學機械力的產生和肌動蛋白細胞骨架的移位[7]。筆者前期研究發現NMHC-ⅡA與病毒糖蛋白gH/gL相互作用介導EB病毒感染鼻咽上皮細胞[8],NMHC-ⅡA是EB病毒進入鼻咽上皮細胞的重要細胞分子。因此制備針對NMHC-ⅡA為靶點的抗EB病毒感染的中和抗體,對于鼻咽癌的靶向治療具有重要意義。本文應用兔多克隆抗體制備技術,制備抗NMHC-ⅡA的特異性抗體,為進一步進行鼻咽癌的分子靶向治療和研究NMHC-ⅡA在鼻咽癌中扮演的角色奠定基礎。
1 材料與方法
1.1材料 收集3例鼻咽炎增生組織(NPN-1、NPN-2、NPN-3,病理診斷為炎癥增生組織)和4例鼻咽癌組織(NPC-1、NPC-1、NPC-3、NPC-4,病理診斷為腫瘤組織)。4株原代鼻咽上皮細胞(N01、N02、N03、N04)、永生化的NP69細胞和BMI1/NPECs在無血清的培養基(KSFM)中培養(InvitroGen,17005~075);鼻咽癌細胞株(C666-1、HK1、SUNE1、SUNE2、CNE1、CNE2)、CNE2-EBV、HNE1-EBV、HK1-EBV和Akata(EBV-eGFP)培養在5%胎牛血清的RPMI 1640培養基中,培養條件為37 ℃、5% CO2。EBV-eGFP的制備如文獻[9]報道,用0.8%羊抗人IgG交聯Akata (EBV-eGFP)細胞表面IgG蛋白,促使EB病毒從潛伏期進入裂解期,從而使病毒顆粒釋放。重組質粒pGEX-4T-1/GST-NMHC-ⅡA-C (amino acids 1665-1960;UniProt entry P35579)由本室構建并保存。實驗動物日本大耳白兔,購買于具有“實驗動物生產許可證”資質的武漢市萬千佳興生物科技有限公司。
1.2儀器與試劑 7900HT Fast Real-time PCR 系統 (Applied Biosystems,USA),電泳儀,水平電泳槽,凝膠成像系統(SynGene),臺式冷凍離心機(Centrifuge 5810,Centrifuge 5417R,Eppendorf),超純水系統(Millipore),磁力攪拌器,分析天平和 pH 計(Mettler Toledo),漩渦振蕩儀(Scientific Industries),超凈工作臺(蘇凈),培養箱(Thermo Forma),普通光學顯微鏡(COIC,XSZ-H),倒置相差顯微鏡(COIC XDS-1B),流式細胞儀(FACS Diva Option,Becton Dickinson,Mountain View,CA)。Trizol試劑(Invitrogen,Grand Island,NY),逆轉錄酶cDNA合成試劑盒(Fermentas,St Leon-Rot,德國),卡那霉素,谷胱甘肽瓊脂糖凝膠珠(Glutathione-Sepharose beads,GE公司),兔IgG(R&D Systems公司),anti-NMHC-ⅡA兔多克隆抗體 (英國Abcam公司),GAPDH 抗體和β-actin 抗體(中國上海康成公司)。
1.3方法
1.3.1重組蛋白的表達、鑒定和純化 將重組質粒pGEX-4T-1/GST-NMHC-ⅡA-C (amino acids 1665-1960;UniProt entry P35579)進行Bam HI和EcoRI雙酶切鑒定,得到的小片段,進行測序和比對。將重組質粒pGEX-4T-1/GST-NMHC-ⅡA-C和對照質粒pGEX-4T-1/GST轉化入E.coli BL21感受態細胞中,涂布于含有卡那霉素(50 μg/mL)抗性的LB平板,37 ℃過夜培養,得到重組蛋白表達菌株,然后加入500 μM IPTG誘導表達5 h后,離心收集沉淀。在沉淀中加入細菌裂解液,超聲破碎后,離心,收集上清,用SDS-PAGE的方法檢測目的蛋白。用谷胱甘肽瓊脂糖凝膠珠(Glutathione-Sepharose beads,GE公司)純化NMHC-ⅡA重組蛋白,參照產品說明書操作。
1.3.2多克隆抗體的制備、純化和效價測定 以日本大耳白兔為免疫動物,免疫前取1 mL兔血清為對照組。將濃縮后的NMHC-ⅡA蛋白作為免疫原以1.0毫克/只的劑量通過背部及皮下多點注射到2只日本大耳白兔。首次免疫與加強免疫總共4次,末次免疫7 d后對日本大耳白兔進行頸動脈取血,分別收集2只日本大耳白兔免疫后的血清各30 mL和12 mL,然后進行純化。期間,采用間接ELISA的方法檢測從日本大耳白兔耳緣靜脈取血中該抗體的效價。采用SDS-PAGE檢測純化后的兔抗NMHC-ⅡA抗體濃度。
1.3.3Real-time PCR和Western-Blot檢測 用Trizol試劑(Invitrogen,Grand Island,NY)從4株原代鼻咽上皮細胞、3株永生化鼻咽上皮細胞株、6株鼻咽癌細胞株、3例鼻咽炎增生組織和4例鼻咽癌組織中提取總RNA,然后用逆轉錄酶cDNA合成試劑盒(Fermentas,St Leon-Rot,德國)進行逆轉錄成cDNA,用Real-time PCR方法檢測鼻咽細胞株和組織中NMHC-ⅡA的mRNA水平的表達情況。NMHC-ⅡA、GAPDH的引物序列及Real-time PCR反應條件同文獻報道一致[10]。Western-Blot檢測方法參照文獻[11]采用的抗體包括anti-NMHC-ⅡA兔多克隆抗體(英國Abcam公司)、制備的anti-NMHC-ⅡA兔多克隆抗體、GAPDH抗體和β-actin抗體(中國上海康成公司),以GAPDH和β-actin抗體為內參照。
1.3.4抗體阻斷試驗 用制備的不同濃度的多克隆NMHC-ⅡA抗體(100、50和25 μg/mL)和100 μg/mL的對照IgG(購買于R&D Systems公司)在4 ℃預處理細胞1 h,不除去抗體,然后在37 ℃條件,EB病毒感染細胞3 h,接著用1×SA洗2次,加1 mL的KSFM培養基培養24 h,用流式細胞儀檢測24 h內EB病毒感染細胞的平均熒光強度。
1.3.5流式細胞儀分析 為檢測EB病毒感染細胞的百分率和平均熒光強度,細胞在感染后24 h內被胰蛋白酶消化成單個細胞懸液,然后采用流式細胞儀(FACS Diva Option;Becton Dickinson)進行檢測。

2 結 果
2.1NMHC-ⅡA mRNA在鼻咽細胞和組織中廣泛表達 實時熒光定量PCR結果顯示,原代培養的鼻咽上皮細胞、永生化鼻咽上皮細胞株、鼻咽癌細胞株、鼻咽炎增生組織和鼻咽癌組織在轉錄水平上都表達NMHC-ⅡA。4株原代培養的鼻咽上皮細胞NMHC-ⅡA的mRNA表達比鼻咽癌細胞株中的表達都高,除了C666-1外。永生化鼻咽上皮細胞株中,NP69的表達較低,另外2株永生化細胞株比較高。在鼻咽癌細胞株中,C666-1的NMHC-ⅡA的mRNA表達最高,其次是CNE2。與3例鼻咽炎增生組織相比,4例鼻咽癌組織中,2例鼻咽癌組織中NMHC-ⅡA的mRNA表達水平較高,另外2例相差不大(圖1)。

注:A表示NMHC-ⅡA mRNA在原代培養鼻咽上皮細胞、永生化鼻咽上皮細胞和鼻咽癌細胞中廣泛表達;B表示NMHC-ⅡA mRNA在鼻咽炎增生組織和鼻咽癌組織中廣泛表達
圖1NMHC-ⅡAmRNA在鼻咽細胞和組織中廣泛表達
2.2NMHC-ⅡA-pGEX-4T-1原核表達載體的鑒定及NMHC-ⅡA重組蛋白的誘導表達、純化 重組質粒pGEX-4T-1/GST-NMHC-ⅡA-C 進行雙酶切后得到小片段的大小為1 000 bp左右,經過測序和比對,確定其序列與NCBI數據庫中MYH9基因序列一致(圖2A)。含有pGEX-4T-1/GST-NMHC-ⅡA-C和pGEX-4T-1/GST重組質粒的E.coli BL21經IPTG誘導表達后,經SDS-PAGE電泳,結果顯示在相對分子質量為60×103左右處有明顯的蛋白誘導條帶,為GST-NMHC-ⅡA的重組蛋白;相對分子質量為25×103左右處有明顯的蛋白誘導條帶,為GST蛋白(圖2B)。將原核表達產物裂解后用谷胱甘肽瓊脂糖凝膠珠進行NMHC-ⅡA重組蛋白純化,通過SDS-PAGE實驗進行鑒定,初步純化了GST-NMHC-ⅡA的融合蛋白(圖2C),進一步大批量的培養細菌并純化蛋白,得到了大于2 mg,濃度為1.0 mg/mL的純化蛋白,經免疫印跡鑒定,為GST-NMHC-ⅡA的融合蛋白(圖2D)。

注:圖A為用Bam HI和EcoRI 對重組質粒pGEX-4T-1/GST-NMHC-ⅡA-C 進行雙酶切的鑒定,M為DNA DL15000 marker和DNA DL2000 marker,1為重組質粒pGEX-4T-1/GST-NMHC-ⅡA-C,2為用Bam HI和EcoRI 對重組質粒pGEX-4T-1/GST-NMHC-ⅡA-C 進行酶切的結果;圖B為GST-NMHC-ⅡA和GST蛋白的表達,M為Marker,1為GST-NMHC-ⅡA的重組蛋白,2為GST蛋白;圖C為GST-NMHC-ⅡA和GST蛋白的純化,M為Marker,1為GST-NMHC-ⅡA的重組蛋白,2為GST蛋白;圖D為大批量制備GST-NMHC-ⅡA重組蛋白的鑒定
圖2NMHC-ⅡA-pGEX-4T-1原核表達載體的鑒定及NMHC-ⅡA重組蛋白的誘導表達、純化
2.3兔抗NMHC-ⅡA多克隆抗體的制備及效價測定 將NMHC-ⅡA蛋白作為免疫原免疫日本大耳白兔,將免疫后的血清通過間接ELISA方法測得抗NMHC-ⅡA血清的效價均為1 000 000(圖3A)。采用間接ELISA方法檢測來源于1號日本大耳白兔的血清、洗脫液和純化抗體的效價分別是1∶100 000、1∶500和1∶100 000。來源于2號日本大耳白兔的血清、洗脫液和純化抗體的效價分別是1∶1 000 000、1∶500和1∶1 000 000(圖3B)。SDS-PAGE檢測純化后的兔抗NMHC-ⅡA抗體濃度分別是600 μg/mL和1.35 mg/mL(圖3C)。
2.4采用制備的兔抗NMHC-ⅡA抗體檢測鼻咽癌細胞株和永生化鼻咽上皮細胞株中NMHC-ⅡA蛋白的表達 采用制備得到的1號抗體(編號為S3633-1)和2號抗體(編號為S3633-2)檢測鼻咽癌細胞株中NMHC-ⅡA的蛋白表達情況,發現2株抗體能檢測到鼻咽癌細胞株中NMHC-ⅡA的表達(圖4A)。與商業化NMHC-ⅡA抗體相比,制備的抗體也能檢測到永生化鼻咽上皮細胞株中NMHC-ⅡA蛋白的表達;商業化的抗體和制備的抗體的使用濃度均為1∶1 000,表明制備的抗體有良好的特異度和靈敏度(圖4B)。采用Western-blot方法檢測鼻咽癌細胞株和穩定表達EB病毒的鼻咽癌細胞株中NMHC-ⅡA的表達情況,發現EB病毒的感染并不影響NMHC-ⅡA蛋白的表達(圖4C)。

注:圖A為采用ELISA方法檢測來源于2只日本大耳白兔的抗血清抗體的效價,1為1號日本大耳白兔,2為2號日本大耳白兔;圖B為采用ELISA方法檢測2株純化抗體的效價,1為1號日本大耳白兔,2為2號日本大耳白兔,a為血清;b為洗脫液;c為純化抗體;圖C為SDS-PAGE檢測純化后的NMHC-ⅡA抗體濃度,1為來源于1號日本大耳白兔的純化抗體,2為來源于2號日本大耳白兔的純化抗體
圖3兔抗NMHC-ⅡA多克隆抗體的效價及特異性檢測
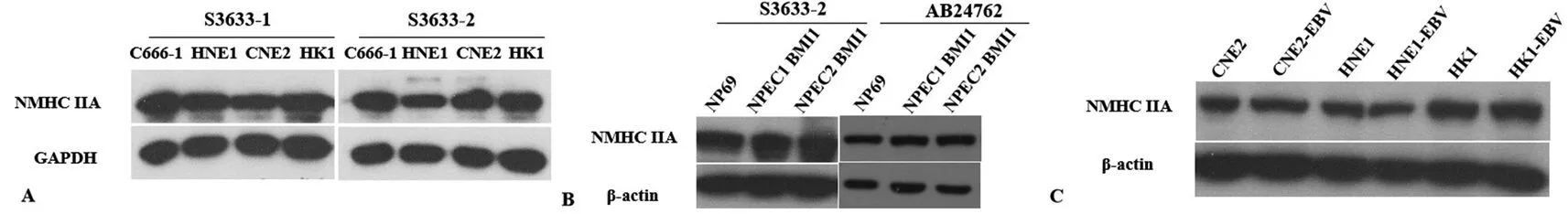
注:圖A為采用1號抗體(編號為S3633-1)和2號抗體(編號為S3633-2)檢測鼻咽癌細胞株中NMHC-ⅡA的蛋白表達情況;圖B為采用2號抗體(編號為S3633-2)和商業化抗體(編號為AB24762)檢測永生化鼻咽上皮細胞中NMHC-ⅡA的蛋白表達情況;圖C為采用2號抗體(編號為S3633-2)檢測鼻咽癌細胞株和用EB病毒感染鼻咽癌細胞株建立的穩定表達EB病毒的鼻咽癌細胞株中NMHC-ⅡA的蛋白表達情況
圖4制備的兔抗NMHC-ⅡA抗體檢測鼻咽癌細胞株和永生化鼻咽上皮細胞株中NMHC-ⅡA蛋白的表達

注:A為熒光顯微鏡觀察EB病毒或者腺病毒感染預先與不同濃度的中和抗體NMHC-ⅡA孵育后永生化鼻咽上皮細胞的代表性圖片;B、C為EB病毒或者腺病毒感染預先與不同濃度的中和抗體NMHC-ⅡA孵育后永生化鼻咽上皮細胞的感染效率及柱狀圖;數據顯示平均值±標準差(n=2),以對照組IgG感染效率為100%,其余的與其比較所得到的值;*P<0.05,**P<0.01
圖5NMHC-ⅡA中和抗體抑制EB病毒感染的效率圖
2.5NMHC-ⅡA抗體可以有效地抑制EB病毒的感染 研究NMHC-ⅡA在EB病毒感染鼻咽癌上皮細胞中是否發揮作用。分別將25、50、100 μg/mL制備的多克隆抗體NMHC-ⅡA預先與永生化鼻咽細胞株NPEC2-BMI1孵育后,然后通過熒光顯微鏡觀察和流式細胞儀檢測,發現兔抗NMHC-ⅡA多克隆抗體可以降低EB病毒的感染效率,并呈劑量依賴性。100 μg/mL劑量的多克隆抗體減少EB病毒的感染效率達54.84%。相反,該抗體對腺病毒的感染并沒有影響。無論是顯微鏡觀察GFP的表達分布和流式檢測EB病毒的感染效率,結果均一致(圖5)。
3 討 論
NMHC-ⅡA在卡波氏肉瘤病毒(KSHV)[11]和人類單純皰疹病毒(HSV-1)[12]進入宿主細胞發揮著非常重要的作用。NMHC-ⅡA是HSV-1感染上皮細胞的受體,并且發現NMHC-ⅡA有利于HSV-1與上皮細胞的融合[12]。文獻報道NMHC-ⅡA是豬繁殖和呼吸綜合征(PRRS)病毒感染的重要細胞因子,重組NMHC-ⅡA蛋白C末端結構域(命名為PRA)通過與病毒糖蛋白5直接相互作用阻斷豬繁殖和呼吸綜合征病毒(PRRSV)的內化,進一步發現PRRSV與可溶性PRA蛋白的預孵育對病毒有抑制作用,并呈劑量依賴性。PRA還具有抑制PRRSV基因型1和2的不同菌株感染的廣譜能力[13]。筆者前期研究表明EB病毒gH/gL與NMHC-ⅡA相互作用促進EB病毒有效進入上皮細胞,并且抑制內源性NMHC-ⅡA的表達可減少EB病毒的結合[8],說明內源性NMHC-ⅡA在EB病毒感染永生化鼻咽上皮細胞中發揮著重要的作用。筆者前期通過抗體阻斷實驗發現制備的多克隆抗體NMHC-ⅡA可以降低EB病毒的感染效率,并呈劑量依賴性,但對腺病毒的感染沒有影響[8]。本研究采用不同的劑量也得到了相同的結果,同樣采用的是重組蛋白C末端區域,進一步表明內源性NMHC-ⅡA在EB病毒感染永生化的鼻咽上皮細胞中發揮著重要的作用。能阻斷NMHC-ⅡA與EB病毒gH/gL相互作用的抑制劑可能阻止EB病毒進入或阻止永生化的鼻咽上皮細胞向鼻咽癌轉化。因此制備針對NMHC-ⅡA為靶點的抗EB病毒感染的中和抗體,對于鼻咽癌的靶向及其抗病毒治療具有重要意義。
采用Akata EBV(+)細胞制備的EB病毒攜帶綠色熒光蛋白,從而為檢測病毒感染細胞提供方便。筆者前期研究發現EB病毒感染永生化鼻咽上皮細胞形成球形細胞后,與沒感染前,NMHC-ⅡA表達無明顯變化[8]。筆者采用高滴度的EB病毒感染鼻咽癌細胞株,然后用G418篩選,獲得了穩定表達EB病毒的鼻咽癌細胞株。采用Western-blot方法檢測穩定表達EB病毒的鼻咽癌細胞株中NMHC-ⅡA蛋白的表達情況,發現與對照組相比,NMHC-ⅡA蛋白的表達沒有增加,表明EB病毒的感染并不能影響NMHC-ⅡA蛋白的表達,與筆者前期研究一致。
最近,NMHC-ⅡA在腫瘤細胞中的作用越來越受關注。研究發現MicroRNA-647通過靶向調控SRF-MYH9軸,從而抑制胃癌細胞的侵襲和轉移[14]。一項研究表明長鏈非編碼RNA PTCSC2與MYH9蛋白結合,更易發生甲狀腺癌[15]。另一項研究發現S100A4-Myh9軸通過誘導轉化生長因子β介導的上皮間充質轉移促進胃癌細胞的遷移和侵襲[16]。筆者研究發現高表達的NMHC-ⅡA可以作為預示膀胱癌病人不良預后的分子標志物,沉默內源性NMHC-ⅡA的表達后能降低膀胱癌細胞侵襲及轉移能力[10]。然而,在頭頸部鱗癌中,NMHC-ⅡA被確認為腫瘤抑制因子[17]。文獻報道NMHC-ⅡA S1943位點的磷酸化有助于調節細胞外基質降解從而促進腫瘤細胞的侵襲和轉移[18]。
本研究發現NMHC-ⅡA mRNA在原代培養、永生化鼻咽上皮細胞株、鼻咽癌細胞株及鼻咽組織、鼻咽癌組織中都有表達,并且NMHC-ⅡA蛋白在原代培養、永生化鼻咽上皮細胞株和鼻咽癌細胞株中都有表達,表明這種蛋白廣泛存在于鼻咽上皮細胞,該蛋白及其磷酸化水平在鼻咽癌中發揮的作用又是如何,值得進一步研究。
4 結 論
筆者成功實現了人源NMHC-ⅡA蛋白的重組表達、純化及高效價多克隆抗體的制備。該多克隆抗體能識別細胞中內源表達的NMHC-ⅡA蛋白。同時,發現NMHC-ⅡA多克隆抗體可以有效地抑制EB病毒在永生化鼻咽上皮細胞中的感染,為進一步研究NMHC-ⅡA相關功能奠定了重要基礎。

