富氫燃氣與空氣低壓補燃特性研究
楊進慧,王朝暉,田 原,許曉勇
(北京航天動力研究所,北京 100076)
0 引言
氫氧火箭發動機利用少量的氫和氧在燃氣發生器內燃燒,產生一定溫度的富氫燃氣去驅動渦輪做功,然后經排氣管排入大氣。火箭飛行過程中環境壓力一直下降,富氫燃氣排放后與空氣發生低壓補燃,直接改變發動機周圍的熱環境,進而影響發動機各組件性能[1-2],為了保證發動機及火箭的正常工作,需開展氫燃氣與空氣的低壓補燃特性研究。
國內外學者對氣氫-空氣在常壓及高壓下的可燃極限研究較多[3-5],但對于低壓環境下的氣氫燃燒特性研究很少。德國卡爾斯魯厄理工學院的M.Kuznetsov開展了關于常溫氣氫-空氣的可燃極限及火焰的擴展速度試驗研究[6],研究表明對于常溫氫氣和空氣的混合氣,當初始壓力低于8 000 Pa(電火花塞點火)或者低于2 500 Pa(電熱金屬絲點火)時,不論氫濃度為多少,都無法被點燃。文獻[7]給出了20~60 kPa壓力下氣氫-空氣不同比例混合氣的最小點火能量,但未給出氣氫與空氣的可燃極限。
目前國內外對于富氫燃氣與空氣的低壓補燃特性尚未有明確的認識,本文通過試驗及仿真研究了低于標準大氣壓工況下不同燃氣溫度、燃氣組分對于富氫燃氣補燃特性的影響,為研究富氫燃氣與空氣的低壓補燃邊界提供了參考。
1 試驗系統
采用氣氫-氣氧燃氣發生器試驗系統開展富氫燃氣與空氣低壓補燃特性研究,試驗系統主要由真空艙、燃氣發生器、氣氫氣氧供應、調節控制系統、吹除系統、電火花塞以及壓力、溫度傳感器等組成,如圖1所示。
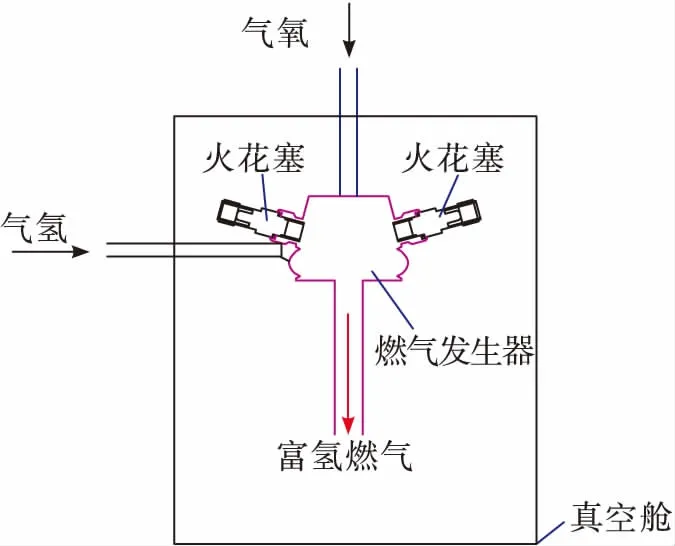
圖1 試驗系統示意圖Fig.1 The experimental system
燃氣發生器流量變化范圍2~20 g/s,混合比變化范圍0.5~1.4,在燃氣發生器出口轉接了一段引出管,引出管通徑10 mm,長度120 mm,在引出管出口前方約80 mm正對位置設有熱電偶用來測量燃氣溫度。
2 試驗結果及分析
表1和圖2為富氫燃氣與空氣低壓補燃特性研究的試驗工況及結果,圖2(a)為明亮黃色火焰,認為其發生補燃,圖2(b)為無色透明火焰,認為其不發生補燃。

圖2 富氫燃氣與空氣補燃特性試驗Fig.2 Recombustion experiment of hydrogen-rich gas and air
在常壓空氣狀態,通過不斷變化混合比調整富氫燃氣溫度,研究富氫燃氣與常壓空氣發生補燃的溫度邊界,從表1可以看出,在富氫燃氣溫度高于932 K時發生補燃,低于877 K時不發生補燃。
保持富氫燃氣溫度高于950 K,逐步降低真空艙壓力,從表1可以看出,當氣壓降至60 kPa時候,富氫燃氣仍能夠與空氣發生補燃,但當氣壓繼續降至30 kPa時,富氫燃氣與空氣不發生補燃。

表1 富氫燃氣與空氣補燃特性試驗結果Tab.1 Results of recombustion experiment for hydrogen-rich gas with air at sub-atmospheric pressures
3 數值仿真分析
3.1 理論模型
利用FLUENT商業軟件,選用軸對稱模型,通過求解使用k-ε湍流模型的Navier-Stokes方程組對富氫燃氣與空氣補燃特性進行數值模擬,仿真模型如圖3所示。模型共劃分結構網格5.9萬個,在燃氣出口及引出管壁面處對網格進行加密。入口邊界采用質量入口,給定入口水力直徑、湍流強度、燃氣溫度和組分;出口邊界條件采用壓力出口邊界,壁面采用無滑移、絕熱條件。
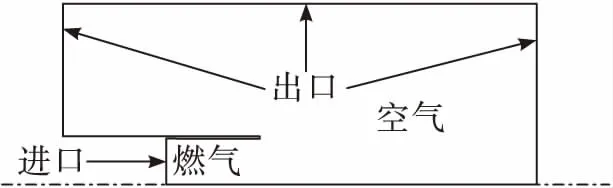
圖3 數值仿真模型Fig.3 Numerical simulation model
火焰的自點火、熄滅等特征需要詳細的化學反應機理對燃燒過程進行深入演繹,氫氧詳細反應機理的研究與簡化已經較為深入和廣泛[8-12]。化學反應機理中包括了化學反應中主要組分和基元反應,本文選用8種組分、18個主要化學反應的有限速率模型,化學反應機理如下:
H2+O2=OH+OH H2+OH=H2O+H
H+O2=OH+O H2+O=OH+H
H+O2+M=HO2+M H+O2+O2=HO2+O2
OH+HO2=H2O+O2H+HO2=OH+OH
O+HO2=O2+OH OH+OH=O+H2O
H2+M=H+H+M O2+M=O+O+M
H+OH+M=H2O+M H+HO2=H2+O2
HO2+HO2=H2O2+O2H2O2+M=OH+OH+M
H2O2+H=HO2+H2H2O2+OH=H2O+HO2
其中M為第三載體。
有限速率化學機制通過組分濃度和化學反應動力學機理直接求解各組分生成和消耗速率,再經單獨確定化學反應時間尺度計算時間步長內的組分濃度變化[13-14]。對于一個由NR個反應、總組分數為N的化學反應系統,組分i總的生成率
(1)
式中:Ri,r為第r個反應中組分i的Arrhenius摩爾生成率;Mw,i為組分i的摩爾質量。
第r個反應方程
(2)
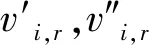
將質量作用定律用于每一個基元反應,對其求和,在第r個反應中,組分i的生成和消耗的摩爾速率
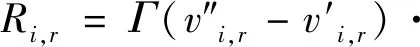
(3)
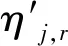
反應r的正向反應速率常數kf,r由Arrhenius公式計算
kf,r=AfTβfe-Ef/RT
(4)
式中:Af為指前因子;βf為溫度指數;Ef為反應活化能;R為通用氣體常數;T為介質溫度。
逆向反應常數kb,r可以根據以下關系式從正向反應速率常數計算
(5)
式中Kr為化學平衡常數,按下式計算
(6)
其中
(7)
(8)
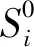
3.2 試驗工況仿真分析
燃燒過程可以根據基元反應的化學狀態的作用和順序大致分成三類:起始反應、鏈式分支反應和終止反應。其中鏈式分支反應生成大部分自由基,主要有H,O,HO2和OH等,這些基元反應持續放熱才能維持火焰傳播或擴散時不會熄滅。H+O2=OH+O已被很多研究證實為氫氧燃燒中最活躍最重要的鏈式分支反應[9-10,15-16],故而本文通過比較不同工況下該反應的化學反應速率研究富氫燃氣與空氣的補燃特性。
針對試驗工況,分別給定燃氣溫度600 K,800 K,950 K和1 200 K進行常壓下的富氫燃氣與空氣補燃仿真分析。燃燒仿真選用FLUENT中層流有限速率模型/渦耗散模型計算反應速率,由Arrhenius公式可知燃氣溫度直接影響化學反應速率常數,如圖4所示,燃氣溫度升高,燃氣與空氣的反應速率呈指數增長,且火焰面向上游移動,與試驗中高溫燃氣才發生補燃現象規律相符。
保持燃氣溫度950 K不變,降低環境壓力,分別計算101 kPa,60 kPa,30 kPa和10 kPa下的富氫燃氣補燃情況。如圖5所示,隨著環境壓力降低,氫氧濃度下降,燃氣出口速度增大,故而化學反應速率下降,火焰面向下游移動,與試驗中高背壓環境下富氫燃氣才發生補燃現象相符[17]。
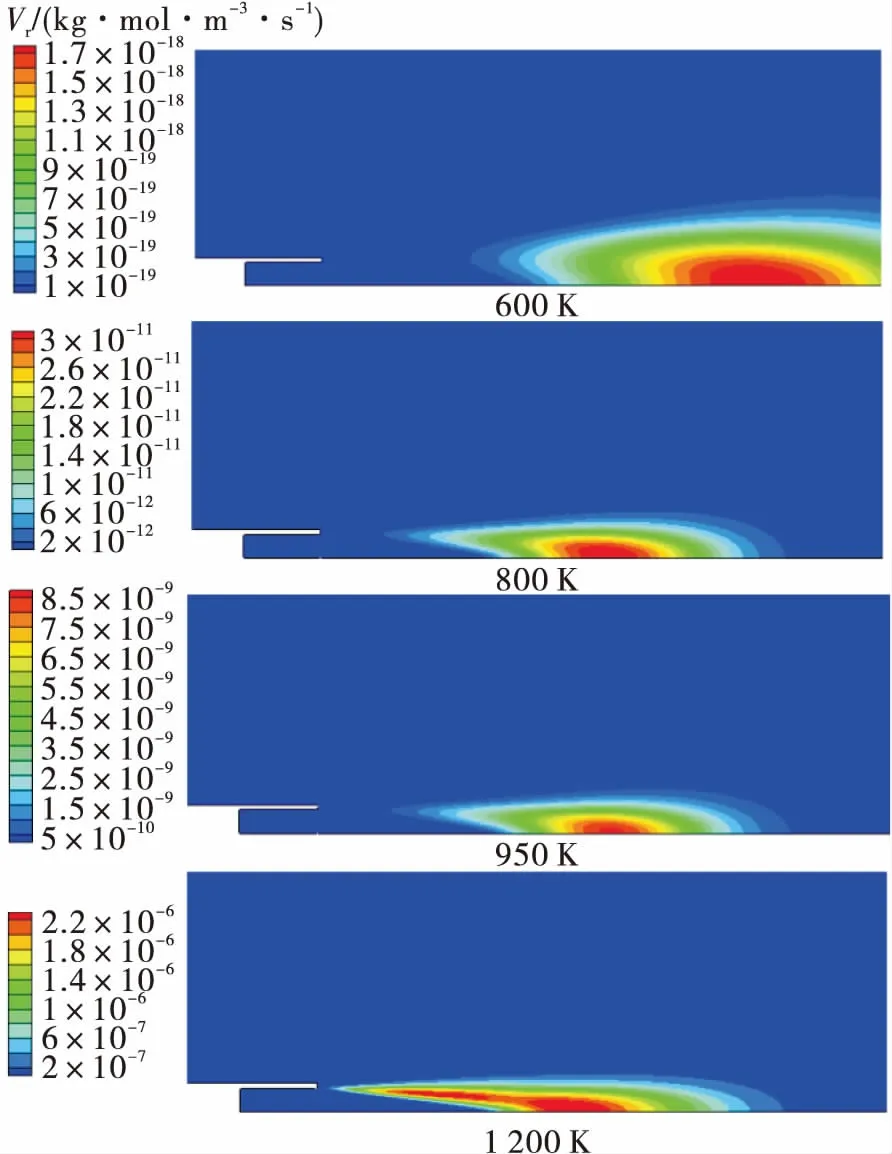
圖4 不同燃氣溫度下的化學反應速率Fig.4 Reaction rate of hydrogen-rich gas under different temperatures
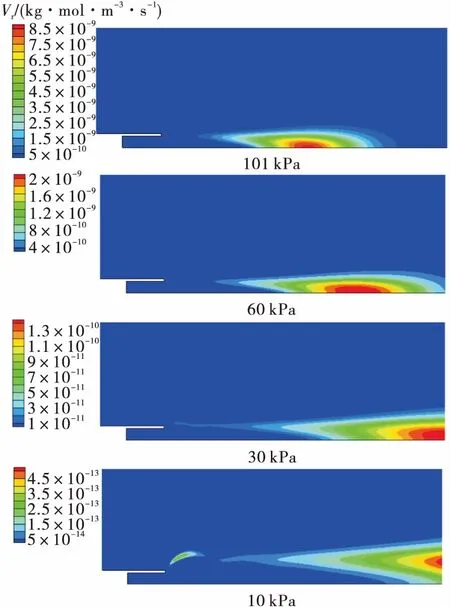
圖5 不同環境壓力下的化學反應速率Fig.5 Reaction rate at different sub-atmospheric pressures
綜合對比圖4、圖5和表1可知,化學反應速率隨燃氣溫度和環境壓力變化劇烈,在最大化學反應速率超過10-9情況下比較容易觀測到宏觀的富氫燃氣與空氣的補燃現象,可以進一步通過H+O2=OH+O的最大化學反應速率研究不同燃氣溫度、氫氣含量的富氫燃氣在低壓狀態下與空氣的補燃特性。
3.3 燃氣溫度對富氫燃氣低壓補燃特性的影響
保持燃氣組分不變(燃氣中氫氣摩爾百分比87.4%),分別計算不同燃氣溫度在低壓環境的燃燒流場,如圖6所示。可以看出,隨著環境壓力增高,富氫燃氣與空氣的化學反應速率增大,當環境壓力大于60 kPa時,反應速率增長減緩。燃氣溫度越高,其與空氣發生補燃的臨界壓力越低,即1 200 K燃氣補燃邊界在10 kPa到30 kPa之間,950 K燃氣需超過60 kPa,而800 K燃氣在一個大氣壓下也不會發生補燃。
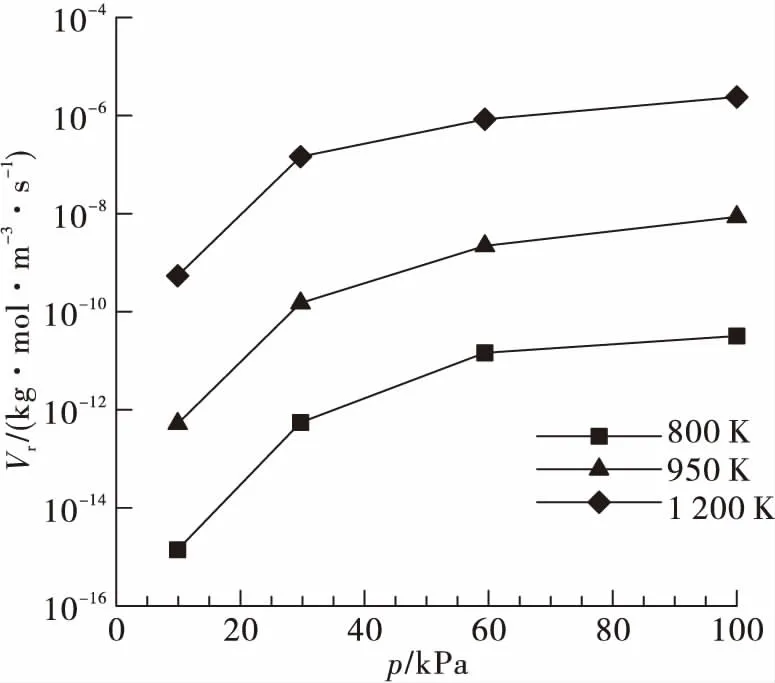
圖6 燃氣溫度對富氫燃氣低壓補燃特性的影響Fig.6 Influence of gas temperature on recombustionproperties of hydrogen-rich gas with air at sub-atmospheric pressures
3.4 氫氣含量對富氫燃氣低壓補燃特性的影響
由Arrhenius公式可知燃氣中氫氣與空氣的當量比對化學反應速率有直接影響,保證燃氣溫度不變(950 K),分別計算不同燃氣組分在低壓環境的燃燒流場。如圖7所示。
在氫含量較多時(燃氣中氫氣摩爾百分比87.4%),隨著環境壓力升高,氫氣與空氣更接近理論化學當量比,故而化學反應速率持續增大;氫含量較低(燃氣中氫氣摩爾百分比30%,50%)時,壓力高于30 kPa后,氫氣與空氣比例變化不大,化學反應速率在10-11~10-10之間。通過分析,燃氣中氫氣含量低于87.4%工況下,無法在低于30 kPa環境下與空氣補燃,燃氣中氫氣含量低于50%工況下在一個大氣壓下也不會發生補燃。

圖7 氫氣含量對富氫燃氣低壓補燃特性的影響Fig.7 Influence of hydrogen ratio on recombution properties of hydrogen-enriched gas with air at sub-atmospheric pressures
4 結論
通過試驗與仿真研究了富氫燃氣與空氣的低壓補燃特性,結論如下:
1)在常壓空氣狀態,混合比約1.2,富氫燃氣溫度高于932 K時發生補燃,低于877 K時不發生補燃。
2)富氫燃氣溫度高于950 K,混合比約1.2,當氣壓降至60 kPa時候,富氫燃氣仍能夠與空氣發生補燃,但當氣壓繼續降至30 kPa時,富氫燃氣與空氣不發生補燃。
3)化學反應速率隨燃氣溫度和環境壓力變化劇烈,在最大化學反應速率超過10-9情況下比較容易觀測到宏觀的富氫燃氣與空氣的補燃現象。
4)燃氣溫度和氫氣含量越高,其與空氣發生補燃的臨界壓力越低,但當壓力低于10 kPa時,燃氣溫度1200 K,氫氣含量87.4%也無法與空氣發生補燃。

