KDM4A調控肝癌細胞增殖機制*
孫黎,戴宇翃,鄒曼,邱紅
(華中科技大學同濟醫學院附屬同濟醫院腫瘤科,武漢 430030)
組蛋白賴氨酸去甲基化酶KDM4家族包括KDM4A-D,在調節染色質結構、基因轉錄及細胞分化中起重要作用。其中對KDM4A/JMJD2A的研究最為深入。目前已知KDM4A的催化酶作用包括H3K9、H3K36、H1.4K26位點的去甲基化[1]。研究發現,KDM4A除催化酶功能之外,還可以與多種轉錄因子及受體結合并影響細胞增殖,而這種功能可能并不依賴于催化酶活性[2]。研究顯示,KDM4A表達水平與肝癌預后密切相關,腫瘤組織高表達KDM4A的患者較低表達組生存率明顯下降。因此,本研究擬分析KDM4A基因表達對肝癌細胞增殖的影響及其作用機制,以期為肝癌的治療提供新靶點。
1 材料與方法
1.1細胞系和材料 Hep3B細胞、293T細胞由華中科技大學同濟醫學院附屬同濟醫院分子醫學中心傳代培養。慢病毒包裝質粒和Myr-AKT質粒由美國Wake Forest大學Hui-Kuan Lin教授惠贈,KDM4A shRNA序列慢病毒載體購自Sigma公司(批號:TRCN0000013496,TRCN0000013497)。抗體均購自Santa Cruz公司,包括:-Actin抗體(sc-47778),KDM4A抗體(sc-81302), AKT抗體(sc-5298),P-Akt T308抗體(sc-135650),GSK-3b抗體(sc-377213),P- GSK-3b ser9抗體(sc-11757),HA抗體(sc-7392)。
1.2慢病毒的包裝 常規培養293T細胞,轉染包裝質粒、衣殼質粒、表達質粒三質粒系統。轉染后48~72 h收取含病毒的上清液,經孔徑0.45 μm過濾器過濾備用。
1.3細胞的感染 常規培養Hep3B細胞,感染上述制備的慢病毒。添加感染增強劑Polybrene,保證終濃度為 8 μg·mL-1。病毒感染12 h后,觀察細胞狀態。病毒感染細胞 72 h 后,熒光顯微鏡下觀察細胞,評估慢病毒感染目的細胞的效率。加入2 μg·mL-1Puromycin篩選。
1.4平板克隆形成實驗 取對數生長期各組細胞,分別用0.25%胰蛋白酶消化并吹打成單個細胞,將細胞懸浮在10%胎牛血清DMEM培養液備用。稀釋細胞懸液,以1×103細胞接種含10 mL預溫培養液的6孔板中,輕搖動,使細胞分散均勻。置于37 ℃5%二氧化碳(CO2)培養箱培養2周。培養皿內出現肉眼可見克隆時,終止培養。棄去上清液,磷酸鹽緩沖液(PBS)小心浸洗2次。加4%多聚甲醛5 mL固定細胞15 min。去除固定液,加適量GIMSA染色液染15 min,PBS洗去染色液,空氣干燥。顯微鏡計數克隆數,最后計算克隆形成率。克隆形成率(%)=(克隆數/接種細胞數)×100%。
1.5Western Blot分析 收取各組實驗細胞,提取總蛋白后Western Blot檢測KDM4A、AKT、P-AktT308、GSK-3、P-GSK-3(ser9)等蛋白表達水平,以β-Actin作為內參蛋白,比較各組細胞蛋白表達水平。
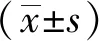
2 結果
2.1肝癌臨床數據分析 臨床數據證實,KDM4A表達與肝癌患者生存率顯著相關。因此,筆者對相關機制進行了研究,以探討肝癌治療的新靶點。隨訪肝癌患者365例,其中女119例(32.6%),男246例(67.4%)。臨床分期Ⅰ期170例(46.6%),Ⅱ期84例(23.0%),Ⅲ期83例(22.7%),Ⅳ期4例(1.1%),N/A24例(6.6%)。觀察終點死亡病例130例(35.6%)。免疫組化分析KDM4A高表達74例(20.3%),KDM4A低表達291例(79.7%)。5年生存率KDM4A高表達組23%,KDM4A低表達組52%(P=1.39×10-5)。(數據來源于網絡公共數據庫“人蛋白圖譜The human protein atlas”,鏈接https://www.proteinatlas.org/ENSG00000066135-KDM4A/pathology/tissue/liver+cancer。),見圖1。

圖1 腫瘤組織高表達KDM4A組與低表達KDM4A組生存率比較(P=1.39×10-5)
Fig.1ComparisonofthesurvivalratebetweenKDM4AoverexpressiongroupandKDM4Alow-expressiongroup(P=1.39×10-5)
2.2KDM4A基因knockdown抑制肝癌細胞Hep3b增殖 見圖2,Western Blot驗證shKDM4A#1和shKDM4A#2細胞系中KDM4A的表達較對照組明顯下降。平板克隆形成實驗肉眼可見,與對照組比較,兩個shKDM4A細胞系形成的克隆面積小,數目少。以對照組為基礎,計算相對克隆形成率。結果顯示,shKDM4A#1和shKDM4A#2組克隆形成率顯著低于shctr組,P<0.01(t=2.85)和P<0.01(t=3.46)。
2.3KDM4A基因敲除抑制AKT/GSK-3β通路蛋白表達 KDM4A基因敲除后可以觀察到肝癌細胞AKT磷酸化水平明顯下降。AKT下游信號P-GSK-3 ser蛋白表達水平顯著下降。實驗以β-Actin為內參(圖3)。
2.4shKDM4A細胞中高表達Myr-AKT能夠逆轉KDM4A對Hep3B細胞增殖的影響 在KDM4A knockdown Hep3b細胞中穩定高表達AKT持續活化的Myr-AKT,可觀察到與轉染vector相比細胞克隆形成數目明顯增多(P<0.01,t=3.30)。而shKDM4A+vec對比ShCtr克隆形成數目明顯減少(P<0.01,t=2.67),與前期實驗結果一致(圖4)。
3 討論
組蛋白賴氨酸殘基的甲基化狀態可以調節染色質空間結構,是最為重要的組蛋白轉錄后修飾形式。在腫瘤的發生過程中存在多種賴氨酸甲基化異常,因此認為腫瘤發病與組蛋白賴氨酸基團甲基化/去甲基化調節失衡有關。KDM4/JMJD2家族主要催化H3K9、H3K36、H1.4K26位點去甲基化[1-2]。因此,近年來越來越多的研究關注KDM4/JMJD2與腫瘤相關性,其中對KDM4A/JMJD2A的研究最為深入。多項研究發現,KDM4A/JMJD2A、KDM4B/JMJD2B及KDM4C/JMJD2C在多種腫瘤中高表達,對腫瘤細胞增殖至關重要,包括乳腺癌、結直腸癌、前列腺癌、肺癌等其他多種腫瘤。KDM4/JMJD2家族也參與調節轉移因子,例如KDM4A/JMJD2A可以與雄激素受體、雌激素受體以及P53結合并影響其功能,但該過程多依賴于KDM4A催化功能。也有研究發現KDM4A以獨立于催化組蛋白去甲基化功能之外的機制調控細胞增殖和分化,如KDM4A能夠抑制53BP1的募集而影響DNA損傷修復。這為進一步探索KDM4A調控腫瘤細胞增殖的機制提供了新的線索[2-3]。目前組蛋白乙酰化酶及DNA甲基轉移酶抑制劑已經被美國食品藥品管理局(FDA)批準應用于腫瘤治療。針對組蛋白甲基化酶及去甲基化酶的靶向藥物也有望應用于臨床治療[4]。

A.免疫印跡實驗顯示成功建立兩個KDM4A knockdown細胞系;B.克隆形成實驗:10 cm培養皿分別培養3組細胞,2周后觀察克隆形成情況;C.相對克隆形成率分析結果;shKDM4A#1與shCtr比較,*1P<0.01;shKDM4A#2與shCtr比較,*2P<0.01
圖2 Hep3b細胞中低表達 KDM4A抑制肝癌細胞克隆形成能力實驗結果
A.Western blot confirmed KDM4A expression level in the two KDM4A knockdown cell lines;B.colony formation assay: clone formation condition after the three groups of cells were cultured for 2 weeks in 10 cm dishes;C.analysis results of relative colony formation rate; Compared with shCtr group,*1P<0.01;compared with shCtr group,*2P<0.01
Fig.2InhibitionoflowexpressionofKDM4AinHep3bcellsontheclonalformationofhepatocellularcarcinomacells

圖3 KDM4A敲除抑制AKT激活實驗結果
Fig.3InhibitonofKDM4AknockdownonAKTactivation
我國肝癌發病率及死亡率占全球一半以上。肝癌早期診斷困難,大部分患者確診時已是晚期,總體5年生存率僅10.1%。由于治療藥物個體選擇性差且不良反應大,進展期肝癌治療受到很大限制。2006年索拉菲尼被批準應用于肝癌,但對總體生存期的延長并不理想[5]。肝癌是一種腫瘤異質性明顯的疾病。個體之間腫瘤細胞形態、微環境、遺傳易感性及信號轉導通路均有差異。因此基于個體差異進行分子學分型有利于為患者提供更合適的藥物治療,提高疾病控制率。研究腫瘤細胞信號轉導通路的異常可以明確腫瘤的發病機制,同時為個體化治療提供理論依據。原發性肝癌的信號通路異常包括Wnt/β-catenin、 Ras/Raf/Mek/Erk、PI3k/Akt/mTOR、IGF、EGF、VEGF、PDGF等。針對這些分子異常藥物目前在進行臨床前研究,部分藥物已進入臨床試驗階段[6]。
KDM4A并不在所有腫瘤中均一高表達。體外實驗也觀察到KDM4A高表達或敲除并不影響HeLa細胞增殖[7]。因此KDM4A高表達存在組織特異性。而數據庫資料顯示KDM4A表達水平與肝癌的預后密切相關,腫瘤組織高表達KDM4A的患者較低表達組生存率明顯下降。本研究通過體外實驗證實KDM4A敲除肝癌細胞的增殖較對照組明顯下降。這提示在肝癌治療中KDM4A有望成為有效的治療靶點。同時筆者也發現KDM4A通過激活AKT來調控細胞增殖,而該作用并不依賴于其去甲基化酶的活性。通過本研究,明確了KDM4A /AKT信號通路在肝癌發生發展過程中的重要作用,這為肝癌的分子靶向治療提供了新的線索。

A.免疫印跡實驗驗證,shKDM4A細胞中成功高表達磷酸化AKT;B.克隆形成實驗:10 cm培養皿培養細胞2周后觀察的克隆形成情況,3組細胞分別為ShCtr對照、shKDM4A+Vec、shKDM4A+Myr-Akt;C.相對克隆形成率分析結果;與shCtr比較,*1P<0.01;與Vec比較,*2P<0.01
圖4 KDM4A 低表達細胞中高表達Myr-AKT逆轉KDM4A對Hep3B細胞增殖的影響
A.Western blot confirmed the overexpression level of p-AKT in ShKDM4A cells;B.colony formation assay: clone formation after the three groups of cells including ShCtr,shKDM4A+vec and shKDM4A+Myr-AKT were cultured for 2 weeks in 10 cm dishes;C.analysis results of relative colony formation rate;Compared with shCtr,*1P<0.01;compared with Vec,*2P<0.01
Fig.4ReversionoftheeffectofKDM4AoncellproliferationofHep3BcellswithKDM4Alow-expressionbyMyr-AKT

