龍膽苦苷預處理對過氧化氫誘導的人臍靜脈內皮細胞氧化應激損傷的影響及機制
楊凱強,劉寶輝,王玉玖,董圣軍,吳恩剛,劉典曉
(濱州醫學院附屬醫院,山東濱州256600)
內皮細胞對血管功能調節具有重要作用,內皮細胞的氧化應激損傷是動脈粥樣硬化、高血壓等疾病的重要發病因素[1]。誘導預適應與藥物治療是減輕機體氧化應激的常用方法。近年來,傳統中藥因來源廣泛、不良反應少、耐藥性低等優點越來越受到關注。龍膽苦苷(GPS)是龍膽科龍膽屬植物龍膽的主要有效成分。研究顯示,GPS不僅有抗炎止痛[2]、保肝利膽[3]、拮抗腫瘤的作用[4],更有抗氧化[5,6]以及抑制大動脈平滑肌細胞的增殖、遷移[7]等預防和治療動脈粥樣硬化的心血管保護作用。但在保護心血管過程中,GPS對血管內皮細胞的氧化應激損傷是否具有保護作用鮮見報道。2017年11月~2018年5月,我們采用過氧化氫(H2O2)作用人臍靜脈內皮細胞(HUVEC)建立標準氧化應激損傷模型[8],觀察GPS預處理對HUVEC氧化應激損傷的影響,并探討其作用機制。
1 材料與方法
1.1 細胞、試劑與儀器 HUVEC由濱州醫學院實驗中心提供。GPS、噻唑藍(MTT)、胰蛋白酶(美國Sigma-Aldrich公司),胎牛血清(杭州四季青公司),DMEM低糖培養液(美國Hyclone公司),H2O2(天津市天大化工實驗廠),鼠源抗小鼠凋亡蛋白Caspase-3、β-actin、Bax、磷酸化AKT(p-AKT)、PI3K、B淋巴細胞/白血病-2(Bcl-2)抗體(美國Cell Signaling公司),原位末端轉移酶標記(TUNEL)檢測試劑盒(美國Santa Cruz公司),辣根過氧化物酶標記羊抗兔或鼠IgG(北京中杉金橋生物技術有限公司),丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽過氧化物酶(GSH-Px)檢測試劑盒(南京建誠生物技術有限公司),BCA蛋白定量測定試劑盒(上海碧云天生物技術公司)。酶標儀(美國Biotech公司),熒光顯微鏡(日本Olympus公司),Western blotting發光照相系統(美國Rio-Red公司)。
1.2 細胞培養與分組處理 將HUVEC加入含10%胎牛血清的DMEM細胞培養液,置于37 ℃、5% CO2培養箱內培養2~3 d,至細胞貼壁融合。加入0.25%胰蛋白酶消化,傳代培養。取對數生長期細胞,隨機分為正常對照組、模型組和GPS干預組。模型組加入200 μmol/L H2O2(以DMEM稀釋)培養4 h,建立氧化應激損傷模型;GPS干預組先加入20 μmol/L GPS(用DMSO預溶,并用DMEM培養液稀釋至相應濃度)培養12 h,然后加入200 μmol/L H2O2培養4 h;正常對照組僅加入0.01% DMSO培養4 h。
1.3 細胞存活率檢測 采用MTT法。取各組反應后細胞,PBS沖洗,加入DMEM培養液100 μL和含0.5% MTT的培養液10 μL,37 ℃、CO2培養箱內孵育4 h。棄培養液,加入100 μL DMSO原液,振蕩10 min,待結晶完全溶解后,用酶標儀于570 nm和630 nm波長處測定吸光度(A)值。細胞存活率=[(實驗組A570-實驗組A630)/(正常對照組A570-正常對照組A630)]×100%。
1.4 細胞凋亡率檢測 采用TUNEL法。取各組反應后細胞,加入4%多聚甲醛固定1 h。采用雙重染色法,加入TUNEL染液后,熒光顯微鏡下凋亡細胞的細胞核呈綠色,而DAPI染液可沾染到所有凋亡和未凋亡細胞的細胞核,鏡下呈藍色。每組細胞隨機選擇5個視野進行計數。細胞凋亡率=凋亡細胞數/所有細胞數×100%。
1.5 細胞上清液中MDA含量及SOD、GSH-Px活性檢測 各組細胞完成反應后,吸取細胞上清液。采用NBT法測定SOD活性,用TBA在酸性條件下加熱與組織中的MDA產生顯色反應來計算MDA含量,通過測定340 nm光吸收減少速率來計算GSH-Px活性。均嚴格按照試劑盒說明書操作。
1.6 細胞中PI3K/AKT信號通路蛋白PI3K、p-AKT以及凋亡相關蛋白Caspase-3、線粒體凋亡通路相關蛋白Bax、Bcl-2表達檢測 采用Western blotting法。取各組反應后細胞,加入裂解緩沖液裂解,提取細胞總蛋白,采用BCA蛋白定量測定試劑盒測定蛋白濃度。取20 μL總蛋白與SDS緩沖液充分混合后,沸水中煮7 min,使蛋白充分變性。用SDS-聚丙烯酰胺凝膠電泳(PAGE)分離,電轉移至硝酸纖維素膜上,用含50 g/L脫脂奶粉的TBST室溫封閉1 h。依次滴加抗PI3K、p-AKT、Bax、Bcl-2、Caspase-3、β-actin抗體(均按1∶1 000稀釋),4 ℃過夜。TBST洗滌,加入1∶5 000的辣根過氧化物酶標記羊抗兔或鼠IgG孵育2 h,TBST洗滌。ECL發光液顯影、曝光、定影,Bio-Rad系統拍照,并用其附帶的軟件分析目標蛋白的相對表達量,內參蛋白為β-actin。
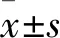
2 結果
2.1 各組細胞存活率和凋亡率比較 與正常對照組相比,模型組細胞存活率降低,凋亡率升高(P均<0.01);與模型組相比,GPS干預組細胞存活率升高,凋亡率降低(P<0.01)。見表1。
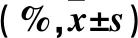
表1 各組細胞存活率和凋亡率比較
注:與正常對照組相比,*P<0.01;與模型組相比,#P<0.01。
2.2 各組細胞上清液中MDA含量及SOD、GSH-Px活性比較 與正常對照組相比,模型組MDA含量升高,SOD、GSH-Px活性降低(P均<0.01);與模型組相比,GPS干預組MDA含量降低,SOD、GSH-Px活性上升(P均<0.01)。見表2。
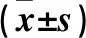
表2 各組細胞中MDA含量及SOD、GSH-Px活性比較
注:與正常對照組相比,*P<0.01;與模型組相比,#P<0.01。
2.3 各組細胞中PI3K、p-AKT、Bax、Bcl-2、Caspase-3蛋白表達比較 與正常對照組相比,模型組PI3K、p-AKT、Bcl-2表達降低,Bax、Caspase-3表達升高(P均<0.01);與模型組相比,GPS干預組PI3K、p-AKT、Bcl-2表達升高,Bax、Caspase-3表達降低(P<0.05或<0.01)。見表3。
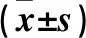
表3 各組細胞中PI3K、p-AKT、Bax、Bcl-2、Caspase-3蛋白表達比較
注:與正常對照組相比,**P<0.01;與模型組相比,#P<0.05,##P<0.01。
3 討論
血管內皮細胞是位于血液和組織之間的主要生理屏障,不僅能夠維護心血管系統生理平衡,還可促使免疫細胞進入血管和周圍組織,進而促進組織中黏附分子和趨化因子表達,在血管內分泌調節中起調控作用[9]。氧化應激誘導的血管內皮細胞功能紊亂是多種心血管與非血管疾病共同的病理基礎[10]。研究發現,在內皮細胞氧化應激損傷過程中,活性氧簇(ROS)可引起凋亡通路相關蛋白Bax、Caspase-3表達升高,干擾正常狀態中抗凋亡蛋白Bcl-2的作用,從而引起血管內皮細胞存活率下降,誘導內皮細胞凋亡[11]。因此,抑制或清除過量的ROS對保護血管內皮細胞具有重要意義。現已證實,多種信號通路能夠抑制氧化應激發生,其中PI3K/AKT信號通路具有重要的抗氧化作用[13,14]。GPS屬于裂環環烯醚萜苷類化合物,其分子式是C16H20O9。研究顯示,GPS具有保護心血管的作用。Kesavan等[7]報道,GPS可抑制大動脈平滑肌細胞的增殖、遷移;曹慧敏等[12]報道,GPS可減輕缺血再灌注所致的心肌細胞凋亡。其機制可能為:GPS抑制趨化物甲酰甲硫氨酰-亮氨酰-苯丙氨酸、十四酰佛波乙酸酯和花生四烯酸誘導的過氧化物酶的產生,并抑制酪氨酰和絲氨酸/蘇氨酸磷酸化的作用,同時抑制細胞質蛋白向細胞膜的遷移。GPS對H2O2誘導的血管內皮細胞氧化應激損傷是否存在保護作用缺少深入的研究。
本研究結果顯示,H2O2作用于HUVEC后,可顯著降低細胞內SOD、GSH-Px活性,增加MDA含量,表明H2O2使細胞受到嚴重的氧化應激損傷。在使MDA生成增多的同時,損害了細胞的自我防御和自凈功能,導致SOD生成減少和ROS含量增多。應用GPS預處理后,細胞存活率升高,凋亡率降低。與模型組相比,GPS干預組MDA含量明顯降低,SOD、GSH-Px活性顯著上升,表明GPS具有良好的清除細胞內氧化毒性物質的能力,對氧化應激損傷的HUVEC存在一定的保護作用。進一步研究發現,與模型組相比,GPS干預組AKT磷酸化水平明顯上調,PI3K、Bcl-2蛋白表達增加,凋亡蛋白蛋Bax表達降低,Caspase-3的激活受到抑制。提示GPS對HUVEC的抗氧化保護作用可能與PI3K/AKT信號通路相關。
綜上所述,在H2O2造成的HUVEC氧化應激損傷過程中,GPS能夠抑制氧化應激水平,上調抗凋亡蛋白Bcl-2并抑制凋亡蛋白Bax、Caspase-3表達,從而減少內皮細胞凋亡,發揮保護內皮細胞的作用;其機制可能與激活PI3K/AKT信號通路有關。

