抗氧化劑預防抗結核藥物致肝損傷的隨機開放研究
覃紅娟 譚守勇 鄺浩斌 吳迪 張宏 汪敏 葉錦泉 袁圓 馮治宇陳澤瑩 李艷
廣州市胸科醫院結核內科(廣州510095)
抗結核藥所致藥物性肝損傷(drug-induced liver injury,DILI)是指在使用抗結核藥過程中,由于藥物或其代謝產物引起的肝細胞毒性損傷或肝臟對藥物及其代謝產物的變態反應所致病理過程。在有關DILI 的報道中,抗結核藥所致DILI 居首位[1]。抗結核藥所致DILI 不僅導致結核病中斷治療和治療失敗,還可誘導耐藥性的產生,少數患者可發生急性肝功能衰竭而死亡[2]。嚴重影響結核病的控制。因此,探討預防抗結核治療所致肝損傷,保證抗結核治療的順利完成的途徑是當前研究的迫切課題。為降低DILI 發生率,提高結核病患者的依從性和療效,近年來我國部分結核科醫生傾向于在抗結核治療的同時使用保肝藥物。由于目前缺乏循證醫學的依據,因此對預防性保肝治療的爭議不斷[3]。N-乙酰半胱氨酸(N-acetyl-L-cysteine,NAC)是呼吸系統常用藥物,近年來研究還表明NAC 對藥物性肝損傷有較好的療效[4]。但國內仍未有NAC 預防性護肝的相關研究。本研究將豐富肺結核患者預防抗結核藥物致肝損傷的認識,為本專科領域對該病的治療提供參考依據。
1 對象與方法
1.1 研究設計 采用隨機開放、對照研究,本研究共納入患者210 例,共分兩個觀察組和一個對照組,各組之間人員對比1∶1∶1。隨機方法:隨機數字表法。方案經廣州市胸科醫院倫理委員會討論通過后執行。2014年9月至2016年7月完成患者入組,2016年9月完成入組患者觀察。
1.2 研究對象 隨機選擇2014年7月至2016年7月在我院就診并確診初治肺結核210例,符合2008年1月16日衛生部發布的《肺結核診斷標準》[5],男女不限,年齡18~65 歲,經患者簽署知情同意書后納入項目。所有入選患者均符合以下條件:抗結核治療前肝功能檢查正常。排除標準:(1)同時接受其它有肝毒性的藥物治療;(2)存在其它可能導致肝功能損傷的肝臟疾病或全身性疾病,包括甲、乙、丙、丁、戊型肝炎病毒重疊感染以及其他原因(酒精、藥物、腫瘤、自身免疫性肝病)等引起的肝臟損害。排除具有上述任何一項的患者。
1.3 分組 210 例患者隨機分為3 組,每組70 例,分別采用予2HRZE/4HR 加用NAC(A 組)以及2HRZE/4HR 加用雙環醇(B 組)方案為觀察組,采用2HRZE/4HR 方案治療為對照組(C 組),觀察治療8 周內各組發生肝損傷情況。剔除不符合標準的患者14 例,其中合并病毒肝的患者6 例,治療過程出現過敏反應2 例,丟失6 例,丟失患者中各組均為2 例,實際完成觀察196 例,其中A 組64 例,B 組66 例,C 組66 例。觀察對比各組肝損傷發生率和治療效果。各組男女性別與年齡分布比較,3 組男女性別比較χ2=1.758,P=0.415;3 組年齡比較F=0.618,P=0.540,差異無統計學意義(P>0.05),具有可比性。由于監測密切,無患者出現嚴重不良事件及因不良事件死亡。各組患者的一般資料與肝損傷情況的對比見表1。
1.4 治療 異煙肼(INH,H)0.3 g,1 次/d;利福平(RFP,R)體質量≥55 kg 0.6 g,1 次/d,體質量<55 kg 0.45 g,1 次/d;吡嗪酰胺(PZA,Z)1.5 g,1 次/d;乙胺丁醇(EMB,E)體質量≥55 kg 1.0 g,1 次/d,體質量<55 kg 0.75 g,1 次/d;NAC 200 mg,3 次/d;雙環醇25 mg,3 次/d。
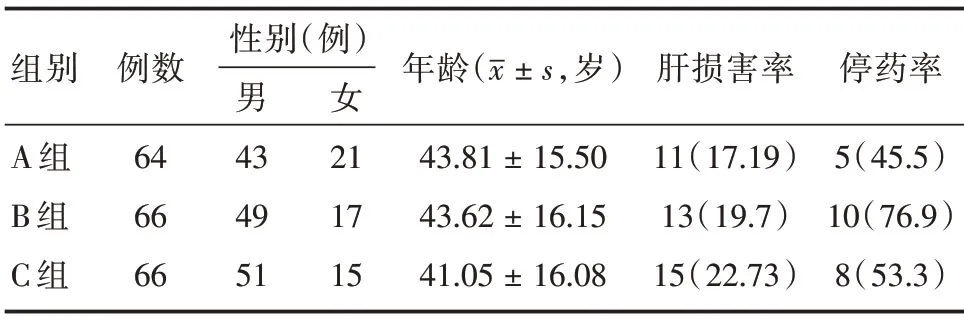
表1 各組患者的一般資料與肝損傷情況的對比Tab.1 comparison of general data and liver injury of patients in each group 例(%)
1.5 評價指標 研究過程中,分別在用藥前及用藥后2、4、8 周后檢查肝功能指標(AIT、AST、AKP、TBIL、DBIL),如出現惡心、厭油、皮疹、黃疸即查肝功能,統計抗結核藥物所致肝損傷情況。并分析對比各組患者發生肝損傷的時間及發生肝損傷后需要更改抗結核治療方案或中斷治療情況。肝損傷診斷標準為[6]:(1)丙氨酸氨基轉移酶(ALT)>2 倍ULN 或直接膽紅素(DBIL)>2 倍ULN;(2)天冬氨酸轉氨酶(AST)、堿性磷酸酶(ALP)和總膽紅素(TBIL)同時升高,且至少1 項>2 倍ULN。出現肝損傷后的處理原則:(1)僅ALT<3 倍ULN,無明顯癥狀,無黃疸,可在密切觀察下保肝治療,并酌情停用肝損傷發生頻率高的抗結核藥物;(2)ALT ≥3 倍ULN,或總膽紅素>2 倍ULN,應停用肝損傷發生頻率高的抗結核藥物,保肝治療,密切觀察;(3)ALT>5 倍ULN,或ALT ≥3 倍ULN 伴有黃疸、惡心、嘔吐、乏力等癥狀,或總膽紅素≥3 倍ULN,應立即停用所有抗結核藥物,積極保肝治療,嚴重肝損傷患者應住院采取綜合治療措施,有肝功能衰竭表現時應積極采取搶救措施。
1.6 統計學方法 應用SPSS 17.0 軟件包處理,計量數據用均數±標準差表示,組間比較用t檢驗;資料不符合正態分布,用非參數秩和檢驗;組間率比較采用χ2檢驗。以P<0.05 為差異有統計學意義。
2 結果
2.1 各組之間肝損傷發生率及停藥率對比 (1)予NAC預防性護肝治療的A組患者肝損傷率17.19%,低于C 組的肝損傷率22.73%,但差異無統計學意義(χ2=0.623,P=0.430),A 組肝損傷患者停藥率45.5%,低于C 組的停藥率53.3%,差異無統計學意義(χ2=0.158,P=0.691)。(2)予雙環醇預防性護肝治療的B 組患者肝損傷率19.7%,低于C 組的肝損傷率22.73%,但差異無統計學意義(χ2=0.181,P=0.670),B 組肝損傷患者的停藥率76.9%,高于C 組的76.9%,差異無統計學意義(χ2=0.08,P=0.778)。(3)A 組患者肝損傷發生率稍低于B 組患者肝損傷率,差異無統計學意義(χ2=0.136,P=0.712)。A 組肝損傷患者停藥率低于B 組肝損傷患者的停藥率,差異無統計學意義(χ2=1.354,P=0.245)。
2.2 3組患者發生肝損傷時間對比 A 組患者較多見于4~8 周,B 組多見2 周內,而C 組患者發生肝損傷在3 個時間段內相同,但肝損傷好發時間在3 組間的分布差異無統計學意義,各組出現肝損傷時間對比見表2。
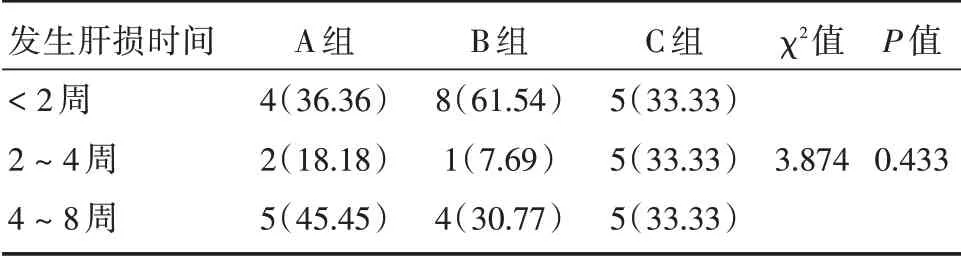
表2 3 組出現肝損傷時間對比Tab.2 Comparison of the time which liver injury appeared in three groups 例(%)
2.3 3組患者發生肝損傷轉氨酶最高值出現時間對比 A組出現的時間較B組及C組遲。而肝損傷發生后,A 組及C 組的患者肝功能恢復時間較B 組患者所需時間短,但各組之間差異無統計學意義,各組肝損傷高峰時間及肝功能恢復時間比較見表3。
表3 3 組肝損傷高峰時間及肝功能恢復時間比較Tab.3 Comparison of liver injury high value and recovery time of liver function in three group ±s
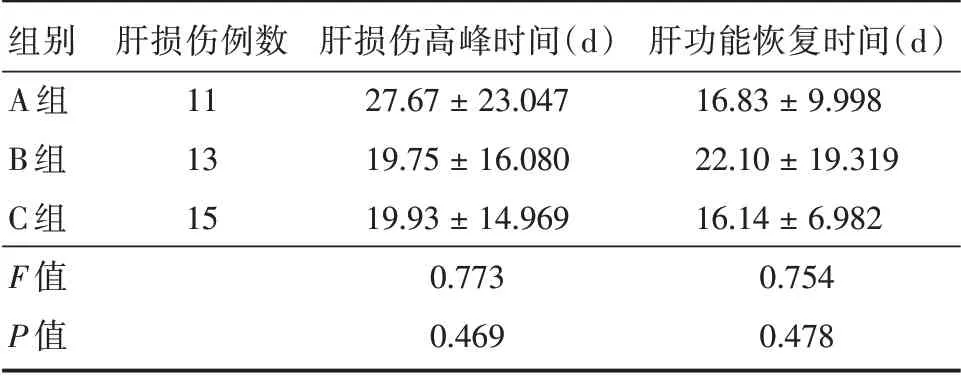
表3 3 組肝損傷高峰時間及肝功能恢復時間比較Tab.3 Comparison of liver injury high value and recovery time of liver function in three group ±s
組別A 組B 組C 組F 值P 值肝損傷例數11 13 15肝損傷高峰時間(d)27.67±23.047 19.75±16.080 19.93±14.969 0.773 0.469肝功能恢復時間(d)16.83±9.998 22.10±19.319 16.14±6.982 0.754 0.478
3 討論
結核病的治療原則為早期、聯合、規律、適量和全程,初治肺結核患者所采用包含異煙肼(H)、利福平(R)、吡嗪酰胺(Z)聯合應用的化療方案是目前治療肺結核的有效的方案,能治愈大部分的結核病,據文獻報道復發率低于3%[7]。肺結核治療出現肝損傷,以R、Z 和H 等3 種藥物最為明顯,特別是H 與R 合用可使肝損傷提高[8]。而且三藥聯用可增加肝損傷的發生風險。DILI 難以預測,其發生率的報道受多種因素影響,差別較大,標準聯合治療方案的DILI 發生率為2%~28%[9]。目前,肺結核標準化療方案特別是在強化期容易發生肝損傷,導致部分患者中途終止治療,嚴重影響抗結核治療的順利進行,增加了結核耐藥的風險,嚴重的可引起肝衰竭而導致死亡。本研究中由于觀察密切,無一例患者出現嚴重不良事件。
抗結核藥引起肝損傷的機制目前尚不清楚,目前認為藥物及其代謝產物對肝臟有直接毒性作用,近年來其在代謝特異質肝損傷和氧化應激機制等方面的報道日益增多[2]。代謝特異質肝損傷機制:藥物代謝酶(DEM)對活性代謝物的合成和解毒都有關鍵性作用,總的來說抗結核藥物性肝損傷遺傳易感性與NAT2、CYP2E、GSTM1 的基因多態性有顯著關聯。氧化應激機制:近年的動物實驗和臨床觀察結果均表明,抗結核藥物所致DILI 存在氧化應激機制。當藥物代謝引起肝細胞損傷后,刺激Kupffer 細胞產生和釋放腫瘤壞死因子(TNF-α)及其他炎性細胞因子,TNF-α 可誘生IL-1,IL-6,IFN-γ 等多肽介質,這些多肽介質促進TNF-α 的產生加重肝臟損傷[10]。TNF-α 還可以誘導自由基的產生及脂質過氧化,產生大量自由基[11],誘導氧自由基的產生,活化分子氧產生超氧離子(O2-),使內質網膜上的多價不飽和脂肪酸發生脂質過氧化,從而破壞肝細胞器的膜性結構,導致肝損傷,此外,DILI 也可能存在肝性適應(hepatic adaptation)機制,表現為短暫、無癥狀和輕度轉氨酶增高。
NAC 是2004年被美國FDA 批準用來治療APAP 引起的固有型DILI 的唯一解毒藥物。2011年美國肝病學會(AASLD)ALF 指南推薦NAC 用于藥物及毒蕈引起的ALF 的治療。2014年ACG 的IDILI 臨床診治指南推薦應用NAC 治療早期ALF患者[12]。近年研究表明NAC 的抗氧化作用還可以提高SOD、GSH-PX 活性,增進GSH 的抗氧化能力,從而起到保護肝細胞的作用。因此NAC 可以減少抗結核藥物肝損傷的發生[13],有研究表明在60 歲以上的結核患者抗結核治療同時予NAC 預防性護肝治療,可以減少肝損傷的發生[14]。多個研究表明雙環醇對多種實驗性肝損傷具有顯著的抗炎保肝作用,其作用機理與抑制炎癥因子的增加,清除自由基、抗脂質過氧化、保護生物膜和線粒體肝功能等密切相關[15]。
本研究中在于HRZE 抗結核治療同時,予NAC 預防性護肝治療的A 組患者和予雙環醇預防性護肝治療的B 組患者的肝損傷發生率相似,較未予預防性護肝治療的C 組患者的肝損傷發生率低,但3 組患者的肝損傷發生率差異沒有統計學意義,考慮可能的原因是抗結核藥物引起的DILI機制復雜,該研究中排除了有肝損傷的危險因素患者,研究中所用的保肝藥物只針對了少部分DILI的發生機制,阻斷藥物肝毒性的產生環節,降低部分抗結核藥物對肝臟的損傷,但并未能完全針對所有DILI的發生機制,故未能完全阻止DILI發生。在肝損傷發生患者中,因肝損傷中斷治療或者更改治療方案的發生率,A 組的患者最低,其次為C 組患者,而B 組的患者最高,雖然3 組患者各組之間差異都沒有統計學意義,但在這個過程中NAC 可能已經控制了部分的抗氧化作用,減輕了肝損傷的發生。而NAC 治療藥物性肝損傷在指南中提高劑量為50~150 mg/(kg·d)。目前研究中采用的是NAC作為化痰藥物所需劑量,該劑量是否未能完全阻止肝損傷的發生,是否增加劑量能增加預防性護肝治療的效果,或者說預防性護肝治療需要多少劑量更適合,仍需要更多的研究證實。而肝損傷好發時間在3 組間的分布差異無統計學意義,但是從發生率中可看到A 組患者發生時間更長,轉氨酶高值出現更遲,NAC 可能可以延遲肝損傷的發生時間。本組研究中還可以看到A 組患者肝損傷后恢復時間加快。肝損傷多發生在兩個月內的抗結核強化期,肝損傷的延遲發生可能可以減少治療中斷率,肝功能較快恢復,可以減少停藥時間,有利于抗結核治療的順利進行。在本研究中各組之間的對比差異無統計學意義,考慮的原因可能還與該研究的病例數較少有關,進一步的結果仍需更大量的研究證實。
研究表明NAC 預處理后,免疫引起的肝損傷明顯減少[16],這個研究表明NAC 更適合于預防性保肝治療;除了有保肝作用外,它還具有較強的黏痰溶解作用,最初作為一種黏液溶解劑應用于臨床。近年來,基礎研究發現其還具有較強的抗氧化及細胞保護作用,而且可以減緩慢性阻塞性肺病患者肺功能的下降速度、抗肺纖維化,另有研究表明NAC 的抗氧化作用還可以抑制抗酸桿菌的生長[17-19],是呼吸系統疾病常用的藥物。肺結核是呼吸系統疾病,大多數患者都有呼吸系統癥狀,所以在肺結核患者中使用NAC,護肝同時可以改善呼吸道癥狀,可以起到一舉多得的作用。
近年來NAC 在治療急性肝衰竭及藥物性肝損傷方面的療效是公認的,但是NAC的預防性護肝治療方面的效果如何,國內未有這方面的研究。本研究的開展將填補這項空白,為本專科領域對該病的治療提供參考依據。但是被研究的患者例數較少,而且目前未能得出NAC預防性護肝治療的最佳劑量,下一步將加大研究患者的例數及探討更加合理的用藥劑量,為該類患者提供積極有效的治療方案。

