單通道微創經皮腎鏡碎石取石術聯合輸尿管軟鏡碎石取石術在斜仰臥截石位下治療鹿角形結石的臨床分析
李天 許可慰 謝清靈 江先漢 李遜 趙風進 劉一帆殷羽飛 黃奕橋
1廣州醫科大學附屬第五醫院泌尿外科(廣州510700);2中山大學孫逸仙紀念醫院泌尿外科(廣州510700)
主體位于腎盂,其分支進入腎盞的結石稱為鹿角形結石[1]。鹿角形結石(staghorn calculi,SC)是一種特殊類型的腎結石,具有結石分布復雜、取石困難、手術難度大和術后容易復發的特點。由于這類患者通常伴有反復的泌尿系感染和慢性腎功能損害,造成病情復雜,給治療帶來極大困難。因此,鹿角形腎結石仍然是泌尿外科的臨床難點之一。近年來,經皮腎鏡碎石取石術(percutaneous nephroscope lithotomy,PCNL)因其高效的碎石效率,已成為鹿角形結石的主要手術方式[2]。為了提高SC 治療的結石清除率(stone free rate,SFR),臨床常采用多通道或多期PCNL的手術方式,這不僅增加了腎臟受損的程度,亦會導致腎出血、腎切除等嚴重并發癥,嚴重影響患者術后的生活質量[3]。因此,本研究旨在探討單通道微創經皮腎鏡碎石取石術(minimally invasive percutaneous nephrolithotomy,MPCNL)聯合輸尿管軟鏡碎石取石術(FURS)在斜仰臥截石位下,治療鹿角形結石的可行性、安全性及有效性,以期為鹿角形結石臨床治療的選擇提供經驗與線索。
1 對象與方法
1.1 研究對象 回顧性分析了2015年8月至2017年8月于廣州醫科大學附屬第五醫院泌尿外科手術治療的87 例鹿角形結石患者。鹿角形結石的診斷,依據術前靜脈腎盂造影(IVP)、泌尿系超聲及泌尿系CT 結果確定。當結石分支占據各個腎盞(≥80%以上腎盂腎盞容積)稱為完全性鹿角形結石。當結石<80%腎盂腎盞容積則稱為部分性鹿角形結石。根據手術類型將患者分為兩組:行MPCNL 與FURS 的聯合組和行MPCNL 的對照組。聯合組:男25 例,女19 例,平均年齡(46.182±12.743)歲;13 例為完全性SC,31 例為部分性SC;結石平均大小(5.171±0.942)cm。對照組:男27 例,女16 例,平均年齡(45.767 ± 11.223)歲;16 例為完全性SC,27 例為部分性SC;結石平均大小(5.277 ±0.903)cm。兩組在年齡、性別組成、SC 類型、結石大小上差異無統計學意義(P>0.05),見表1。
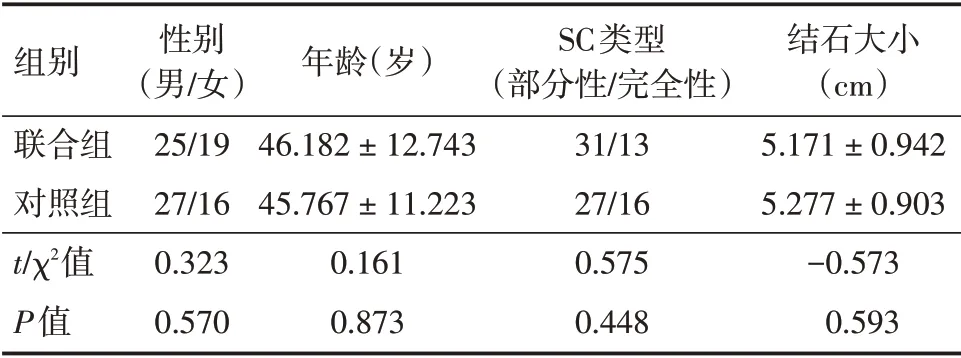
表1 研究對象一般資料Tab.1 General information of research subjects x±s
1.2 納入及排除標準 納入標準:(1)年齡≥18 歲;(2)單側鹿角形結石;(3)既往未行體外沖擊波碎石術(ESWL)、經皮腎鏡碎石取石術(PCNL)、輸尿管鏡取石術(URS)、軟性輸尿鏡碎石術(FURL)等外科治療;(4)圍手術期參數、結石清除率、并發癥事件等數據收集齊全。
排除標準:(1)解剖或功能性孤立腎,不宜行PCNL 者;(2)伴有嚴重心肺功能不全,無法耐受全麻手術者;(3)合并有泌尿系惡性腫瘤者;(4)術前出現不宜控制的泌尿系感染(膿毒血癥、感染性休克、腎積膿等);(5)FURS 工作鞘置入失敗(輸尿管狹窄、息肉等)。
1.3 術中同期行逆行輸尿管軟鏡手術(RIRS)的指征 同期進行RIRS 的指征:(1)單通道MPCNL 術后,鏡檢仍可見部分腎盞有結石殘余,但受限于角度、距離等因素,而無法碎石。此時無需術中X 線驗證即可進行同期RIRS 術;(2)單通道MPCNL 術后,鏡檢雖無明確結石殘余,但術中X 線證實有結石殘余者。
1.4 術前準備 所有患者術前均行常規檢驗及檢查,行尿常規及中段尿培養,運用抗生素3~7 d 直至感染完全控制,尿液分析提示白細胞計數完全正常。
1.5 手術方式
1.5.1 MPCNL 術 全身麻醉起效后,將患者取截石位。在輸尿管鏡引導下,逆行置入5 Fr 輸尿管導管至患側腎盂。留置16 Fr 雙腔尿管,將輸尿管導管的遠端固定在尿管旁,以防導管移位。將輸尿管導管的遠端與正常生理鹽水輸注口連接,以便在患側建立人工腎積水。隨后將患者調整為俯臥位,并將腰部墊高。在X 線引導下,用18G 穿刺針經第11 肋肋間隙或第12 肋下緣腋后線刺入目標腎盞。當看到尿液從穿刺針中流出時,可認為穿刺成功,已達目標腎盞。將斑馬導絲置入針鞘內,在導絲引導下,使用筋膜擴張器將腎穿刺通道擴張到20 Fr。將一個20 Fr 的工作鞘放入目標腎盞。利用鈥激光粉碎結石,用抓鉗除去結石碎塊。碎石后運用經皮腎鏡檢查各腎盞、腎盂,確認無明顯結石殘余后,在斑馬導絲引導下留置雙J 管,并將16 Fr 硅膠腎造瘺管放置于MPCNL 通道內進行引流。最后,常規放置尿管。
1.5.2 斜仰臥截石位下MPCNL 聯合FURS 待全身麻醉起效后,將患者擺放至斜仰臥截石位。設定體位時,將患者置于患側向上斜仰臥45°體位,腰部向外上方墊高以協助顯露穿刺區,臀部后方置小枕,健側腰腹部墊沙袋以固定患者體位。妥善固定后再將患者置于接近截石位,患側下肢盡量伸直,對側下肢外展屈髖屈膝,擺放完成后患者整體即成斜仰臥截石位。在輸尿管鏡引導下,逆行置入5 Fr 輸尿管導管至患側腎盂。留置16 Fr 雙腔尿管,將輸尿管導管的遠端固定在尿管旁,以防導管移位。將輸尿管導管的遠端與正常生理鹽水輸注口連接,以便在患側建立人工腎積水。在X 線引導下,用18G 穿刺針經第11 肋肋間隙或第12 肋下緣腋后線刺入目標腎盞。當看到尿液從穿刺針中流出時,可認為穿刺成功,已達目標腎盞。將斑馬導絲置入針鞘內,在導絲引導下,使用筋膜擴張器將腎穿刺通道擴張到20 Fr。將一個20 Fr 的工作鞘放入目標腎盞。利用鈥激光粉碎結石,用抓鉗除去結石碎塊。MPCNL碎石后,運用經皮腎鏡檢查各腎盞、腎盂,以評估結石殘余情況,并進行FURS手術。FURS手術時,利用半硬輸尿管鏡將導絲置入腎盂。取出半硬輸尿管鏡后,放置輸尿管軟鏡工作鞘(Cook,Bloomington,IN)。置鞘成功后,輸尿管軟鏡(URF-P5,Olympus)在斑馬導絲引導下進入上尿路。將鈥激光的能量參數設定為:能量0.8~1.2 J;頻率10~20 Hz的頻率。激光纖維尺寸為200 μm。當殘余結石被粉碎后,結石碎片通過經皮腎穿刺通道取出。手術結束時,利用輸尿管軟鏡再次檢查集合系統有無結石殘余,并留置雙J 管(6 Fr,術后2~6 周取出)。將16 Fr 硅膠腎造瘺管放置于MPCNL 通道內進行引流。最后,常規放置尿管。
1.6 術后管理與評估 術后密切觀察血壓變化及腎造瘺引流管的引流情況。腎造瘺管于術后5~7 d 視情況拔除。術后第1 天、第1 周及第4 周,利用泌尿系全段CT及KUB 評估結石清除率及雙J 管放置情況。規定當無結石碎片或結石碎片直徑<4 mm,認為無結石殘留[4]。由于術中出血導致MPCNL 處理不理想,或由于輸尿管條件差導致軟鏡工作鞘置鞘失敗,而最終導致結石殘余(直徑≥5 mm)的病例可考慮于術后5~10 d行輔助ESWL治療。
1.7 評價指標 首要評價指標為首次術后SFR、輔助ESWL 后SFR 及術后并發癥的發生率。次要評價指標為:平均手術時間、平均住院時間、術后血紅蛋白降低幅度等。按照Clavien Dindo 分級系統對并發癥進行分類[5]。
1.8 統計學方法 利用SPSS 14.0 軟件進行數據分析。連續性變量以均值±標準差的形式表示,分類變量以率的形式表示。分類變量采用χ2檢驗或Fisher 精確概率檢驗比較。連續性變量采用t檢驗比較。以P<0.05 為差異有統計學意義。
2 結果
2.1 手術相關參數與SFR 的比較 所有患者均順利完成相關手術,兩組術前與術后的數據結果見表2。聯合組在平均手術時間上與對照組相比差異有統計學意義(P=0.007)。在術后住院天數上則少于對照組,差異有統計學意義(P=0.006)。在術后血紅蛋白下降幅度上,聯合組亦低于對照組(P<0.001)。在SFR 上,無論是首次術后還是輔助ESWL 后,聯合組的術后SFR 均優于對照組(P=0.013)。
表2 手術相關參數與SFR 的比較Tab.2 Comparison of surgical parameters with SFR ±s
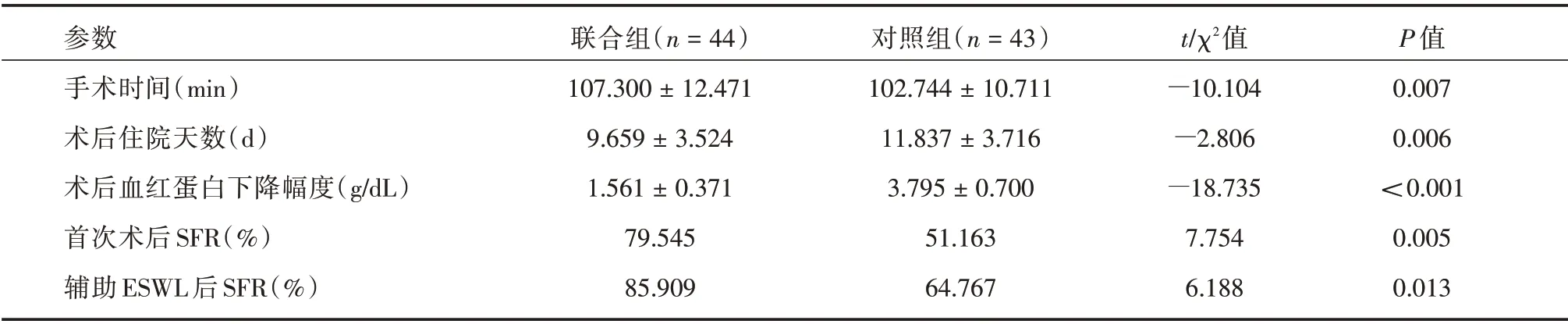
表2 手術相關參數與SFR 的比較Tab.2 Comparison of surgical parameters with SFR ±s
參數手術時間(min)術后住院天數(d)術后血紅蛋白下降幅度(g/dL)首次術后SFR(%)輔助ESWL 后SFR(%)聯合組(n=44)107.300±12.471 9.659±3.524 1.561±0.371 79.545 85.909對照組(n=43)102.744±10.711 11.837±3.716 3.795±0.700 51.163 64.767 t/χ2值-10.104-2.806-18.735 7.754 6.188 P 值0.007 0.006<0.001 0.005 0.013
2.2 不良事件的比較 兩組并發癥的發生情況見表3。兩組均未發生≥ClavienⅢ級的并發癥。從并發癥總發生率上看,聯合組優于對照組,且差異具有統計學意義(P=0.032)。
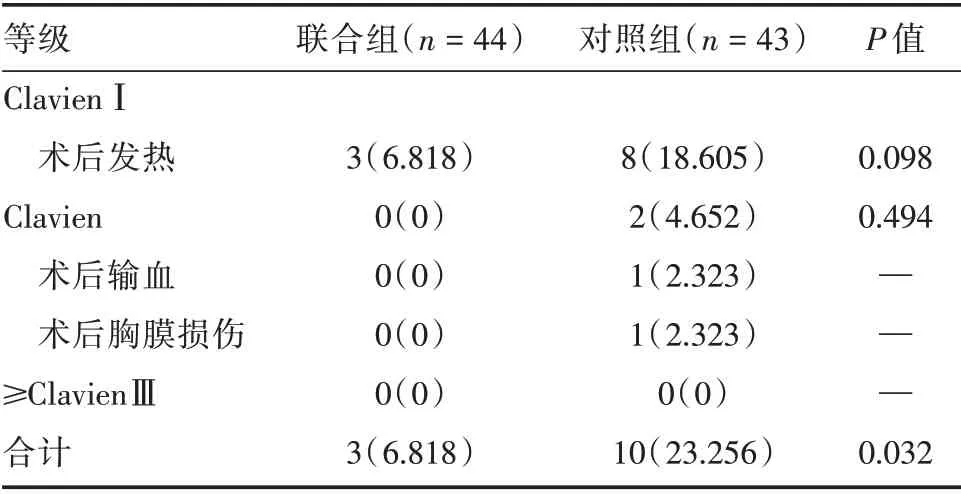
表3 兩組并發癥的發生情況比較Tab.3 Comparisons between the two groups例(%)
3 討論
標準通道PCNL 擁有可靠的碎石效率,但穿刺帶來的腎臟損傷及出血風險也限制了PCNL在SC治療中的運用[6]。手術策略的選擇,如手術時間延長、多通道建立等,亦會導致大出血、敗血癥、結腸損傷、血氣胸等嚴重并發癥的發生[7]。已有研究表明,部分行PCNL 手術的患者會因腎臟的嚴重損傷,被迫行腎切除術,一些患者甚至會因休克或膿毒血癥死于圍手術期[8]。因此,就迫切需要尋找新的方法來彌補傳統SC 手術方法的不足。
MPCNL 聯合FURS 在處理SC 時,較傳統單一使用PCNL 術有一定優勢,原因如下:(1)體位優勢。傳統PCNL術在手術過程中,需從截石位調整為俯臥位。這種體位變化會導致手術時間及麻醉風險的增加[9]。本研究采用的手術體位為斜仰臥截石位,手術中體位的擺放及調整相對簡單、方便,且術中無需改變體位,因此可減少手術時間,降低膿毒血癥的發生。然而,病人臀部和肩部必須加上水袋或棉袋以防受傷[10]。(2)通道優勢。傳統PCNL 通常需建立30 Fr 的經皮腎穿刺通道,手術過程中出現腎臟損傷,出血以及器官損傷的機率都較高,運用MPCNL(16~20 Fr)可降低這些風險的發生。(3)FURS 帶來的優勢。由上文可知FURS 可與MPCNL 形成良好互補。本研究表明,FURS 聯合MPCNL 治療SC 后,有85.9%的患者獲得了結石的清除。FURS 在處理上盞、憩室內、息肉包裹及上段輸尿管結石時,較PCNL 有一定優勢[11]。而CEPEDA 等[12]的研究顯示,PCNL 在處理下盞及較大負荷結石時較FURS有優勢。(4)聯合治療帶來的優勢。單獨運用FURS 因其置鞘難度大、碎石效率低,并不適合處理SC 或大負荷泌尿系結石[13]。此外,FURS 因術中引流較困難,術后出現發熱、感染、膿毒血癥、感染性休克的機率也較高[14]。另一方面,利用FURS 的補充,不僅可以處理MPCNL 難以清除的結石,還可以減少MPCNL 的通道建立,減少出血及腎臟損傷。
在手術決策及治療技巧上仍需注意以下幾點:(1)MPCNL 通道的選擇:MPCNL 通道的建立必須考慮到SC 在腎臟中的分布。(2)優先處理下盞結石:由于輸尿管與腎盞之間夾角過小,或輸尿管軟鏡彎曲程度限制等原因,FURS不易處理下盞內結石[15]。總之,在處理SC 時,應該充分利用MPCNL 作為“主戰場”獲勝的方法,同時利用FURS 做好“清理戰場”的工作。
在斜仰臥截石位下,聯合MPCNL 及FURS 處理SC,可充分發揮兩種治療方式的優勢,減少手術創傷、住院時間及并發癥的發生,并可顯著提高術后S FR。斜仰臥截石位下MPCNL 聯合FURS 治療,可作為SC 患者的新型治療策略。

