LASS2基因?qū)盒阅[瘤作用機(jī)制研究進(jìn)展
王僑 欒婷 王劍松 王海峰
昆明醫(yī)科大學(xué)第二附屬醫(yī)院泌尿外科/云南省泌尿外科研究所(昆明650101)
相關(guān)調(diào)查[1]發(fā)現(xiàn),2018年全球?qū)⑿略霾±? 810 萬(wàn),癌癥死亡960 萬(wàn)例,其中有一半的癌癥死亡病例將發(fā)生在亞洲。癌癥成為亟待解決的問(wèn)題。抵抗細(xì)胞死亡和持續(xù)增殖被認(rèn)為是癌癥的基本特征。細(xì)胞周期進(jìn)程的失調(diào)破壞了細(xì)胞增殖和細(xì)胞死亡的動(dòng)態(tài)平衡,從而導(dǎo)致癌癥的發(fā)生。在對(duì)腫瘤的研究中逐漸發(fā)現(xiàn)腫瘤的發(fā)生、發(fā)展過(guò)程中部分基因發(fā)生了改變,因此最近幾年通過(guò)基因治療癌癥成為了研究熱點(diǎn)。新發(fā)現(xiàn)的腫瘤轉(zhuǎn)移抑制基因—人源性長(zhǎng)壽保障基因Ⅱ型(homo sapiens longevity assurance homologue2,LASS2)又名腫瘤轉(zhuǎn)移抑制基因-1(tumor metastasis suppressor gene-1,TMSG1),在肝癌[2]、肺癌[3]、膀胱癌[4]、乳腺癌[5]、胃癌[6]、前列腺癌[7]等多種腫瘤中LASS2 均呈低表達(dá),進(jìn)一步研究證實(shí)其可以抑制以上多種腫瘤的增殖能力和轉(zhuǎn)移能力。本文就LASS2 對(duì)各種腫瘤的作用及其機(jī)制作一綜述。
1 LASS2
LASS2 基因是由劉宇欣等[7]于1999年引用mRNA 差異顯示技術(shù)從前列腺癌不同轉(zhuǎn)移潛能亞系中克隆出來(lái)得到的一種新的cDNA 序列,在GenBank 中的登錄記號(hào)為AFl89062。其后PAN 等[8]于2001年從人肝cDNA 文庫(kù)中克隆出一種與酵母長(zhǎng)壽保障基因LAGl 高度同源的新基因,命名為L(zhǎng)ASS2 基因。因其與TMSG1 高度同源,所以TMSG1 基 因也叫做LASS2 基因。ZOU 等[9]于2008年研究發(fā)現(xiàn)LASS2/TMSGl 具有利用長(zhǎng)鏈脂肪酰輔酶A 合成神經(jīng)酰胺的功能,故將其更名為神經(jīng)酰胺合成酶2(ceramidesynthase 2,CerS2)。LASS2 是一種廣泛分布于多種組織的管家基因,其中在肝、腎中高表達(dá),LASS2 定位于1q11,含10 個(gè)外顯子。陳玉錦等[10]研究發(fā)現(xiàn)膀胱癌細(xì)胞中LASS2 的rs8444 區(qū)的C 等位基因和CC 基因型明顯低于正常組織,推測(cè)以上兩種基因型可減少膀胱癌發(fā)病風(fēng)險(xiǎn)。LASS2 編碼的蛋白定位于細(xì)胞膜和細(xì)胞質(zhì)中,具有HOX 和TLC 兩個(gè)功能域。HOX 是一種序列特異性DNA 結(jié)合轉(zhuǎn)錄調(diào)節(jié)因子,對(duì)基因的轉(zhuǎn)錄調(diào)控起著不可忽視的作用,同時(shí)能誘導(dǎo)神經(jīng)酰胺合成酶的活性。根據(jù)目前的研究TLC 功能域可能參與神經(jīng)酰胺的合成后,參與細(xì)胞功能。
2 LASS2 作用機(jī)制
2.1 LASS2 與液泡型ATP 酶 液泡型ATP 酶(vacuolar ATPase,V-ATPase)廣泛分布于真核細(xì)胞中,在細(xì)胞膜、溶酶體、分泌泡上均有分布,在高轉(zhuǎn)移潛能的腫瘤細(xì)胞中高表達(dá)。V-ATPase 通過(guò)跨膜將細(xì)胞內(nèi)的H+排出胞外,使細(xì)胞外pH 降低[11]。細(xì)胞外H+增多時(shí)可以促進(jìn)腫瘤細(xì)胞分泌的基質(zhì)金屬蛋白酶-2(MMP2)與MMP9 等酶激活、破壞腫瘤細(xì)胞周圍的細(xì)胞外基質(zhì),為腫瘤細(xì)胞的遷移開(kāi)辟道路[12]。V-ATP 的C 亞基又稱VTP6L,是將H+排出胞外的關(guān)鍵部分,實(shí)驗(yàn)證實(shí)LASS2 能直接與VTP6L 結(jié)合,從而抑制腫瘤細(xì)胞的轉(zhuǎn)移、擴(kuò)散[13]。腫瘤細(xì)胞主要以糖酵解的形式產(chǎn)生能量,這使得腫瘤細(xì)胞內(nèi)H+濃度較 高[14]。LASS2 與VTP6L 結(jié) 合后可抑 制V-ATPase 向 細(xì)胞外泵H+能力,細(xì)胞外H+濃度降低,細(xì)胞內(nèi)的H+濃度升高可以使細(xì)胞處于應(yīng)激狀態(tài),激活JNK 信號(hào)通路釋放線粒體中的細(xì)胞色素C,當(dāng)細(xì)胞色素C 進(jìn)入細(xì)胞質(zhì)內(nèi)時(shí)使caspase-3 被激活產(chǎn)生線粒體途徑凋亡。因此LASS2 可以促進(jìn)腫瘤細(xì)胞的凋亡抑制其生長(zhǎng)[15]。綜上,LASS2 可以通過(guò)與液泡型ATP 酶結(jié)合促進(jìn)腫瘤細(xì)胞的凋亡并抑制其轉(zhuǎn)移。
2.2 LASS2 與神經(jīng)酰胺 神經(jīng)酰胺是可以調(diào)節(jié)細(xì)胞生長(zhǎng)、分化和凋亡的生物活性物質(zhì),它能通過(guò)多條途徑使線粒體內(nèi)的細(xì)胞色素C 釋放入胞質(zhì)內(nèi)進(jìn)而激活caspase引發(fā)線粒體凋亡。而LASS2 能誘導(dǎo)神經(jīng)酰胺合成酶的活性,增加神經(jīng)酰胺的合成,更多的神經(jīng)酰胺的下游分子如磷酸化的c-jun、bcl-2 家族和JNK 等進(jìn)入線粒體內(nèi),線粒體內(nèi)外膜之間的巨大滲透性通道PT 孔開(kāi)放釋放細(xì)胞色素C,細(xì)胞色素C 進(jìn)入細(xì)胞質(zhì)后與Apaf1 結(jié)合形成寡聚體再與procaspase9 相互作用激活caspase3 進(jìn)而激活下游caspases 引發(fā)細(xì)胞凋亡[2]。因此LASS2 可以通過(guò)神經(jīng)酰胺途徑誘導(dǎo)腫瘤細(xì)胞的凋亡。上述反應(yīng)概括見(jiàn)圖1。
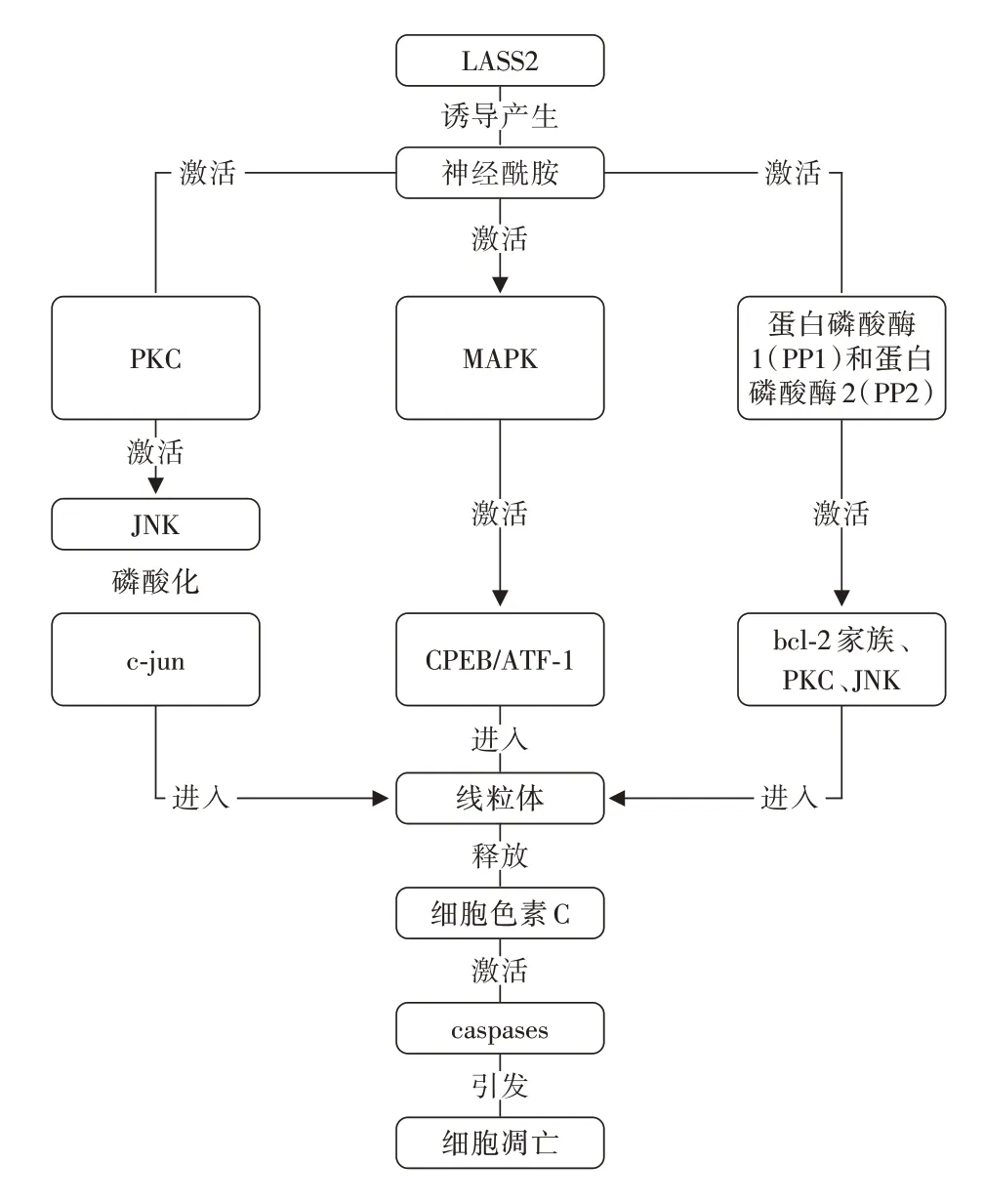
圖1 LASS2通過(guò)神經(jīng)酰胺途徑誘導(dǎo)腫瘤細(xì)胞凋亡示意圖Fig.1 Schematic diagram of LASS2 inducing tumor cell apoptosis through the ceramide pathway
2.3 LASS2 與細(xì)胞周期 細(xì)胞周期是由復(fù)雜的周期蛋白和周期蛋白依賴性激酶組成的蛋白激酶系統(tǒng)控制。在G1階段d 型細(xì)胞周期蛋白與CDK4 和CDK6 結(jié)合通過(guò)關(guān)鍵檢查點(diǎn)控制細(xì)胞的轉(zhuǎn)變,之后細(xì)胞周期可以自主進(jìn)行[16]。既往研究發(fā)現(xiàn)轉(zhuǎn)錄因子細(xì)胞腫瘤抗原p53 調(diào)控細(xì)胞周期中涉及眾多基因的表達(dá),并誘導(dǎo)細(xì)胞周期阻滯[17-19]。P21 是一種通用的G1 期細(xì)胞周期抑制劑,是第一個(gè)p53 效應(yīng)基因[20]。ZENG 等[21]證明LASS2 導(dǎo)致細(xì)胞 周期蛋白D1 和CDK4 下調(diào),誘導(dǎo)p21 表達(dá),增加p-p53 表達(dá),但未明顯影響p53 的表達(dá)。綜上,這些結(jié)果表明LASS2 過(guò)表達(dá)通過(guò)p53依賴途徑造成G0/G1 細(xì)胞阻滯。然而p21 也被認(rèn)為由p53獨(dú)立的信號(hào)通路調(diào)控。磷脂合成過(guò)程中,二酰基甘油和磷脂1-磷酸的生成是細(xì)胞周期G1-S 轉(zhuǎn)變的必要條件。鞘磷脂途徑調(diào)節(jié)著NF-κB 的活性。NICOLAE 等[22]已經(jīng)發(fā)現(xiàn)一種新的不依賴p53 的NF-κB 調(diào)控P21 的活性。既往研究表明NF-κB 通 過(guò) 細(xì) 胞 周 期 蛋 白D1 調(diào)控 細(xì) 胞 周 期[23-24]。SCHUMM 等[25]發(fā)現(xiàn)NF-κb 刺激細(xì)胞周期蛋白D1 的表達(dá)抑制p21 的表達(dá),揭示了NF-κB 是細(xì)胞周期調(diào)控物質(zhì)。因此,可能不僅p53 而且NF-κB 也調(diào)和這些監(jiān)管效果。LASS2 過(guò)表達(dá)是否可以通過(guò)NF-κB 途徑調(diào)控細(xì)胞周期,還是僅通過(guò)p53 途徑調(diào)控細(xì)胞周期仍待進(jìn)一步研究。
2.4 其他 LASS2 可以阻止ERK 的磷酸化,而激活的ERK能磷酸化Drp1。Drp1 的磷酸化程度決定了線粒體的動(dòng)態(tài)變化,決定線粒體是融合還是分裂[26]。LASS2 過(guò)表達(dá)時(shí)減少線粒體的分裂增加線粒體融合,導(dǎo)致線粒體外形狹長(zhǎng)[27]。線粒體分裂時(shí)可以增加腫瘤細(xì)胞的轉(zhuǎn)移和浸潤(rùn)能力[28]。因此LASS2 可以通過(guò)控制ERK/Drp1 途徑?jīng)Q定線粒體的動(dòng)態(tài)變化從而抑制腫瘤細(xì)胞的轉(zhuǎn)移、浸潤(rùn)[21]。
3 影響LASS2 基因表達(dá)的因素
微小RNA(microRNAs,miRNAs)是一類在真核生物中普遍存在含19~25 個(gè)堿基的非編碼性小RNA 分子,它能與mRNA 的3′-非編碼區(qū)結(jié)合而調(diào)控其表達(dá)。因此miRNA 在細(xì)胞的增殖、分化、凋亡、代謝和腫瘤的發(fā)生發(fā)展過(guò)程中有舉足輕重的作用。WANG 等[29]研究發(fā)現(xiàn)miRNA-9 在膀胱癌組織中的表達(dá)水平高于正常組織,模仿轉(zhuǎn)染miRNA-9 的細(xì)胞中LASS2 基因的表達(dá)水平下降,同時(shí)通過(guò)熒光素酶報(bào)告基因?qū)嶒?yàn)發(fā)現(xiàn)miRNA-9 可以與LASS2的3′-UTR直接結(jié)合從而抑制LASS2基因的表達(dá)。后續(xù)實(shí)驗(yàn)相繼證明miRNA-20a[30]、miRNA-3658[31]、miRNA-3622a[32]、miRNA-93[33]均可與LASS2 的3′-UTR 直接結(jié)合,抑 制 腫瘤細(xì)胞內(nèi)的LASS2 基因表達(dá)從而增加腫瘤細(xì)胞的增殖、擴(kuò)散和轉(zhuǎn)移能力。FAN 等[34]通過(guò)RTCA 增殖實(shí)驗(yàn)發(fā)現(xiàn)LASS2 基因表達(dá)下調(diào)的AGPAT9 轉(zhuǎn)染細(xì)胞和AGPAT9 轉(zhuǎn)染細(xì)胞相比細(xì)胞的增殖能力明顯增強(qiáng),RTCA 遷徙實(shí)驗(yàn)表明LASS2 基因表達(dá)下調(diào)的AGPAT9 轉(zhuǎn)染細(xì)胞和AGPAT9 轉(zhuǎn)染細(xì)胞相比細(xì)胞的遷徙能力明顯增強(qiáng)。實(shí)時(shí)定量RT-PCR檢測(cè)和免疫印跡分析均顯示上調(diào)AGPAT9 的表達(dá)將導(dǎo)致KLF4 和LASS2 的表達(dá)增加。綜上推測(cè),AGPAT9 可通過(guò)上調(diào)LASS2 基因的表達(dá)抑制腫瘤細(xì)胞的增殖和遷移能力。ZOU 等[9]利用實(shí)時(shí)RT-PCR 和蛋白印跡實(shí)驗(yàn)均發(fā)現(xiàn)轉(zhuǎn)染siRNA ATP6V0C 的細(xì)胞和對(duì)照組相比LASS2 的表達(dá)明顯受到抑制,進(jìn)一步利用激光共聚焦顯微鏡觀察LASS2 蛋白和ATP6V0C 的共定位信號(hào)明顯減弱。從而據(jù)此推測(cè)下調(diào)ATP6V0C 表達(dá)后抑制LASS2 基因表達(dá)是通過(guò)某種途徑激活了與LASS2 上游抑制性調(diào)控區(qū)域結(jié)合的轉(zhuǎn)錄因子,但其具體轉(zhuǎn)錄調(diào)控機(jī)制尚不清楚,有待進(jìn)一步實(shí)驗(yàn)研究。GU 等[35]ASGR1 在肝癌細(xì)胞中低表達(dá),而上調(diào)ASGR1 的表達(dá)能抑制肝癌細(xì)胞降低V-ATP 酶的活性同時(shí)能抑制肝癌細(xì)胞轉(zhuǎn)移、侵襲的能力。下調(diào)ASGR1 高表達(dá)的肝癌細(xì)胞的LASS2 基因能減少上述影響,進(jìn)一步實(shí)驗(yàn)證實(shí)ASGR1 能直接與LASS2 基因反應(yīng),據(jù)此推測(cè)ASGR1能調(diào)控LASS2 的表達(dá)。
4 LASS2 對(duì)不同腫瘤的作用
4.1 LASS2 與前列腺癌 MA 等[7]通過(guò)mRNA 差異顯示技術(shù)發(fā)現(xiàn)高轉(zhuǎn)移潛能的前列腺癌細(xì)胞系中LASS2 表達(dá)程度下降,而在無(wú)轉(zhuǎn)移潛能的前列腺癌細(xì)胞系中LASS2 表達(dá)程度升高。這種差異性的表達(dá)說(shuō)明前列腺癌細(xì)胞的轉(zhuǎn)移潛能與LASS2 的表達(dá)程度有關(guān)。研究[36-37]證實(shí)運(yùn)用shRNA靶向沉默LASS2 的表達(dá)能增加V-ATPase 的活性而增加前列腺癌細(xì)胞的轉(zhuǎn)移、增殖能力。YU 等[38]構(gòu)建了4 種含有不同功能域LASS2/TMSG1 的變異體,并將其穩(wěn)定轉(zhuǎn)染到具有高轉(zhuǎn)移潛能的人前列腺癌細(xì)胞系PC-3M-1E8 細(xì)胞中,運(yùn)用免疫沉淀、免疫熒光和免疫電鏡顯示LASS2/TMSG1 的同源域能與ATP6L 直接相互作用。結(jié)果證實(shí)LASS2 可以直接和V-ATPase 的C 亞基直接相互作用調(diào)節(jié)V-ATPase 酶的活性,在前列腺腫瘤細(xì)胞增殖、轉(zhuǎn)移的過(guò)程中發(fā)揮重要作用。
4.2 LASS2 與肝癌 游海燕等[39]研究發(fā)現(xiàn)高轉(zhuǎn)移潛能的肝癌細(xì)胞系HCCLM3 高表達(dá)LASS2 后其細(xì)胞的遷移能力受到明顯的抑制。唐寧等[40]利用構(gòu)建好的pCMV-HA2-LASS2 質(zhì)粒轉(zhuǎn)染入HCCLM3 細(xì)胞中,結(jié)果測(cè)得細(xì)胞的生長(zhǎng)受抑制且細(xì)胞的凋亡率明顯高于空白對(duì)照組,證實(shí)LASS2能抑制腫瘤細(xì)胞的增長(zhǎng)。LU 等[41]研究發(fā)現(xiàn)敲除LASS2 的小鼠更容易被誘導(dǎo)形成肝癌,并發(fā)現(xiàn)在LASS2 缺失的小鼠體內(nèi)miR-694 下調(diào)和靶基因Tnfaip3 上調(diào),推導(dǎo)其與肝癌發(fā)生的高風(fēng)險(xiǎn)有關(guān)。RUAN 等[42]研究發(fā)現(xiàn)LASS2 和TGF-β1低表達(dá)促進(jìn)肝腫瘤細(xì)胞的侵略性和不良預(yù)后,可能可以作為一種新的肝癌病人預(yù)后生物標(biāo)記物。
4.3 LASS2 與膀胱癌 WANG 等[43]對(duì)80 例膀胱腫瘤樣本通過(guò)免疫組織化學(xué)染色和實(shí)時(shí)定量PCR 方法檢測(cè)發(fā)現(xiàn)LASS2 的表達(dá)水平和膀胱癌的臨床和組織病理學(xué)參數(shù)有關(guān),LASS2 基因表達(dá)的缺失與膀胱腫瘤的增殖和轉(zhuǎn)移和顯著的相關(guān)性。通過(guò)對(duì)這80 例患者的生存狀態(tài)信息的收集發(fā)現(xiàn)LASS2 陰性組的生存率明顯低于LASS2 陽(yáng)性組。同時(shí)發(fā)現(xiàn)LASS2 在晚期膀胱癌中表達(dá)下調(diào)且與膀胱癌的分期有關(guān),且在腫瘤浸潤(rùn)深度和腫瘤復(fù)發(fā)方面,差異有統(tǒng)計(jì)學(xué)意義。在Ⅰ、Ⅱ級(jí)病人中LASS2 陽(yáng)性組的存活率明顯高于LASS2 陰性組。WANG 等[15]認(rèn)為L(zhǎng)ASS2 是膀胱癌患者的潛在預(yù)后因素,尤其是早期膀胱癌病人。同時(shí)該研究發(fā)現(xiàn)在RT4 細(xì)胞中利用siRNA 沉默LASS2 基因的表達(dá)能明顯上調(diào)V-ATP 酶的活性,同時(shí)細(xì)胞外H+將顯著升高。因此推測(cè)沉默LASS2 可以通過(guò)上調(diào)V-ATP 酶的活性促進(jìn)膀胱癌活動(dòng)。同時(shí)通過(guò)流式細(xì)胞檢測(cè)分析發(fā)現(xiàn)阿霉素能誘導(dǎo)RT4 細(xì)胞的凋亡,但是轉(zhuǎn)染si-LASS2 的RT4 細(xì)胞凋亡明顯受到抑制,據(jù)此推測(cè)LASS2 基因能增加膀胱癌細(xì)胞的化療敏感性。有研究[44]發(fā)現(xiàn)敲除LASS2 的人膀胱細(xì)胞癌EJM3 細(xì)胞系在裸鼠中的生長(zhǎng)情況明顯好于對(duì)照組。敲除LASS2 后細(xì)胞表現(xiàn)出明顯的多態(tài)性且MMP2、MMP9 的活性顯著增高,因此推測(cè)出敲除LASS2 更有利于膀胱腫瘤的發(fā)生、發(fā)展。HUANG 等[27]通過(guò)基底膜基質(zhì)侵入實(shí)驗(yàn)發(fā)現(xiàn)LASS2 過(guò)表達(dá)的BIU87 膀胱癌細(xì)胞系和J82 膀胱癌細(xì)胞系侵襲能力下降,而LASS2 沉默的5637 膀胱癌細(xì)胞系侵襲能力增強(qiáng)。通過(guò)CCK-8 分析發(fā)現(xiàn)過(guò)表達(dá)LASS2 后將損傷膀胱癌細(xì)胞在阿霉素治療后的生存能力,沉默LASS2 基因后將提升膀胱癌細(xì)胞在阿霉素治療后的生存能力。同時(shí)采用流式細(xì)胞術(shù)進(jìn)行JC-1 染色發(fā)現(xiàn)LASS2 是線粒體膜電位負(fù)性調(diào)控因素,進(jìn)一步實(shí)驗(yàn)發(fā)現(xiàn)過(guò)表達(dá)LASS2 基因可以下調(diào)線粒體分裂蛋白p-Drp1、Drp、Fis1 等的表達(dá)。綜上,HUANG 等[27]推測(cè)LASS2 能通過(guò)調(diào)控ERK-Drp1 途徑誘導(dǎo)線粒體動(dòng)態(tài)變化抑制膀胱腫瘤細(xì)胞的浸潤(rùn)和化療耐受。目前許多研究證實(shí)LASS2 是miRNA-20a[29]、miRNA-3658[30]、miRNA-3622a[31]、miRNA-93[32]、miRNA-9[21]等miRNA 的靶基因,這些miRNA 可以通過(guò)調(diào)控LASS2 的表達(dá)影響膀胱腫瘤細(xì)胞的發(fā)生、發(fā)展。
4.4 LASS2 與乳腺癌 FAN 等[34]研究發(fā)現(xiàn)LASS2 的表達(dá)在藥物耐受的乳腺癌細(xì)胞MCF-7/ADR 中明顯低于藥物敏感的乳腺癌細(xì)胞MCF-7。上調(diào)MCF-7/ADR 細(xì)胞LASS2 基因的表達(dá)可增加其對(duì)包括阿霉素在內(nèi)的多種藥物的敏感性,下調(diào)MCF-7 細(xì)胞LASS2 基因的表達(dá)可降低其化療敏感性。進(jìn)一步研究證實(shí)LASS2 過(guò)表達(dá)可以通過(guò)顯著增加細(xì)胞外pH 和溶酶體的pH 使更多的阿霉素進(jìn)入細(xì)胞并停留在細(xì)胞核內(nèi),而增加乳腺腫瘤細(xì)胞對(duì)DOX 細(xì)胞毒性的敏感性。LASS2 表達(dá)下調(diào)可能預(yù)測(cè)化療耐受。MEI 等[44]通過(guò)lipofectin 轉(zhuǎn)染方法將構(gòu)建好的LASS2 過(guò)表達(dá)質(zhì)粒轉(zhuǎn)染入人乳腺癌細(xì)胞系MCF-7 中,通過(guò)將其與對(duì)照組比較發(fā)現(xiàn),MCF-7 細(xì)胞中的V-ATP 酶活性明顯下降,細(xì)胞外H+濃度顯著降低,MMP-2 的活性下降。因此推測(cè)LASS2可以通過(guò)降低V-ATPase 活性和細(xì)胞外氫離子濃度,使分泌的MMP-2 失活,從而抑制乳腺癌細(xì)胞體外的生長(zhǎng)和侵襲。可能為乳腺癌轉(zhuǎn)移的診斷和治療提供了一個(gè)新的靶點(diǎn)。
4.5 LASS2 與肺癌 徐海芹等[3]研究發(fā)現(xiàn)高轉(zhuǎn)移潛能、增值能力強(qiáng)的肺癌亞系95D 中LASS2 的表達(dá)顯著低于低轉(zhuǎn)移潛能、增殖能力弱的肺癌亞系95C。因此,認(rèn)為L(zhǎng)ASS2基因可能參與抑制肺癌細(xì)胞的增殖、侵襲及轉(zhuǎn)移過(guò)程。徐曉燕等[45]將構(gòu)建好的PcDNA3-TMSG-1 質(zhì)粒轉(zhuǎn)染如95D 細(xì)胞中發(fā)現(xiàn)LASS2 的表達(dá)上調(diào),VATP6L 的表達(dá)水平下降,其V-ATPase 活性下降及細(xì)胞外H+濃度下降。推測(cè)出LASS2可通過(guò)與ATP6L 結(jié)合抑制V-ATPase 活性進(jìn)而改變肺癌細(xì)胞體外侵襲能力。
4.6 LASS2 與甲狀腺癌 甲狀腺癌是內(nèi)分泌系統(tǒng)的常見(jiàn)病和多發(fā)病,研究證實(shí)大部分甲狀腺癌存在至少一種分子遺傳學(xué)改變,這些分子遺傳學(xué)改變可作為潛在的分子標(biāo)志物[46]。ZENG 等[21]研究發(fā)現(xiàn)LASS2 基因在乳頭狀甲狀腺癌的表達(dá)程度比相鄰甲狀腺組織或結(jié)節(jié)性甲狀腺腫組織中相對(duì)較低。實(shí)驗(yàn)中還發(fā)現(xiàn)LASS2 的過(guò)表達(dá)顯著增加了p21的表達(dá),抑制了cyclin D1 和cyclin 依賴性激酶4 的表達(dá),增加了p-p53 的表達(dá)。據(jù)此,推測(cè)LASS2 的過(guò)表達(dá)通過(guò)p53依賴通路導(dǎo)致G0/G1 細(xì)胞周期阻滯抑制PTC 細(xì)胞增殖,促進(jìn)細(xì)胞凋亡。因此,LASS2 可以作為乳頭狀甲狀腺癌中的一種新的生物標(biāo)志物。
5 結(jié)語(yǔ)
綜上所述,LASS2 在多種腫瘤組織中表達(dá)下調(diào),被認(rèn)為是一種新的腫瘤轉(zhuǎn)移抑制基因,同時(shí)具有促進(jìn)惡性腫瘤細(xì)胞凋亡和抑制轉(zhuǎn)移的作用。LASS2 在腫瘤中的低表達(dá)使其具有成為新型腫瘤標(biāo)記物的潛能,但在腫瘤的早期LASS2 不易被檢測(cè),用其作為腫瘤的早期診斷具有敏感性較低的缺點(diǎn)。后續(xù)研究提升該篩查的敏感性有望幫助早期診斷改善患者預(yù)后。原發(fā)性腫瘤可以通過(guò)手術(shù)和放射治療,但轉(zhuǎn)移是惡性腫瘤的基本生物學(xué)特征,對(duì)于已經(jīng)播散的腫瘤往往難以通過(guò)上述方法獲得令人滿意的治療效果。腫瘤的轉(zhuǎn)移是個(gè)復(fù)雜的多步驟的過(guò)程,關(guān)于LASS2 靶向治療干預(yù)腫瘤進(jìn)展的研究逐漸成為新的研究熱點(diǎn)。目前有大量研究確定LASS2 在多種惡性腫瘤的發(fā)生、發(fā)展過(guò)程中發(fā)揮重要作用。但對(duì)于LASS2 發(fā)揮其生物效應(yīng)的具體分子機(jī)制和其上游事件任不明確,仍需要投入更多精力做進(jìn)一步的探索研究。隨著探索研究的深入,LASS2 有望為多種腫瘤的診斷、治療和評(píng)估預(yù)后提供新的思路,提高患者的生存率和生存質(zhì)量。
- 實(shí)用醫(yī)學(xué)雜志的其它文章
- 抗氧化劑預(yù)防抗結(jié)核藥物致肝損傷的隨機(jī)開(kāi)放研究
- 單通道微創(chuàng)經(jīng)皮腎鏡碎石取石術(shù)聯(lián)合輸尿管軟鏡碎石取石術(shù)在斜仰臥截石位下治療鹿角形結(jié)石的臨床分析
- 照顧者反應(yīng)對(duì)接受抗反轉(zhuǎn)錄病毒治療艾滋病患兒照顧者負(fù)擔(dān)的影響
- 計(jì)算機(jī)輔助面部分析法在Noonan綜合征中的應(yīng)用
- 頸部血管超聲、CT血管成像及磁共振成像在急性缺血性腦卒中患者頸動(dòng)脈狹窄診斷中的應(yīng)用比較
- 最小表觀擴(kuò)散系數(shù)、表觀擴(kuò)散系數(shù)差及磁共振增強(qiáng)掃描對(duì)乳腺導(dǎo)管原位癌和微浸潤(rùn)的鑒別診斷

