杜鵑紅山茶的組織培養技術研究初探
韓 偉,馬麗霞
(韶關學院 英東生命科學學院,廣東 韶關512005)
杜鵑紅山茶(Camellia changii)是山茶科山茶屬植物,與山茶、油茶、茶等植物同科同屬.杜鵑紅山茶花似山茶葉像杜鵑,花大而鮮艷,一年四季都能開花,俗稱“四季茶”,與普通的山茶相比具有極高的觀賞價值.杜鵑紅山茶是山茶科中的一個極其珍稀的品種,其自然種群分部狹窄,目前僅見于廣東省陽春縣河尾山,結實率和種子萌發率都很低,一度曾瀕臨滅絕,有“植物界大熊貓”之稱,該種已被《中國物種紅色名錄》列為極危種[1].因此,為了更好的保護這一珍貴的植物資源,對杜鵑紅山茶快速繁殖技術的研究迫在眉睫.
杜鵑紅山茶繁殖的研究目前主要集中在傳統的人工扦插[2-4]和嫁接繁殖[5-7]方面,而利用植物組織培養技術對其進行繁殖的研究報道較少[8-12].如將杜鵑紅山茶的幼嫩的莖段在無菌條件下進行繁殖,預期獲得大量種苗,為生產花卉的企業提供大量的苗木,進而為地方經濟建設服務.同時也為探索木本花卉快速繁殖提供借鑒.但是杜鵑紅山茶屬于山茶科植物,該科植物體中通常含有大量的酚類化合物,木質素、單寧或色素,所以在組織培養過程中極易導致外植體發生裼變,部分細胞也會因褐變物質的毒害而死亡,且內外生菌的污染對誘導分化產生了一定的影響.筆者利用植物組培技術對杜鵑紅山茶的繁殖進行了探討,主要從不同激素配比對杜鵑紅山茶葉片和莖段愈傷組織的影響進行探討,又關注了外植體污染和褐化的問題,旨在為其組織培養技術提供參考.
1 材料和方法
1.1 材料 于天氣晴朗的上午8:00~10:00時剪取杜鵑紅山茶(用于植株嫁接,見圖1-A)上的幼嫩的葉片和帶側芽的莖段(剛抽出不久,半木質化).
1.2 培養條件 以MS為基本培養基,按表1激素配比配制培養基(瓊脂7.5 g/L,蔗糖30 g/L,pH 5.8,121℃高壓滅菌 20 min).培養溫度 26±1℃,濕度 70%~80%,光照時間 16 h/d,光照強度 1 500~2 000 lx,20 d 繼代 1 次.
1.3 外植體的預處理 從杜鵑紅山茶母株上剪取較嫩的葉片,側芽和頂芽飽滿的新梢后,用流水反復沖洗1 h,洗去表面污物后用洗衣粉仔細清洗,再用清水沖洗、半涼干,放置在燒杯中用1.4 g/L抗壞血酸浸泡1 h.

圖1 杜鵑紅山茶的組織培養
1.4 外植體接種
將取材多余的部分進行裁剪,待接種的外植體在75%的酒精中表面消毒30 s,雙蒸水沖洗3~5次;再置于0.1%的氯化汞中消毒9 min,雙蒸水洗滌4~6次;消毒好的外植體置于濾紙上晾干表面水分并準備接種.將葉片切成約0.7~1 cm的小塊,將帶側芽的莖段切成1.0~1.5 cm的小段,每段留1~2個芽,分別接種培養基上(見表1),每種培養基分別接葉片、莖段各30瓶,每瓶接種2~3個外植體,觀察愈傷組織誘導情況,統計誘導率.另外,將杜鵑紅山茶帶側芽的莖段作為外植體接于MS+6-BA 1 mg/L+IBA 0.01 mg/L+GA3 10 mg/L[8]或MS+6-BA 1 mg/L+IBA 0.01 mg/L的培養基上培養30 d后,觀察側芽的萌發情況,統計萌發率.
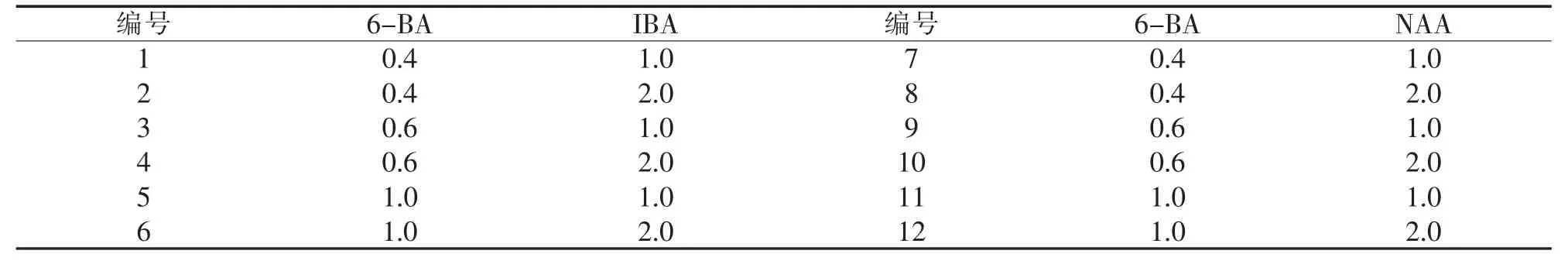
表1 誘導愈傷組織的不同激素配比/(mg/L)
2 結果和分析
2.1 培養基中的激素配比對杜鵑紅山茶葉片和莖段愈傷組織誘導的影響
將杜鵑紅山茶的葉片、莖段接種于表1中的培養基上后,葉片和莖段都能誘導出愈傷組織.觀察發現在葉片和莖段分別培養13,15 d出現愈傷組織.培養30 d后,葉片在不同激素組合中愈傷組織的狀態有較大差別:在含有NAA的培養基上,愈傷組織顏色發黃,較致密(見圖1-B);而在含有IBA的培養基上的愈傷組織顏色為白色或淡綠色,較為疏松(見圖1-C).莖段誘導出的愈傷組織致密并帶紅色(見圖1-D).與其它激素配比相比,葉片和莖段在6-BA/IBA或者6-BA/NAA配比為1∶1時,愈傷組織誘導率較高,當6-BA濃度一定時、IBA或NAA濃度相對低時,莖段愈傷組織的誘導率相對較高(見表 2).葉片在MS+6-BA 1.0 mg/L+NAA 1.0 mg/L培養基上愈傷組織的誘導率達到最高,為52.3%,莖段在MS+6-BA 1.0 mg/L+IBA 1.0 mg/L培養基上愈傷組織的誘導率達到最高,為56.8%.
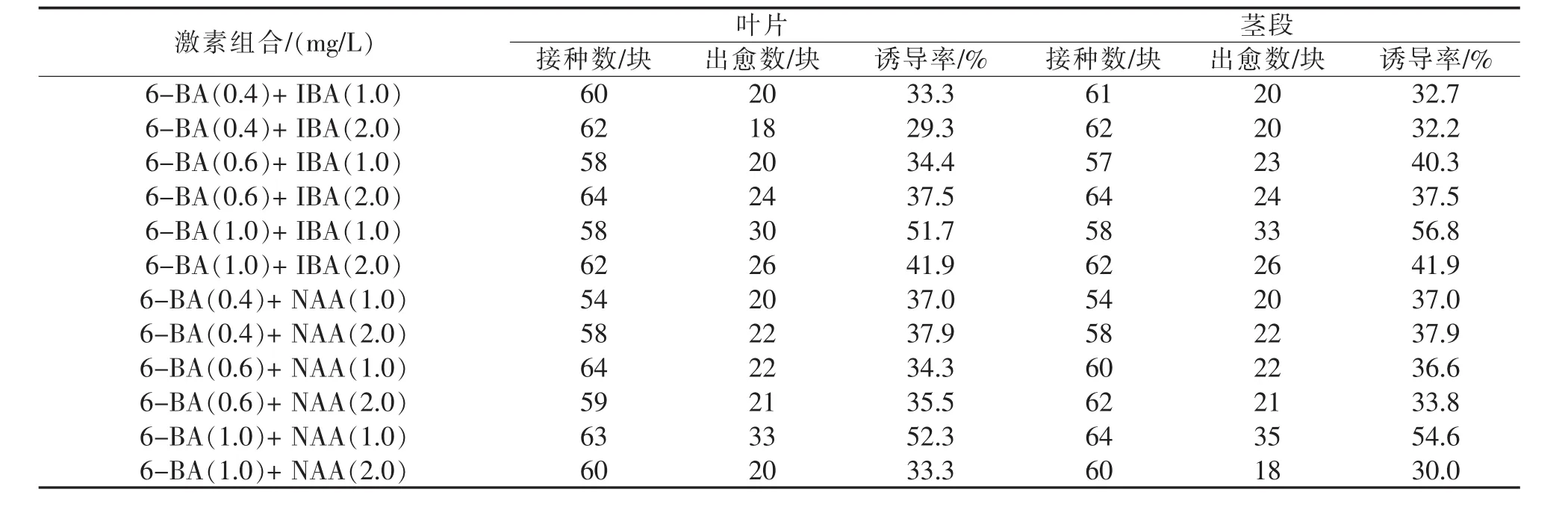
表2 不同激素配比對杜鵑紅山茶葉片和莖段愈傷組織誘導的影響
2.2 培養基中的激素配比對杜鵑紅山茶帶側芽的莖段上芽萌發的影響
當把杜鵑紅山茶帶側芽的莖段接種到兩種不同的培養基上(見表3),培養15 d后,可觀察到莖段上的側芽和頂芽有萌動的現象,芽周圍的葉柄脫落,芽苞開始膨大(見圖1-E).培養30 d后可以看到葉片長出(見圖1-F).莖段的基部沒有看到愈傷組織產生.培養基中添加GA3后,芽的萌發率可達到57.1%,沒有添加GA3的培養基芽的萌發率只達到46.4%,說明培養基中添加GA3有利于杜鵑紅山茶莖段上芽的萌發.

表3 不同的激素配比對杜鵑紅山茶帶側芽的莖段上芽萌發的影響
3 討論
3.1 培養基中的激素配比對誘導愈傷組織的影響
植物愈傷組織的誘導中,激素的濃度和種類起著重要作用.山茶科植物常用的誘導愈傷組織的激素有2,4-D、6-BA、NAA和IBA[13-16].實驗研究究發現培養基中細胞分裂素/生長素配比為1∶1時較適宜誘導杜鵑紅山茶的愈傷組織,但石蘭蓉[12]研究結果表明MS+2,4-D 2.0 mg/L+6-BA 0.5 mg/L是杜鵑紅山茶愈傷誘導的最佳培養基,其細胞分裂素/生長素配比為1:4,與本文結果有不同之處,可能是由外植體生理年齡及生長狀態不同導致的.培養基MS+6-BA 1.0 mg/L+NAA 1.0 mg/L適宜誘導葉片的愈傷組織的產生,誘導率最高為52.3%,NAA在葉片的愈傷組織誘導中的效果優于IBA;培養基MS+6-BA 1.0 mg/L+IBA 1.0 mg/L中莖段的愈傷組織誘導率最高為56.8%,而IBA在莖段的愈傷組織誘導中的效果優于NAA.可見,不同的外植體在愈傷組織誘導時所需的激素種類及濃度均不同.
杜鵑紅山茶莖段在MS+BA 1 mg/L+IBA 0.01 mg/L+GA3 10 mg/L的培養基上培養30 d,芽萌發率可高達57.1%,與沒有添加GA3的培養基相比,芽的萌發率較高,說明GA3在杜鵑紅山茶莖段上芽的萌發時起著重要的作用,有利于芽的萌發,提高芽的萌發率.另外,GA3通常在植物組織培養中用作促進芽伸長的一種激素[17].因此,考慮在木本植物的組織培養中添加一定量的GA3,可促進芽的萌發和伸長,加快芽的生長速度.本文所得到杜鵑紅山茶莖段上的芽萌發率57.1%低于蔡靜如等[8]研究的結果(芽的萌發率可達到68%),原因可能是采取的外植體生理年齡不同,本文采取的是嫁接植株上的杜鵑紅山茶莖段,而前人采用的是實生苗上的莖段.
3.2 污染探討
有效控制微生物污染是植物組織培養成功的關鍵技術之一.山茶科植物組織培養中污染的原因主要由外植體、培養基和無菌操作3個方面引起的,其中以外植體方面的污染最復雜,也最難控制.外植體的污染主要由表面消毒不徹底和內生菌造成的,通常接種之后的一周就會表現出來.試驗中發現杜鵑紅山茶的組織培養中外植體的污染主要由內生菌造成的.本文通過外植體接種前的預處理,取材時選用剛抽生的新梢及縮短繼代的時間,有效的降低了外植體內生菌的污染率.
3.3 外植體褐化
外植體褐化主要是因為茶組織分泌的多酚類物質被氧化所致.由于山茶科植物組織中酚類物質含量較高,當酚類化合物含量高時,木質素、單寧或色素形成就多,易導致褐變的發生,有些細胞會因褐變而死亡[18].杜鵑紅山茶葉片和莖段在培養過程中都有褐化的現象,切口褐化對愈傷組織生長會產生不利影響.若是局部褐化,對愈傷組織的誘導影響較小,全部褐化會導致外植體快速死亡,阻礙愈傷組織的誘導.與葉片、腋芽、頂芽比較,莖段的褐化現象較輕.同時發現添加吸附劑(如活性碳)和添加抗氧化劑(如PVP)的培養基,或是外植體經過Vc浸泡處理的,外植體褐化現象較輕,褐變得到一定控制;沒有處理的培養基褐化較嚴重.

