HIF-1α對大鼠內皮細胞通透性的影響及作用機制
蔣智永,胡子健,孟承穎 ,黃海良,段聲梁,蔣 薇,王 歡,余又新,孫業祥,方林森,胡德林
燒傷早期組織缺血缺氧是血管通透性改變的重要機制,大量的炎癥因子及轉錄因子參與其中,而缺氧誘導因子-1(hypoxia-inducible factor 1α,HIF-1α)在燒傷休克早期血管通透性增加中占有重要位置;此外燒傷早期血管通透性改變主要發生在微靜脈和毛細血管,微靜脈由內皮細胞、周靜脈、基底膜及少量平滑肌組成,而內皮細胞在血管通透性改變中起著重要作用,因此,研究血管通透性的變化及其調控機制對燒傷休克的防治以及預防燒傷早期組織器官損害均有重要意義。然而,燒傷后血管內皮細胞通透性變化的作用機制及調控途徑目前尚不清楚,該實驗以原代大鼠主動脈內皮細胞為研究對象,通過探討HIF-1α/內皮素-1(endothelin-1,ET-1)信號通路的調控作用以期為進一步闡明燒傷早期血管通透性改變的機制及燒傷的臨床治療提供新思路。
1 材料與方法
1.1 材料原代大鼠主動脈內皮細胞購自武漢原生原代生物醫藥科技有限公司;RNA提取試劑盒購自購自天根生化科技(北京)有限公司;反轉錄試劑盒購自美國Thermo Fish公司;RT-PCR試劑盒購自大連TakaRa公司;細胞培養基購自美國Hyclone公司;胎牛血清購自美國Gibco公司;RIPA細胞裂解液、BCA蛋白定量試劑盒購自杭州碧云天生物技術研究所;磷酸甘油醛脫氫酶(reduced glyceraldehyde-phosphate dehydrogenase,GAPDH)、HIF-1α、ET-1、內皮素受體A(endothelin receptor A,ETA)、ETB和閉鎖小帶(zonula occludens,ZO-1)抗體購自美國Santa Cruz公司;PCR引物購自美國Invitrogen公司。
1.2 方法
1.2.1細胞培養 應用含10%胎牛血清、100 U/ml青霉素、100 g/ml的鏈霉素、pH 7.4的RPMI1640的培養基于37 ℃、5% CO2培養箱中培養原代大鼠主動脈內皮細胞,隔天換液,觀察細胞生長狀況,當細胞匯合度約為90%時,進行消化、傳代、種板,按1×105/孔接種于6孔細胞培養板。繼續培養細胞至匯合度為80%時,將培養基更換為無血清RPMI1640培養基,進行后續實驗。
1.2.2載體構建 HIF-1α干擾、過表達及其陰性對照組載體均由上海吉凱基因化學技術有限公司構建,干擾載體分別標記為短發夾RNA(short hairpin RNA,shRNA-Ⅰ)、shRNA-Ⅱ、shRNA-Ⅲ和短發夾RNA陰性對照組(short hairpin RNA negative control group,shRNA-NC),干擾序列見表1。過表達載體標記為GV230/HIF-1α和GV230。

表1 HIF-1α干擾序列
1.2.3細胞轉染及穩轉細胞株篩選 按1×106/孔將細胞接種于6孔細胞培養板,繼續培養細胞至匯合度為70%~80%,使用Lipofectamine 2000并參照其說明書分別將HIF-1α干擾及過表達載體轉染至原代大鼠主動脈內皮細胞,同時設置陰性對照組。6 h后更換為含200 μg/ml遺傳霉素G418(geneticin,G418)的細胞培養基篩選穩轉細胞株。同時,抑制劑組BQ123和BQ788先于GV230/HIF-1α 1 h加入細胞培養基。
1.2.4RT-PCR 應用預冷的PBS洗滌細胞3次,參照細胞總RNA提取試劑盒說明書提取細胞總RNA。以總RNA為模板,參照逆轉錄試劑盒說明書合成cDNA第一鏈。以cDNA為模板,使用ABI7500 RT-PCR儀檢測相關基因的表達。RT-PCR反應程序為:95 ℃、5 s;60 ℃、34 s,設置循環數為40。以β-actin作為內參,采用2-ΔΔCt法比較分析各基因表達,PCR引物序列見表2。

表2 RT-PCR引物序列
1.2.5Western blot 從RIPA細胞裂解物中提取細胞的總蛋白。用BCA方法定量后,將樣品以50 μg/孔的劑量進行電泳和膜轉化。轉移完成后,5%脫脂奶粉在室溫下密封1.5 h,TBST洗滌3 min,每種蛋白抗體根據抗體說明書操作,在4 ℃下孵育過夜,每次用TBST洗滌3次,每次5 min。相應的次級抗體在室溫下孵育1.5 h,TBST每次洗滌3次,每次洗滌10 min,ECL發光、顯影。Quantity One灰度分析軟件檢測各目的蛋白灰度值,以β-actin為內參計算其相對表達量。
1.2.6單層內皮細胞膜通透系數檢測 將各組內皮細胞按1×105/孔接種于24孔Transwell小室,37 ℃、5% CO2培養8 h待其形成細胞單層。雙層小室的頂室加入FITC-albumin,底室加入D-Hank’s液,在37 ℃、5% CO2孵育45 min并抽吸雙室的頂部和底部腔室液體。在熒光分光光度計波長為488 nm下測定各樣品熒光強度(optical density,OD)值OD488 nm,計算單層內皮細胞膜通透系數。

2 結果
2.1 HIF-1α shRNA有效序列篩選將3條HIF-1α shRNA分別轉染原代大鼠主動脈內皮細胞,24 h后RT-PCR和Western blot分別檢測HIF-1α的表達,同時設置shRNA-NC組作為對照組。結果顯示:shRNA-Ⅰ、shRNA-Ⅱ 和shRNA-Ⅲ 的干擾效率分別為(67.14±7.28)%、(83.55±9.16)%和(52.84±6.48)%。shRNA-Ⅰ、shRNA-Ⅱ 和shRNA-Ⅲ組分別和shRNA-NC比較(T=22.222,P<0.001;T=24.449,P<0.001;T=15.278,P<0.001),shRNA-Ⅱ 的干擾效率最高,差異有統計學意義(P<0.01),見圖1。
2.2 HIF-1α低表達及過表達對細胞膜通透性相關蛋白表達的影響分別將shRNA-Ⅱ及GV230/HIF-1α轉染原代大鼠主動脈內皮細胞,應用濃度為200 μg/ml G418篩選4周,構建穩轉細胞株。應用RT-PCR和Western blot分別檢測HIF-1α、ET-1、ETA、ETB和ZO-1 mRNA和蛋白表達水平的變化。檢測結果顯示:與shRNA-NC組相比,穩轉shRNA-Ⅱ組HIF-1α(T=22.73,P<0.001)、ET-1(T=17.99,P<0.001)、ETA(T=11.27,P=0.004)和ETB(T=23.19,P=0.001) mRNA和蛋白表達均明顯降低,而ZO-1(T=12.46,P=0.002)則顯著升高,差異有統計學意義(P<0.01),見圖2A、2B。與轉染GV230組比較,穩轉GV230/HIF-1α組HIF-1α(T=13.23,P=0.002)、ET-1(T=14.86,P=0.001)、ETA(T=14.86,P=0.001)和ETB(T=27.29,P=0.001) mRNA和蛋白表達顯著升高,而ZO-1(T=16.17,P<0.001)則顯著降低,差異有統計學意義(P<0.01),見圖2C、2D。
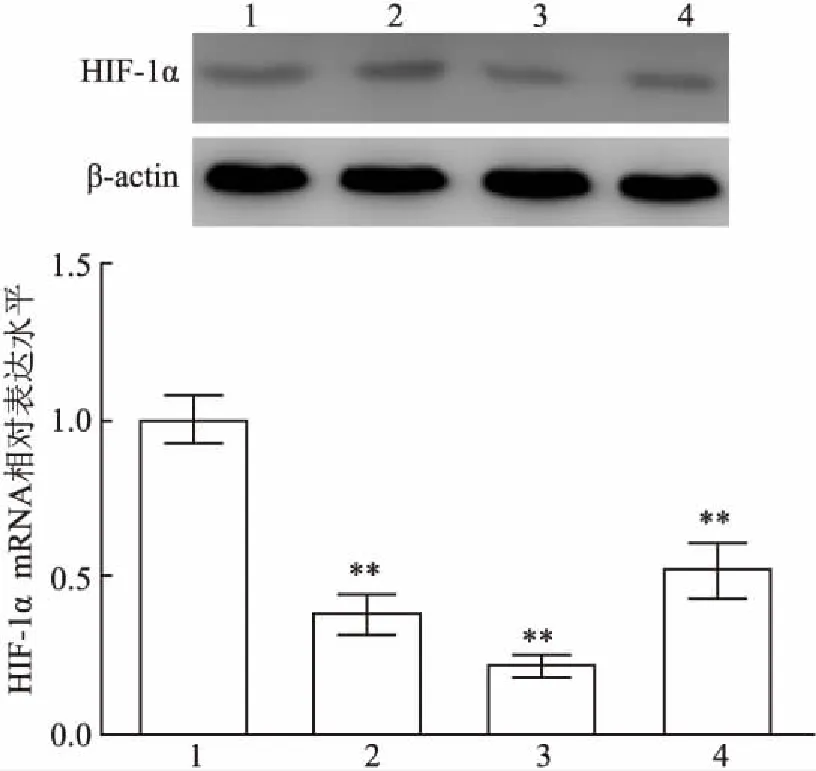
圖1 轉染不同shRNA對HIF-1α表達的影響
2.3 HIF-1α過表達對大鼠主動脈內皮細胞通透性系數的影響分別檢測GV230組和GV230/HIF-1α組樣品的熒光強度值(OD488 nm),并將GV230組細胞通透系數均一化為100%,計算GV230/HIF-1α組單層內皮細胞膜通透性系數。結果顯示,與GV230組比,GV230/HIF-1α(T=6.765,P<0.001)組細胞通透性系數明顯升高,差異有統計學意義(P<0.01),見圖3。
2.4 阻斷HIF-1α/ET-1信號通路對相關蛋白表達和細胞通透性的影響聯合應用濃度分別為10 nmol/L的BQ123和1 nmol/L的BQ788預處理穩轉GV230/HIF-1α大鼠主動脈內皮細胞1 h,RT-PCR和Western blot分別檢測HIF-1α、ET-1、ETA、ETB和ZO-1 mRNA和蛋白表達。同時,熒光分光光度計檢測各組熒光度值。結果顯示,BQ123和BQ788能夠抑制HIF-1α誘導的ETA和ETB表達、增強ZO-1的表達,單層細胞膜通透性系數降低,差異有統計學意義(P<0.01),見圖4、5。

圖2 干擾及過表達HIF-1α對細胞膜通透性相關基因表達的影響
A:HIF-1α干擾后相關mRNA表達;B:HIF-1α干擾后相關蛋白質表達;C:HIF-1α過表達后相關mRNA表達;D:HIF-1α過表達后相關蛋白質表達;1:轉染shRNA-NC組;2:穩轉shRNA-Ⅱ組;3:轉染GV230組;4:穩轉GV230/HIF-1α組;與shRNA-NC組比較:**P<0.01;與GV230組比較:##P<0.01

圖3 HIF-1α過表達對內皮細胞通透性系數的影響與GV230組比較:**P<0.01

圖4 阻斷HIF-1α/ET-1信號通路對相關蛋白的mRNA及蛋白質表達影響
A:阻斷HIF-1α/ET-1信號通路相關mRNA表達; B:阻斷HIF-1α/ET-1信號通路相關蛋白質表達;1:GV230/HIF-1α組;2:GV230/HIF-1α+BQ123/BQ788組;與GV230/HIF-1α組比較:**P<0.01
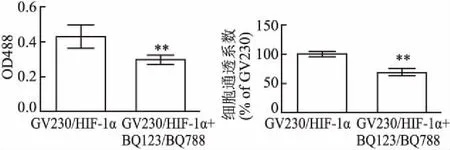
圖5 阻斷HIF-1α/ET-1信號通路對細胞膜通透性影響
3 討論
細胞通透性改變是炎性反應、組織缺氧以及細胞代謝障礙等多種疾病的重要病理過程。燒傷早期血管通透性改變受多種因素調節,而內皮細胞損傷占有重要地位[1],內皮細胞在組織和血管中起生理屏障作用[2-3],這道屏障允許小分子物質通過,禁止大分子物質通過;而大分子物質通過細胞鏈接、細胞上的窗孔和跨細胞途徑跨越細胞通過內皮細胞屏障到達組織中,大量血漿樣液體及高分子物質從血管內滲出血管外,引起血容量驟減造成休克發生和發展。而機體缺氧更使血管通透性增加,這樣反復形成惡性循環[4]。燒傷早期血管活性物質及炎性介質釋放改變了血管結構,從而改變血管通透性[5]。但是至目前為止,燒傷早期血管通透性改變發生的具體機制仍不明確[6],因而臨床更無有效的預防治療手段來降低血管通透性。
HIF-1α是一種異源二聚體轉錄因子并廣泛分布于人體內,它由120 ku的HIF-1α和91~94 ku的HIF-1β兩個亞單位組成[7]。正常情況下,機體合成的HIF-1蛋白很快失去活性,HIF-1蛋白只有在機體缺氧條件下才能具有活性。其中α亞基決定著HIF-1的調控活性,被激活的HIF-1α通過增加與下游基因的缺氧反應元素結合,從而調控多種轉錄因子的轉錄和翻譯[8]。
ET-1是內皮細胞分泌的血管活性肽,具有強烈的縮血管作用,而燒傷早期由于機體缺氧ET-1高度表達,研究[ 9]表明ET-1可以通過與其相應受體結合而發揮各種生物活性,而ET-1啟動子的某位點可以結合HIF-1,從而促進內皮細胞ET-1表達的激活,ET-1在炎癥反應方面有重要作用,如刺激中性粒細胞和巨噬細胞釋放各種促炎因子,導致失控性炎癥反應,結果導致血管內皮細胞損傷加重[10],通透性增加,組織缺氧加重細胞損傷,形成恐性循環導致多器官功能障礙綜合征[11]。
研究[12-14]顯示當大鼠缺血缺氧時,HIF-1α、ET-1、ETA、ETB mRNA和蛋白表達水平均顯著升高,提示 HIF-1α可能參與了主動脈內皮細胞通透性的調控,但是其作用機制尚未闡明。
本研究結果顯示HIF-1α能明顯提高細胞膜通透性系數,應用ET-1信號通路抑制劑預處理HIF-1α過表達細胞株后細胞膜通透性系數則明顯降低,該結果進一步證明HIF-1α促進血管內皮細胞通透性升高的可能性,同時說明,HIF-1α/ET-1信號軸在調控燒傷大鼠血管通透性方面具有重要作用。

