磁共振成像診斷常見中樞神經(jīng)系統(tǒng)脫髓鞘疾病的研究進展
復旦大學附屬華山醫(yī)院放射科,上海 200040
多發(fā)性硬化(multiple sclerosis,MS) 和視神經(jīng)脊髓炎譜系疾病(neuromyelitis optica spectrum disorders,NMOSD)是常見的中樞神經(jīng)系統(tǒng)脫髓鞘疾病。近年來,磁共振成像(magnetic resonance imaging,MRI) 診斷技術的發(fā)展以及自身免疫性抗體檢測技術的進步,帶來了新的臨床診斷標準以及指南和共識的快速更新。從2015年的NMOSD診斷標準,到2016年 的 MAGNIMS(magnetic resonance imaging in multiple sclerosis) 診斷標準[1], 再到2017年的McDonald標準[2]以及2018年關于髓鞘少突膠質細胞糖蛋白(myelin oligodendrocyte glycoprotein,MOG)抗體檢測的國際推薦,MRI在診斷中樞神經(jīng)系統(tǒng)脫髓鞘疾病中的價值正日益獲得重視。皮質或皮質下病灶、中央靜脈征和腦膜增強等影像學標志以及不同的病灶特征是指導鑒別診斷的重要依據(jù),這些影像學特征作為診斷和評估預后的依據(jù)也不斷得到豐富。自身免疫性抗體檢測和影像學特征的差異提示MOG-免疫球蛋白G(immunoglobulin G,IgG)相關腦脊髓炎(MOG-IgG-associated encephalomyelitis,MOGEM)是不同于MS和NMOSD的一類獨立疾病,MOG-EM的臨床表現(xiàn)和影像學特征也已成為當前研究的熱點。此外,成像技術的發(fā)展也促進了對疾病認識的不斷深入,隨著超高場強MRI被批準用于臨床診斷,7T MRI能夠清晰地呈現(xiàn)皮質病灶和中央靜脈征等傳統(tǒng)MRI無法辨別的細微病變。本文通過復習近年來發(fā)表的有關MRI診斷常見中樞神經(jīng)系統(tǒng)脫髓鞘疾病的研究,旨在圍繞MS、NMOSD和MOG-EM這3種疾病,探討MRI診斷常見中樞神經(jīng)系統(tǒng)脫髓鞘疾病的研究進展。
1 MRI診斷MS的研究進展
對于臨床醫(yī)師而言,MS的診斷并不是一件簡單的事。盡管2016年歐洲MS MRI多中心協(xié)作研究網(wǎng)發(fā)布的MAGNIMS診斷標準[1]和2017年更新的McDonald標準[2]為MS的臨床診斷提供了更加有力的依據(jù),采用新的診斷標準有助于在臨床上更早期地識別復發(fā)緩解型多發(fā)性硬化(relapsing remitting MS,RRMS),但由于不合理的解讀以及新標準的采用,往往也導致MS誤診[3]。
MRI是臨床診斷MS的重要手段之一。如果在MRI圖像上發(fā)現(xiàn)Dawson手指征(Dawson finger sign)、皮質或近皮質病灶(cortical or juxtacortical lesion)以及短節(jié)段的偏心脊髓病灶等典型的影像學特征,即能更好地支持MS的診斷[1-2]。然而,即便如此,由于大量的其他神經(jīng)系統(tǒng)疾病也可以表現(xiàn)為與MS類似的病灶,因此在實際操作中要準確識別這些異常表現(xiàn)并非易事,這就成為導致MS誤診的重要原因之一[4]。許多中樞神經(jīng)系統(tǒng)疾病(如偏頭痛、年齡相關血管病等常見的神經(jīng)科疾病[4-5])可以在MRI圖像上表現(xiàn)出類似于MS的近皮質和(或)腦室旁的T2高信號病灶。為此,MAGNIMS提出影像學iMIMICS(imaging MIMICS mnemonic)原則(表1)[5]以輔助鑒別MS。對于懷疑MS者,可以通過這些紅旗(red flag)征逐個排除容易混淆的疾病,特別是對于病灶的MRI表現(xiàn)不典型者,可以更好地避免誤診。
此外,各類診斷標準在經(jīng)過臨床實踐驗證后也帶來一些值得探討的問題。例如,按照2017年McDonald標準,只需有1個腦室旁病灶即符合空間多發(fā)性(dissemination in space,DIS),然而通過與MAGNIMS提出的以≥3個腦室旁病灶作為DIS的診斷標準進行比較,發(fā)現(xiàn)增加DIS診斷所需的腦室旁病灶數(shù)并不能提高診斷的準確度[6],但在常見白質損害的老年人群和視神經(jīng)炎患者中采用McDonald標準時需特別謹慎[7],也有學者建議對老年人群和已知合并類似白質病變的患者應采用≥3個病灶的標準或以缺血損失相對少見的胼胝體區(qū)域病灶來診斷DIS[3]。此外,也有研究發(fā)現(xiàn)將癥狀性視神經(jīng)病灶納入DIS標準可以提高McDonald標準診斷MS的準確度和靈敏度[8]。
中心靜脈征(central vein sign,CVS)被認為是MS的一種特征性表現(xiàn),研究發(fā)現(xiàn)CVS在鑒別MS與其他類型白質病灶如小血管白質病變時顯示出重要的價值,但尚不足以區(qū)分不同的原發(fā)進展型MS(primary-progressive MS,PPMS)和RRMS[9]。既往需要進行7T高場強MRI掃描才能評估CVS,但隨著成像技術的創(chuàng)新,通過將T2加權圖像配準至磁敏感加權成像(susceptibility weighted imaging,SWI)圖像的方式, 目前已擴展至采用常規(guī)3T MRI掃描也可以進行評估[10-11]。研究還發(fā)現(xiàn),以>54%的病灶出現(xiàn)CVS為鑒別MS與NMOSD的界限,MS診斷準確率可達94%[11]。
皮質病灶在MS的影像學診斷中已受到越來越多的關注,自MS可以出現(xiàn)皮質病灶的現(xiàn)象被報道后,關于灰質和白質損害在MS中的關系始終是研究的熱點。近期研究發(fā)現(xiàn),一些皮質和皮質下炎性病灶的發(fā)生與血腦屏障破壞有關[12]。在臨床上,皮質病灶在預測病程和預后方面顯示出獨特的價值和意義。目前認為,皮質病灶的出現(xiàn)與長期病程相關;復發(fā)型MS患者發(fā)病時的皮質病灶越多,轉歸為繼發(fā)進展性MS的風險越高,且進展的潛伏期越短[13];基線期的皮質損害水平甚至可以預測長達15年后的不良轉歸,而結合影像學表現(xiàn)來識別PPMS較單純采用臨床評估提前4年[14]。近期的一項回顧性研究認為,脊髓皮質MS可能是一種表現(xiàn)為皮質和脊髓受累而白質不受累的特殊亞型,這類MS患者主要表現(xiàn)為皮質神經(jīng)元的丟失而不伴腦白質脫髓鞘改變[15]。此外,功能MRI研究也發(fā)現(xiàn)皮質病灶與認知[16-17]和胃腸功能[18]之間的關聯(lián)。
軟腦膜釓增強(leptomeningeal gadolinium enhancement,LME)病灶在MS患者中的發(fā)生率很高,20%~50%的MS患者可以在T2-液體衰減反轉恢復(fluid attenuated inversion recovery,F(xiàn)LAIR)序列出現(xiàn)提示軟腦膜炎性浸潤改變的強化病灶[19]。雖然LME不是MS的特異性異常表現(xiàn),如在其他的神經(jīng)炎性疾病、人T淋巴細胞病毒相關脊髓炎等疾病中也可以出現(xiàn),但LME聯(lián)合皮質病灶和皮質萎縮等表現(xiàn)可以作為特異性的生物標志[19-20]。采用超高場強三維FLAIR序列掃描的縱向研究發(fā)現(xiàn),LME的持續(xù)性在不同病灶類型之間存在差異,其在血管壁型和硬腦膜病灶型中較為多見[21];病灶數(shù)的增加與擴展殘疾狀況量表(expanded disability status scale,EDSS)評分的進展相關[22]。
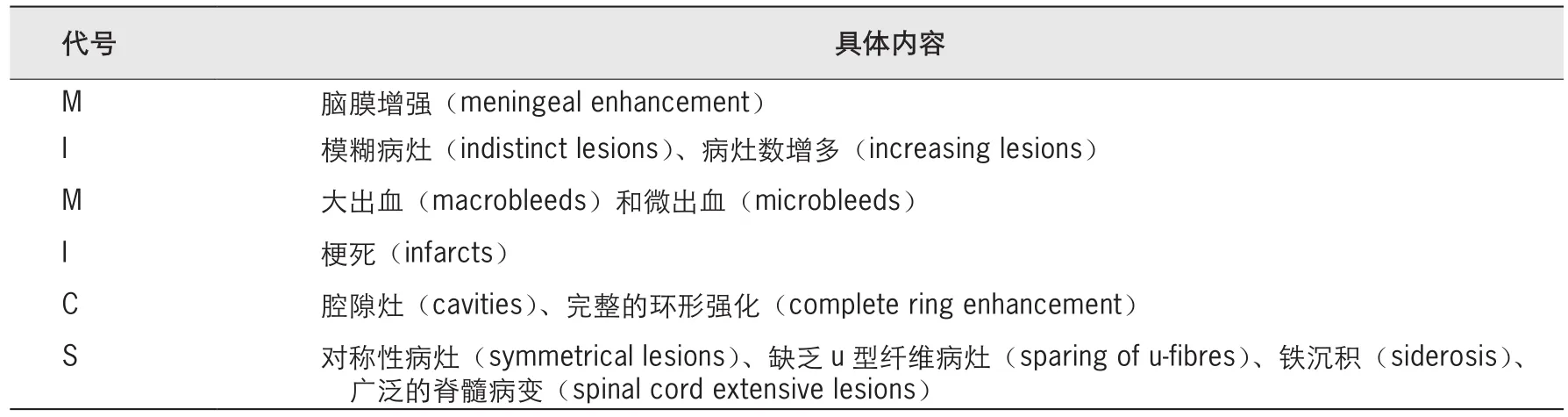
表1 iMlMlCS(imaging MlMlCS mnemonic)原則
MRI技術的發(fā)展促進了MS診斷準確度的提升。增強掃描磁場的場強可以獲得分辨率更高的圖像。一項多中心研究顯示,3T MRI相較于1.5T MRI能夠發(fā)現(xiàn)更多的T2高信號病灶,但按照2017年McDonald標準,其并不影響最終的MS診斷[23]。超高場強MRI具有更高的信噪比(signal-to-noise ratio,SNR)和對比噪聲比(contrast-to-noise ratio,CNR)優(yōu)勢[24],在 MS的診斷,尤其是識別CVS和皮質病灶等方面,顯示出重要的應用價值[25]。盡管目前還無法在所有的醫(yī)院普及超高場強MRI技術,但是隨著超高場強MRI被批準用于臨床診斷,以及有關超高場強MRI的研究日益增多,超高場強MRI在未來會擁有越來越重要的地位。
除了通過傳統(tǒng)的釓增強對比T1加權成像來評估新發(fā)病灶以外,非對比增強磁共振彌散加權成像(diffusion weighted imaging,DWI) 和FLAIR序列在檢測新發(fā)病灶方面也顯示出特有的優(yōu)勢[26-28]。除了用于解釋肉眼可見病灶以外,病灶的定量評估對于MS的診斷價值也日益受到關注[29-31]。不同序列的圖像通過優(yōu)化組合可以獲得更好的灰質和白質對比度以及更高的病灶檢出敏感性,通過組合T2加權和FLAIR序列圖像得到的合成三維 FLAIR(synthetic three-dimensional FLAIR,SyFLAIR3)圖像在評估皮質病灶方面與傳統(tǒng)FLAIR序列和雙反轉恢復(double inversion recovery,DIR)序列相比,可以獲得更高的CNR[32-33]。在7T場強下聯(lián)合使用雙磁化準備快速梯度回波(magnetization prepared 2 rapid acquisition gradient echoes,MP2RAGE)和T2*加權(T2 star-weighted imaging)序列下,可以發(fā)現(xiàn)更多的皮質或近皮質病灶,這些病灶可以更好地解釋臨床癥狀的異質性,有助于指導治療和評估預后[34]。此外,僅需常規(guī)T1加權和T2加權圖像就可以計算得到T1/T2加權比值,從而為區(qū)分皮質脫髓鞘病灶提供了一種簡單而可靠的臨床新方法[35]。
2 MRI診斷NMOSD的研究進展
沿著腦室系統(tǒng)周圍分布的T2加權高信號病灶是NMOSD的特征性病灶[36-37],其余特征還包括融合的白質病灶和沿著皮質脊髓束分布的病灶。盡管既往文獻和診斷標準都對這些特征進行了詳細描述,然而實際上存在典型病灶的患者僅占約50%,而存在不典型病灶的患者比例卻高達84%,不典型病灶即非癥狀性的分布在皮質下和白質區(qū)域的直徑小于3 mm的T2或FLAIR序列高信號病灶[36]。這一臨床現(xiàn)象給臨床診斷帶來了困難,也反映了抗體檢測在診斷NMOSD中的重要性和必要性。最近的一項研究分析了NMOSD和MS的病灶特征,發(fā)現(xiàn)側腦室緣的室管膜周區(qū)病灶在NMOSD患者中最為常見(32.7%),但是其特異度并不高,而大病灶、皮質脊髓束病灶和間腦病灶診斷NMOSD的特異度卻較高;在這項研究中,MS患者均無間腦病灶,由此認為間腦病灶對于NMOSD和MS的鑒別診斷具有重要價值[38]。也有研究認為,MS特異性的皮質病灶僅出現(xiàn)在小部分NMOSD患者中[39-40];然而,亦有研究認為這些皮質病灶僅出現(xiàn)在急性期,而在后期的隨訪期間,這些皮質病灶會隨著癥狀的好轉而消失,因此認為皮質病灶是MS而非NMOSD的特異性表現(xiàn)[38]。
既往認為,NMOSD的脊髓損害表現(xiàn)為長節(jié)段脊髓炎,但近年來基于抗體檢測的研究證據(jù)表明,存在短節(jié)段橫貫性脊髓炎(short transverse myelitis,STM)不能排除NMOSD診斷[41-42],而這些發(fā)現(xiàn)或許得益于采用超高場強MRI技術而提高的STM檢出率[38]。一項納入多種族NMOSD患者的研究顯示,22%的臨床表現(xiàn)為脊髓炎癥狀的患者,在影像學方面可以發(fā)現(xiàn)STM[43],這一發(fā)現(xiàn)進一步證實了MRI結合抗體檢測對于NMOSD診斷的必要性[44]。此外,值得注意的是,合并結締組織病的NMOSD患者較不合并結締組織病的NMOSD患者更常出現(xiàn)T1低信號病灶、斑點狀T2高信號病灶和長節(jié)段脊髓病灶,而STM則較為少見[45]。T1低信號病灶被認為是區(qū)分MS和NMOSD的重要標志。最新研究發(fā)現(xiàn),在MS患者中,頸髓T1低信號病灶與患者的臨床殘障水平相關[46]。然而,有趣的是,NMOSD患者腦部的T1/T2信號比值較MS患者更低,而脊髓的T1/T2信號比值與MS患者相仿[38]。
此外,功能MRI在NMOSD診斷中也得到越來越多的應用。彌散張量成像(diffusion tensor imaging,DTI)在評估NMOSD病灶中的可行性及價值已得到認可,通過采用多種不同的后處理方式可以發(fā)現(xiàn)疾病組與對照組之間視輻射區(qū)域白質的損害,在識別早期的神經(jīng)炎性損害中顯示出較好的靈敏度[47]。功能連接分析發(fā)現(xiàn)水通道蛋白4(aquaprorin-4,AQP4)抗體陽性的NMOSD患者的視覺損害癥狀與初級皮質的視覺網(wǎng)絡重組之間存在關聯(lián)[48]。
3 MRI診斷MOG-EM的研究進展
隨著檢測手段的進步,抗MOG抗體已逐漸成為診斷中樞神經(jīng)系統(tǒng)炎癥性疾病的重要生物標志物[49]。近年來,有關MOG抗體陽性腦脊髓炎的研究結果改變了人們對這類疾病的認識,也將這類疾病從NMOSD中分離出來。2018年發(fā)布的MOG抗體檢測的國際推薦將MOG-EM定義為一類在免疫病理機制上不同于AQP4抗體陽性NMOSD和MS的獨立疾病[50]。鑒于MOG-IgG陽性患者的臨床表型不局限于NMOSD,大量病例表現(xiàn)為視神經(jīng)炎、伴脫髓鞘病變的腦炎和(或)脊髓炎,有研究提出了MOG-IgG相關神經(jīng)炎、腦炎和脊髓炎(MOG-IgG-associated optic neuritis,encephalitis, and myelitis,MONEM)的概念[49]。按照MOG-EM診斷的國際推薦,如果發(fā)現(xiàn)MRI圖像上存在一些高度提示MOG-EM的異常表現(xiàn),則需考慮MOG-EM的可能,并建議進一步開展抗體檢測[50]。由此,這一類被新定義的疾病——MOG-EM,其影像學表現(xiàn)以及與NMOSD和MS相鑒別的特征是當前亟待闡明的前沿問題。
最近的研究探討了MOG-EM的影像學特征。有研究發(fā)現(xiàn)視神經(jīng)是MOG-EM最常見的受累部位,在MRI圖像上表現(xiàn)為T2高信號或對比增強病灶,其分布以眼眶段最為常見,視交叉和視束最少受累[51]。累及視神經(jīng)的病灶長度是鑒別MS和NMOSD的一項有效指標。曾有研究將 17.6 mm作為劃分MS與NMOSD視神經(jīng)病灶長度的界線[52],最近的一項研究認為2者的差異可能更加明顯[51]。深部白質是MOG-EM患者腦部最常見的病灶分布部位[51],此外,丘腦和腦橋也是常見的受累部位,而延髓和極后區(qū)較少受累[53];MOG-EM患者的胼胝體病灶一般表現(xiàn)為散在的局灶結節(jié)狀病灶,也缺乏明顯的腦室旁分布特征[51],而不同于 NMOSD 患者的拱橋征(arch of bridge sign)和MS的Dawson手指征。MOG-EM患者發(fā)生癲癇較AQP4抗體陽性NMOSD患者更為常見[54],這可能與MRI圖像顯示的皮質性腦炎相關[51,54-55]。
一項觀察性研究發(fā)現(xiàn),表現(xiàn)為急性弛緩性脊髓炎的MOG-EM患者的脊髓病灶大多超過1個節(jié)段且無釓強化,在軸位上通常局限于灰質,典型者呈現(xiàn)H形中央灰質分布(H征)[56],其MRI圖像上常顯示特殊的長節(jié)段T2加權高信號脊髓病灶和腦深部灰質病灶,而不同于AQP4抗體陽性NMOSD的長節(jié)段脊髓炎和MS表現(xiàn)。MOG-EM的這一特征與既往發(fā)現(xiàn)脊髓灰質中有MOG分布的結論是一致的[57],因此提示這一特征可能反映了灰質脫髓鞘,是與MS和NMOSD進行鑒別的關鍵特征之一。
4 結 語
MRI在中樞神經(jīng)系統(tǒng)脫髓鞘疾病診斷中的作用無可替代。近年來,隨著MRI技術的發(fā)展,這類疾病的診斷和機制研究不斷深入。從臨床角度而言,對疾病影像學特征認識的不斷提高,提升了中樞神經(jīng)系統(tǒng)脫髓鞘疾病診斷的準確度,也豐富了疾病評估和管理手段;從研究角度而言,影像學技術也為這類疾病的機制研究提供了強有力的工具。隨著超高場強MRI的技術應用和新的成像技術的不斷涌現(xiàn),MRI必將在中樞神經(jīng)系統(tǒng)脫髓鞘疾病的診斷、治療和預后評估中占據(jù)越來越重要的地位。

