苦參素對大鼠全腦缺血再灌注損傷保護作用的實驗研究
外科手術、心臟驟停、窒息等導致低壓、低氧常引發全腦缺血[1],目前臨床以藥物或介入手術溶栓為主要治療方案,但再灌注損傷極大地影響病人預后,其機制與炎癥、氧化應激及細胞凋亡有關[2-3]。現代藥學研究發現,苦參素為喹諾西啶類生物堿,是一類具有抗炎、抗凋亡活性的中藥提取物[4-5],但苦參素對全腦缺血再灌注損傷影響的相關報道較少,本研究探討苦參素對大鼠全腦缺血再灌注后腦組織的保護作用。
1 材料與方法
1.1 實驗動物 健康清潔級SD大鼠(雌雄不限)由河北醫科大學實驗動物中心提供[SCXK(冀)2013-1-003]。
1.2 實驗藥物與試劑 苦參素(南京澤朗醫藥科技有限公司,批號:20170114);白細胞介素-1β(IL-1β)、白細胞介素-6(IL-6)、腫瘤壞死因子α(TNF-α)試劑盒和末端脫氧核苷酰基轉移酶介導dUTP切口末端標記(TUNEL)試劑盒購自北京博奧森生物技術有限公司,批號:170129、170312、170116、170324;超氧化物歧化酶(SOD)、過氧化氫酶(CAT)、丙二醛(MDA)試劑盒購自南京建成生物工程研究所,批號:20170309、20170413、20170114。
1.3 實驗方法
1.3.1 動物分組、給藥與模型制備 采用隨機數字表法將100只SD大鼠隨機分為假手術組(0.9%氯化鈉溶液)、模型組(0.9%氯化鈉溶液)和苦參素低劑量組[25 mg/(kg·d)]、中劑量組[50 mg/(kg·d)]、高劑量組[100 mg/(kg·d)],每組20只。術前10 min腹腔注射相應濃度藥物,實施麻醉后通過夾閉四動脈(雙側椎動脈和雙側頸動脈)制備全腦缺血大鼠模型,造模成功標志:腦電圖波幅下降正常25%以下、翻正反射消失、瞳孔顏色變灰白,夾閉四動脈20 min;假手術組不夾閉四動脈,其余操作同模型組[6]。
1.3.2 翻正反射和腦電恢復時間記錄 應用BL-420E型生物機能實驗系統記錄大鼠翻正反射恢復時間;記錄腦電振幅恢復到正常75%時間,即腦電恢復時間。
1.3.3 腦組織含水量 各組隨機取6只大鼠,麻醉后取腦并去除小腦和腦干,稱重為濕重;用錫紙包裹后置110 ℃干燥箱烘烤至恒重,稱重為干重,腦組織含水量=[(濕重-干重)/濕重]×100%。
1.3.4 海馬CA1區病理學檢查及神經元凋亡觀察 每組隨機取6只大鼠,麻醉后取腦并去除小腦和腦干后置于濃度4%多聚甲醛溶液固定72 h,之后進行石蠟包埋和切片,切片厚度約2 μm,經二甲苯透明、脫蠟水化處理后,進行蘇木精-伊紅(HE)染色,梯度乙醇脫水后封片,最后通過光學顯微鏡觀察海馬CA1區組織細胞病理學改變。取石蠟切片并脫蠟水化處理后,按照TUNEL試劑盒操作說明步驟進行,通過光學顯微鏡觀察細胞凋亡狀況,計算視野內細胞總數和凋亡細胞數,每張切片均取5個不重疊的視野并分別計數后取平均值,計算凋亡指數(AI)=(凋亡細胞數/細胞總數)×100%。
1.3.5 海馬組織炎癥細胞因子含量、抗氧化酶活性和MDA含量 取各組剩余8只大鼠,麻醉后取腦組織并剝取海馬組織,于冰上剪碎后加入適量冷裂解液后行研磨勻漿,4 ℃條件下,12 000 r/min離心,取上清液,之后按照各試劑盒操作方法測定炎癥細胞因子IL-1β、TNF-α、IL-6含量和抗氧化酶SOD、CAT活性和MDA含量。
2 結 果
2.1 各組大鼠翻正反射和腦電恢復時間、腦含水量比較 與模型組比較,苦參素中劑量組、高劑量組翻正反射和腦電恢復時間均顯著縮短(P<0.01)。模型組腦組織翻正反射恢復時間、腦電恢復時間和腦含水量較假手術組顯著升高(P<0.01);與模型組比較,苦參素中、高劑量組腦含水量顯著降低(P<0.05或P<0.01)。詳見表1。

表1 各組大鼠翻正反射和腦電恢復時間、腦含水量比較(±s)
與假手術組比較,1)P<0.01;與模型組比較,2)P<0.05,3)P<0.01
2.2 海馬CA1區神經元形態結構 假手術組未見異常;模型組海馬CA1區神經元數量減少、排列稀疏、層次紊亂,胞體腫脹或空泡變性,核固縮或溶解、核膜不清等病理性改變;苦參素干預能改善全腦缺血再灌注大鼠海馬CA1區神經元病變,以高劑量組最顯著。詳見圖1。
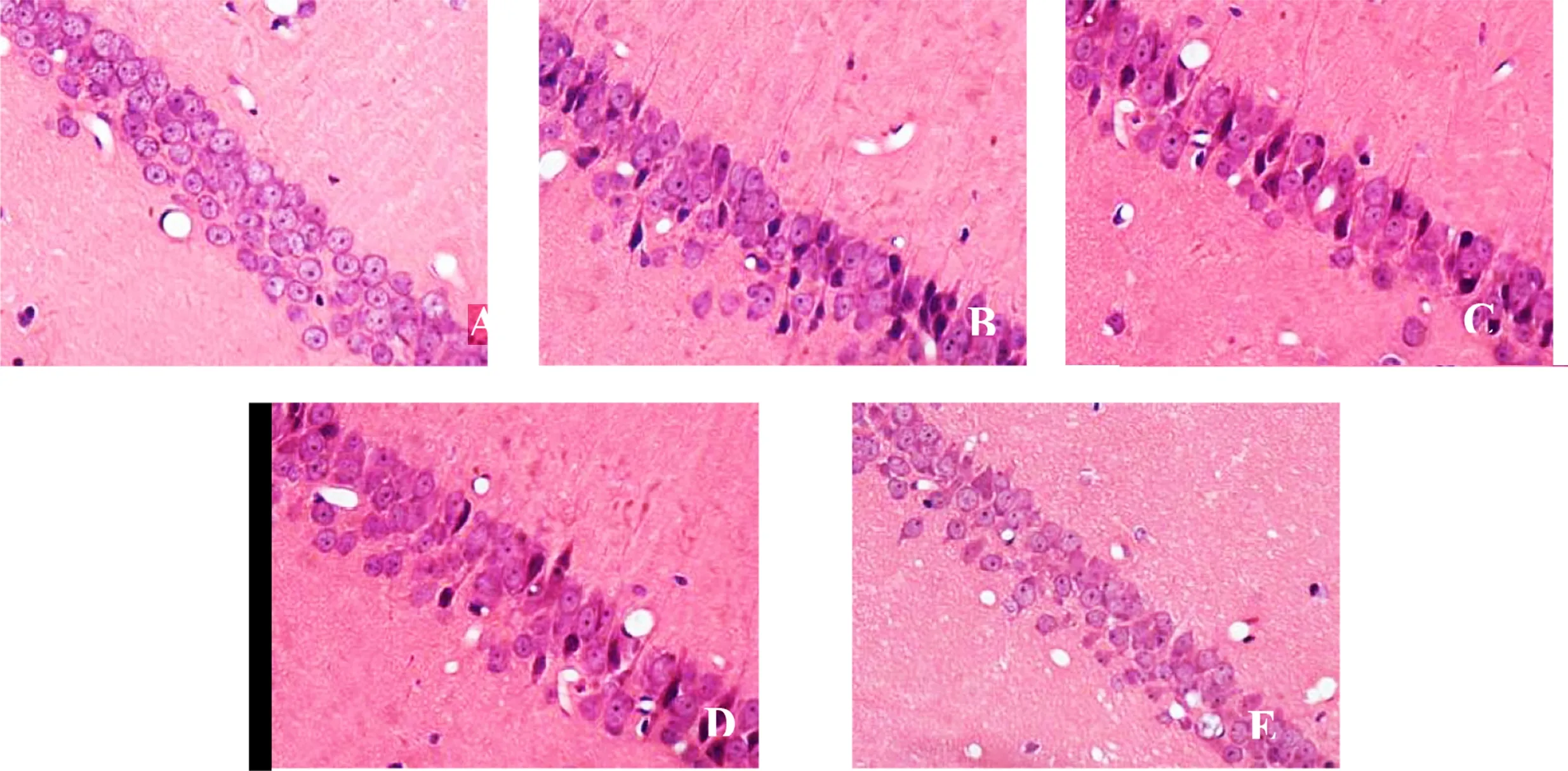
A為假手術組;B為模型組;C為苦參素低劑量組;D為苦參素中劑量組;E為苦參素高劑量組
圖1各組大鼠大腦海馬CA1區神經元形態結構(HE,×400)
2.3 海馬CA1區神經元凋亡狀況 假手術組僅見少量凋亡神經元;模型組凋亡神經元數量明顯多于假手術組;與模型組比較,苦參素能減少神經元凋亡,以高劑量組最顯著。詳見圖2。模型組AI高于假手術組[(64.8±8.3)%與(2.3±0.9)%,P<0.01];與模型組比較,苦參素中、高劑量組AI明顯降低[(41.2±7.0)%、(15.8±3.6)%與(64.8±8.3)%,P<0.01]。
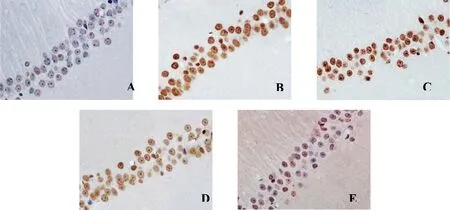
A為假手術組;B為模型組;C為苦參素低劑量組;D為苦參素中劑量組;E為苦參素高劑量組
圖2各組大鼠大腦海馬CA1區神經元凋亡狀況(TUNEL,×400)
2.4 各組大鼠海馬組織炎癥細胞因子含量比較 模型組炎癥細胞因子TNF-α、IL-1β、IL-6含量較假手術組均明顯升高(P<0.01);與模型組比較,苦參素中劑量組、高劑量組炎癥細胞因子TNF-α、IL-1β、IL-6含量均顯著降低(P<0.05或P<0.01)。詳見表2。
2.5 各組大鼠海馬組織抗氧化酶活性和MDA含量比較 模型組抗氧化酶(SOD、CAT)活性較假手術組降低(P<0.01),MDA含量升高(P<0.01);與模型組比較,苦參素中劑量組、高劑量組SOD、CAT活性增高且MDA含量降低(P<0.05或P<0.01)。詳見表3。

表2 各組大鼠海馬組織炎癥細胞因子含量比較(±s) nmol/L
與假手術組比較,1)P<0.01;與模型組比較,2)P<0.05,3)P<0.01

表3 各組大鼠海馬組織抗氧化酶活性和MDA含量比較(±s)
與假手術組比較,1)P<0.01;與模型組比較,2)P<0.05,3)P<0.01
3 討 論
氧化應激、炎癥及神經元凋亡在再灌注損傷發生發展中發揮重要作用[2-3,7],其作為靶點已成為防治缺血再灌注損傷新型藥物研發熱點。苦參素是中藥苦參的主要有效成分之一,王雪芬等[8]研究發現苦參素具有擴張血管、改善微循環的藥理學作用,苦參素通過抑制氧化應激、細胞凋亡表現出對心肌缺血再灌注損傷的保護作用[8-9];賈昌盛等[10]研究發現苦參素通過調控機體抗氧化系統對腎臟缺血-再灌注損傷起到一定保護作用;高鵬[11]研究發現苦參素通過抑制細胞凋亡而保護肝臟缺血再灌注。既往關于苦參素對全腦缺血再灌注損傷影響文獻的報道尚不多見。
本研究采用與人類病理特點接近的四動脈夾閉法制備全腦缺血再灌注大鼠模型[12]展開研究,海馬是對腦缺血最敏感的區域之一,尤其是CA1區的錐體細胞層[13],因此本研究以大腦海馬CA1區為組織損傷及改善觀察區域。本研究結果顯示,中、高劑量苦參素預處理能有效縮短翻正反射和腦電恢復時間、降低腦組織含水量、抑制海馬CA1區病變并抑制該區域神經元凋亡,提示苦參素對全腦缺血再灌注損傷具有一定的保護作用。
氧自由基代謝失衡是導致細胞膜不飽和脂肪酸氧化破壞等氧化應激損傷的根源,其代謝失衡,在體內蓄積與抗氧化酶(SOD、CAT)過度消耗有關[14];MDA為不飽和脂肪酸氧化應激損傷終產物之一,其含量間接反映氧化應激損傷程度[15]。炎癥細胞因子是臨床監測炎癥反應的常用指標。本研究結果顯示,中、高劑量苦參素預處理能有效提高海馬組織SOD、CAT活性并降低MDA含量,降低TNF-α、IL-1β、IL-6含量,提示苦參素對全腦缺血再灌注損傷后氧化應激損傷及炎癥反應具有一定的抑制作用。
綜上所述,苦參素對全腦缺血再灌注損傷具有保護作用,其機制可能與抑制氧化應激和炎癥反應有關。

