骨髓間充質干細胞通過激活Wnt通路防治阿爾茨海默病
陳鵬 姚宏波
(齊齊哈爾醫學院 1口腔醫學院,黑龍江 齊齊哈爾 161006;2基礎醫學院組胚教研室)
阿爾茨海默病(AD)是一種進行性發展的中樞神經系統退行性疾病。臨床表現為記憶能力的失活、失用,執行功能障礙,認知能力下降,同時多出現精神行為的異常,對中老年人身心健康產生嚴重危害。近年來,應用干細胞治療AD逐漸被認可,其中骨髓間充質干細胞(BMSCs)是一種專能干細胞,來源于骨髓,具有自我更新和多向分化的能力,可以在特定的條件下轉變成構成人體某種組織的細胞,BMSCs來源廣泛,能為AD的治療提供豐富資源,也為臨床的自體細胞移植奠定了實驗基礎〔1〕。Wnt信號通路在神經系統的發生、發育及神經系統疾病的發生、發展等方面發揮重要作用,如軸突導向、突觸形成、成年神經再生和神經細胞的保護和遷移等〔2〕。有研究顯示,Wnt/β-catenin 信號的激活可以促進成體動物神經干細胞的增殖及向神經元分化〔3〕。本研究通過在AD大鼠海馬區移植BMSCs,探討在治療AD的過程中是否存在Wnt通路的激活及對Wnt通路相關蛋白β-catenin及細胞周期蛋白(Cyclin)D1表達的影響。
1 材料與方法
1.1 實驗動物及試劑 6~8月齡清潔級雄性Wistar大鼠,體重(200 ± 20)g,來自哈爾濱醫科大學實驗動物中心。兔抗β-catenin,Cyclin D1抗體一抗;羊抗兔 IgG;二氨基聯苯胺(DAB)顯色法檢測試劑盒;β-淀粉樣蛋白(Aβ)23~35;氫溴酸加蘭他敏。
1.2 動物分組及處理 將40只大鼠隨機分為5組,每組8只,正常組:常規鼠糧飼養,飲用水;模型組:稱重后10%水合氯醛腹腔注射麻醉,固定于腦立體定位儀,切開皮膚暴露頂骨,按照大鼠腦立體定位儀圖譜在雙側海馬區注射10 μl Aβ23~35,緩慢注射5 min注完,注射結束需繼續留針5 min,將骨孔用牙托粉封固,皮膚縫合,前3 d,每日肌注10萬U青霉素。常規飼養7 d后,用Moriss水迷宮檢測造模是否成功,成功后不進行任何治療;模型對照組:注射生理鹽水代替Aβ23~35,方法同模型組;移植組:建立AD大鼠模型2 w后,對AD模型大鼠進行BMSCs移植,注射部位為原Aβ23~35的注射部位,術后處理同模型組;西藥組:建立AD大鼠模型后,氫溴酸加蘭他敏灌胃治療,每日每千克體重0.6 mg,治療30 d〔4〕。
1.3 BMSCs的培養、鑒定及移植 原代培養,將大鼠麻醉后在無菌條件下取雙側股骨,將兩側干骺端剪斷,注射器將骨髓沖出,淋巴細胞分離離心,去上清,取云霧狀細胞,接種于75 cm2培養瓶中,密度5×105/cm2,培養體系為DMEM培養基、10%胎牛血清、青/鏈雙抗,隔日在倒置顯微鏡下觀察細胞形態。當細胞約80%匯合時,胰蛋白酶-乙二胺四乙酸(EDTA)進行消化,然后終止消化用含胎牛血清的培養液,制成單細胞懸液后進行傳代,細胞擴增好后對其進行CD44免疫組化染色鑒定。檢測造模成功后,行BMSCs移植,注射部位為原Aβ23~35的注射部位,將BMSCs懸液注入AD模型大鼠雙側海馬區,每側10 μl緩慢注射,1 μl/min,留針約5 min。染色后BMSCs陽性為胞核藍色,胞質褐色。
1.4 行為學實驗 Morris水迷宮的組成:一個不銹鋼圓形水池和一個可以移動的平臺。水池上方有攝像機和監視器與計算機相連,跟蹤記錄大鼠游泳軌跡和游泳時間。水池被等分為平臺象限、對側象限、右側象限和左側象限4個象限,并用不同形狀進行標記。在平臺象限正中放置平臺,將大鼠頭部染成黑色,將大鼠面向池壁,在其他3個象限中任一點放入水中。記錄大鼠逃避潛伏期,即每次自入水至爬上平臺的時間。方法如下:將大鼠編號,第1天讓大鼠適應環境,自由游泳2次,每次120 s;第2天起,每天上、下午各進行水迷宮訓練1次,連續3 d,共計6次,訓練時間同上,120 s未找到平臺則以120 s計算,為了加強記憶,每次訓練后,將大鼠引導至平臺上15 s。記錄大鼠平均逃避潛伏期。
1.5 形態學實驗 取腦組織海馬進行石蠟切片制作并采用蘇木素-伊紅(HE)染色觀察海馬神經元的形態及超微結構的改變。HE染色步驟:①石蠟切片二甲苯脫蠟;②梯度乙醇脫水至蒸餾水水洗;③蘇木精染色;④自來水稍沖洗;⑤1%鹽酸乙醇分化、水洗;⑥伊紅復染;⑦酒精脫水;⑧二甲苯透明、自然干燥;⑨封片。光學顯微鏡下觀察并拍照。
1.6 免疫組化染色 采用PV二步法進行免疫組化檢測各組AD大鼠海馬Wnt信號通路β-catenin及Cyclin D1蛋白的表達,對照組一抗用0.01 mol/L磷酸鹽緩沖液(PBS),光學顯微鏡下觀察。
1.7 統計學方法 應用SPSS17.0軟件進行方差分析;圖像處理應用ImageJ。
2 結 果
2.1 BMSCs的培養、鑒定及移植 BMSCs呈細長纖維狀,貼壁生長后變成長梭形,分布呈漩渦樣,折光性好,形態飽滿。染色后可見BMSCs表達陽性,陽性細胞比例在99%以上。
2.2 行為學檢測 模型組與正常組、模型對照組比較,逃避潛伏期及游泳路程明顯增長(P<0.01);移植組和西藥組明顯低于模型組(P<0.05)。見表1。
2.3 形態學變化 正常組和模型對照組海馬區錐體細胞和顆粒細胞胞質豐富,排列規則且整齊緊密,層數較多。模型組錐體細胞和顆粒細胞可見被破壞現象,胞質濃縮染色較深,核固縮,細胞排列稀疏且紊亂,細胞體積縮小,間隙擴大。移植組和西藥組顆粒細胞核圓,但細胞數量較正常組減少,細胞排列較規整,界限較清晰。見圖1。

表1 各組平均逃避潛伏期及游泳路程比較
與模型組比較:1)P<0.01,2)P<0.05;下表同

圖1 各組海馬HE染色(×400)
2.4 免疫組化檢測結果 正常組和模型對照組β-catenin蛋白在大鼠海馬神經元的胞質內陽性表達;模型組陽性表達細胞數明顯減少(P<0.01);移植組和西藥組明顯多于模型組(P<0.05)。正常組、模型對照組Cyclin D1蛋白在細胞核內表達;模型組陽性表達明顯降低(P<0.01);移植組和西藥組明顯多于模型組(P<0.05),見表2。
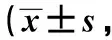
表2 各組海馬蛋白β-catenin 及Cyclin D1表達陽性細胞數個/mm2,n=8)
3 討 論
AD病因目前尚不明確。根據2010年失智癥報告顯示,全球AD患者約有3 560萬例,且增長速度約每20年翻1倍,估計到2030年AD患者將達約6 500萬例,且發展中國家居多〔5〕。AD主要有三大病理改變:Aβ形成、tau蛋白的過度磷酸化及神經炎癥,其產生的神經毒性最終導致大量海馬神經元凋亡。
BMSCs具有多向分化的潛能,應用不同的誘導劑可分化為多種細胞,如脂肪細胞、軟骨細胞、骨細胞及神經元等〔6〕,故近些年BMSCs被作為移植治療多種疾病的種子細胞〔7〕。在體內外實驗中,BMSCs在適當的條件下可誘導分化為神經元,但調控機制目前尚不清楚。據報道,BMSCs在定向分化過程中,Wnt信號通路具有一定的調控作用〔8〕。Wnt/β-catenin信號通路是最經典的Wnt通路,Wnt 3a蛋白與細胞膜上的相應受體結合,Wnt信號通路被激活,使未被磷酸化的β-catenin從細胞質進入細胞核,并啟動相應靶基因的轉錄,從而產生多種細胞效應〔9〕。其中激活Wnt 信號通路后,可啟動靶基因Cyclin D1 的轉錄〔10〕。Beaulieu等〔11〕發現,在Wnt /β-catenin 通路激活劑或Wnt 配體作用下,可增強 β-catenin蛋白的表達及該通路下游靶基因中存活基因如 Cyclin D1的表達,減弱 Aβ 的神經毒性,對神經元起保護作用。有研究還發現Cyclin D1的調控機制有利于Cyclin D1在 AD 病理發展中作用的研究〔12〕。
目前有報道證實,通過Wnt信號通路的激活可使AD大鼠腦組織內的炎癥得到改善〔13〕。BMSCs在向神經元分化時,胞質內游離β-catenin蛋白的表達明顯增加;而Wnt信號通路受到抑制時,BMSCs的分化明顯減少〔14〕。所以推斷Wnt 信號通路對AD的發生有嚴重影響,但目前許多機制仍不明確,還有待繼續研究〔15〕。本研究顯示,BMSCs移植可以縮短AD模型大鼠的逃避潛伏期和游泳路程,對學習記憶能力起到改善作用;模型組胞質內游離的 β-catenin 減少,抑制了Wnt信號通路的轉導,從而使靶基因 Cyclin D1 的表達有所下調。經過BMSCs移植后,胞質內游離β-catenin表達增多,激活了Wnt信號通路,使Cyclin D1 的表達增強,并且能夠促進神經元之間突觸的發生。因此,BMSCs移植治療AD的機制可能是通過激活Wnt/β-catenin通路,調控細胞周期,從而起到保護神經元的作用。
BMSCs具有高分化潛能,可以實現自體移植,具有低免疫原性,避免了移植后的排斥反應。同時,BMSCs易于獲取,故不涉及醫學倫理問題,作為組織工程的種子細胞,具有十分廣闊的應用前景〔16〕。

