CYTOR通過調控miR-125b-5p/HK2通路促進宮頸癌細胞有氧糖酵解、增殖和侵襲
(武漢市三醫院婦產科,湖北 武漢430074)
隨著手術、放療、化療等綜合治療方法的發展和改進,早期宮頸癌的療效取得了很大的進展,但中晚期宮頸癌的療效仍然不能令人滿意[1]。中晚期宮頸癌的高度增殖活性和侵襲性直接導致了預后不良,因此,積極研究宮頸癌發生增殖和侵襲轉移的機制,并尋求相應的治療靶點,對于提高宮頸癌的整體療效有十分明顯的臨床意義[1]。以往針對宮頸癌的靶向治療主要集中在蛋白靶點,但近年來,一種新型的非編碼RNA逐漸引起了腫瘤學者的重視。長鏈非編碼RNA(long non-coding RNA, lncRNA)是一大類長度超過200個核苷酸的特殊RNA,由于不具備蛋白質編碼能力長期未受到腫瘤研究者的重視。但近年來越來越多的研究表明,lncRNA在多種腫瘤中具有關鍵性的調節作用[2-3],跟蛋白靶點一樣,lncRNA同樣可以作為癌基因存在[4]。然而,關于lncRNA和宮頸癌之間的關系,以及lncRNA如何促進宮頸癌的增殖和侵襲活性,這方面的研究尚處于早期階段。本研究首先通過檢測一種新型lncRNA細胞骨架RNA(cytoskeleton regulator RNA, CYTOR)在宮頸癌組織及細胞中的表達,然后進一步探討CYTOR通過調控miR-125b-5p和HK2對宮頸癌細胞增殖、侵襲和有氧糖酵解的影響,為尋求宮頸癌新的治療靶點提供實驗依據和理論支持。
1 材料與方法
1.1 組織、細胞株、試劑及儀器
選取來源于本院2014年5月至2018年5月的宮頸癌組織及癌旁組織30例,納入標準:符合國際婦產科聯合會(FIGO)分類標準且經病理確診為宮頸癌,宮頸癌分期采用FIGO分期。4種人宮頸癌細胞株(Hela、C33A、Caski和SiHa)和人宮頸上皮細胞(H8)購于中科院上海細胞研究所。Si-CYTOR(sh1:CTGGAAACCTCTTGACTCT;sh2:CAGGAAGCTCTATGACACA)和pcDNA-HK2過表達載體(HK2全長序列見https://www.ncbi.nlm.nih.gov/nuccore/M23115.1)由上海吉瑪制藥技術有限公司合成,轉染試劑Lipofectamine 2000購于Invitrogen公司;RNA提取試劑盒Trizol購于Invitrogen公司;實時定量SYBR Green和逆轉錄試劑盒購于TAKATA公司,引物由上海生工生物合成;HK2抗體和內參抗體購于Abcam公司;增殖檢測CCK8試劑盒購于碧云天公司。雙熒光素酶報告基因試劑盒購于Promega公司;Western blot用電泳儀和轉印儀購于Bio-Rad公司。
1.2 細胞培養和轉染
人宮頸癌細胞株(Hela、C33A、Caski和SiHa)和人宮頸上皮細胞(H8)培養于DMEM培養基中(培養基中含10%胎牛血清和青鏈霉素雙抗),培養條件:溫度37 ℃、含5%CO2。待細胞進入對數生長期,用胰酶消化后選取2 mL細胞懸液并接種到6孔板中(保持細胞密度為1×105個/mL),在培養箱培養24 h后按照Lipofectamine 2000說明書方法進行轉染,轉染物包括si-CYTOR、miR-125b-5p inhibitor和pcDNA-HK2,轉染48 h后用于下一步檢測實驗。
1.3 熒光定量PCR檢測CYTOR、miR-125b-5p和HK2的表達
收集宮頸癌組織及轉染后48 h的宮頸癌細胞,采用TRIzol試劑提取宮頸癌組織和細胞總RNA,隨后進行逆轉錄反應制備cDNA。熒光定量PCR檢測方法以U6和GAPDH作為內參照,引物序列如下:U6 F為5′-CTCGCTTCGGCAGCACA-3′,R為5′-AAC GCTTCACGAATTTGCGT-3′;GAPDH F為5′-AATGGGCAGCCGTTAGGAAA3-3′,R為5′-GCGCCCAAT ACGACCAAATC′-3′;CYTOR F(2143-2162)為5′-AGAATGAAGGCTGAGGTGTG-3′,R為(2465-2484)5′-CAGCGACCATCCAGTCATTTA-3′;miR-125b-5p F為5′-TCCCTGAGACCCTAACTTGTGA-3′,R為5′-AG TCTCAGGGTCCGAGGTATTC-3′;HK2 F為5′-CAAA GTGACAGTGGGTGTGG-3′,R為5′-GCCAGGTCCTTCACTGTCTC-3′。按熒光定量試劑盒說明建立PCR反應體系(包括2 μL cDNA、10 μL SYBR Green Mix、上下游引物。PCR運行參數中設置:95 ℃ 3 min,然后進行下列反應:92 ℃變性30 s,60 ℃退火30 s,一共進行35個循環。PCR檢測結果采用2-ΔΔCt法進行匯總分析。
1.4 宮頸癌細胞的增殖活性的檢測(CCK-8法)
培養HeLa細胞使之處于對數生長期,然后接種細胞于96孔板中(保持細胞密度為2×104個/孔),細胞中加入100 μL DMEM培養基,每組設立3個平行對照。在HeLa細胞中分別轉染si-CYTOR、pcDNA-HK2和miR-125b-5p inhibitor。檢測前加入10 μL CCK-8溶液,然后將細胞在培養箱內孵育4 h后測定450 nm處的光密度OD值。所有操作依照CCK-8試劑盒說明書進行。
1.5 Transwell法檢測宮頸癌細胞的侵襲能力
將HeLa細胞用胰酶消化后接種于Transwell小室內,Transwell上室加100 μL HeLa細胞懸液,下室加250 μL培養基(含10%胎牛血清),在37 ℃、5%CO2環境培養箱中培養48 h,取出小室后用PBS溶液沖洗2遍,然后用4%多聚甲醛固定15 min,最后用結晶紫溶液進行染色,Transwell板干燥后置于倒置顯微鏡下觀察細胞侵襲情況。
1.6 Annexin V-FITC/PI檢測細胞凋亡
選取HeLa細胞并培養至對數生長期,用PBS清洗后均勻地混合HeLa細胞與500 μL預冷的結合緩沖液和5 μL Annexin-V-FITC,避光放置15 min,上機前5 min加入2.5 μL PI溶液進行染色,均勻混合后上流式細胞儀檢測細胞凋亡率。所有操作依照Annexin V-FITC/PI試劑說明書進行。
1.7 雙熒光素酶報告基因驗證miR-125b-5p和CYTOR/HK2之間的互作關系
首先將CYTOR 3′UTR靶序列或HK2 3′UTR靶序列插入到熒光素酶載體下游。并設置突變載體作為對照進行熒光素酶驗證實驗,具體操作如下:每孔細胞中轉染pmir-GLO-CYTOR-3′UTR 200 ng、pmir-GLO-HK2-3′UTRmiRNA、mimic 500 ng及陰性對載體200 ng。用Opti-MEM培養基將Lipofectamine2000稀釋后,室溫下放置5 min;然后混合轉染試劑和載體DNA和mimic,室溫下放置20 min后,用Opti-MEM培養基進行充分混勻;然后在溫度37 ℃、5%CO2培養箱中培養48 h后收集細胞。整個檢測步驟依照雙熒光素酶報告基因試劑盒說明書,并以載體本身的熒光值作為內對照。
1.8 統計學分析
2 結 果
2.1 CYTOR在宮頸癌組織及細胞中表達升高
首先,利用熒光定量PCR探明CYTOR在宮頸癌組織和細胞中的表達,結果顯示,相比癌旁組織(圖1A),CYTOR在宮頸癌組織中的表達明顯增高(3.29±2.21vs8.39±4.86,t=6.83,P<0.01);對30例宮頸癌患者的CYTOR和臨床病理特性進行了分析,結果見表1所示,分期是導致CYTOR表達差異的重要因素。熒光定量PCR結果表明,相比I/II級宮頸癌組織(圖1B),CYTOR在III/IV宮頸癌中的表達也明顯升高(5.25±2.02vs9.77±5.12,t=3.99,P<0.01)。同時細胞實驗表明,相比人正常宮頸上皮細胞H8,CYTOR在宮頸癌細胞系(Hela、C33A、Caski和SiHa)中的表達水平明顯增高(t=19.71、16.23、-19.38、20.39,P<0.01,圖1C)。以上結果顯示,CYTOR的異常表達升高可能與宮頸癌的惡性生物學行為存在密切關聯。
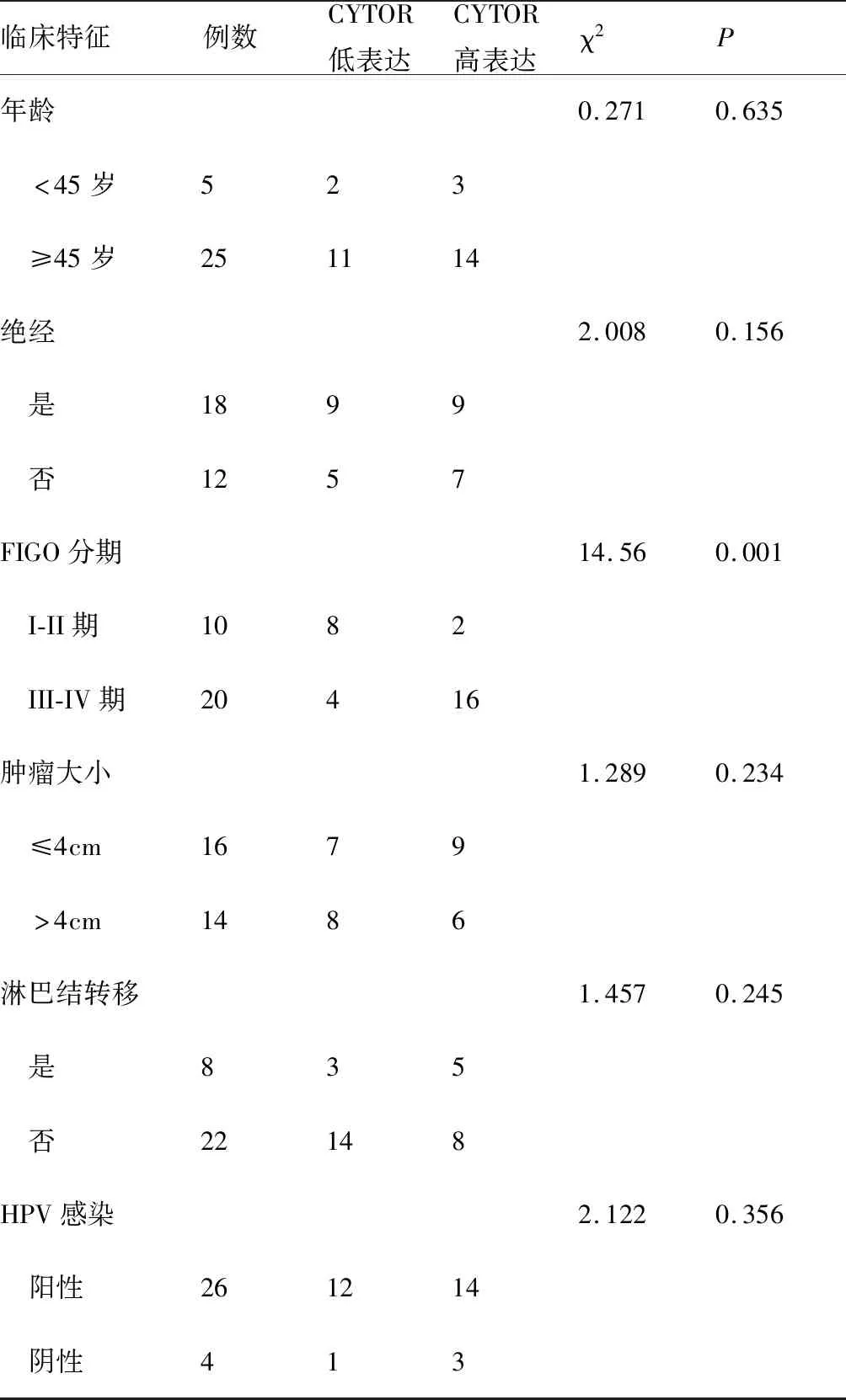
表1 30例宮頸癌患者臨床病例特征與CYTOR表達的關系
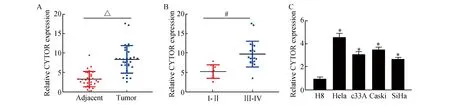
圖1 CYTOR在宮頸癌組織和細胞中的表達A:CYTOR在宮頸癌組織和癌旁組織中的表達;B:CYTOR在I/II級宮頸癌以及III/IV宮頸癌中的表達;C:CYTOR在宮頸癌細胞以及正常上皮細胞中的表達 與Adjacent比較,△P<0.05;與Ⅰ/Ⅱ比較,#P<0.05;與H8組比較,*P<0.05
2.2 抑制CYTOR對宮頸癌細胞增殖和侵襲的影響
熒光定量PCR法檢測結果(圖2A)顯示,相比于對照組,轉染CYT OR siRNA可明顯下調CYTOR在宮頸癌細胞HeLa中的表達(P<0.05),且轉染si-CYTOR#1的效果優于si-CYTOR#2和si-CYTOR#3,在接下來的實驗中選用si-CYTOR#1。CCK-8檢測結果顯示(圖2B),抑制CYTOR可抑制HeLa細胞的增殖活力(t=7.23,P<0.01)。Transwell檢測結果顯示(圖2C),抑制CYTOR可抑制HeLa細胞的侵襲能力(t=8.85,P<0.01)。此外,細胞凋亡結果顯示(圖2D),抑制CYTOR可促進HeLa細胞凋亡(t=12.78,P<0.01)。以上實驗結果顯示,抑制CYTOR可抑制HeLa細胞的增殖和侵襲能力并促進其凋亡。

圖2 抑制CYTOR后對宮頸癌細胞增殖、侵襲及凋亡的影響A:CYTOR表達量的變化;B:對宮頸癌細胞增殖;C:對宮頸癌細胞侵襲;D:宮頸癌細胞凋亡與si-NC組比較,*P<0.05
2.3 抑制CYTOR對宮頸癌細胞有氧糖酵解代謝的影響
腫瘤的有氧糖酵解能力增強是腫瘤獲得快速增殖和侵襲的重要機制,為了探明CYTOR對宮頸癌細胞生物學功能影響的具體機制,對有氧糖酵解活性進行了檢測,結果表明,抑制CYTOR后,無論是對葡糖糖的攝取水平(圖3A),還是乳酸(圖3B)和三磷酸腺苷(adenosine triphosphate,ATP)(圖3C)的生成水平均發生了明顯下降(t分別為6.86,7.52,6.95,P<0.01),表明CYTOR對維持宮頸癌細胞的有氧糖酵解水平有重要作用。
2.4 CYTOR靶向調控miR-125b-5p在宮頸癌細胞中的表達
利用生物信息學數據庫Stabase V3.0數據庫(http://starbase.sysu.edu.cn/)預測miR-125b-5p可能是CYTOR的靶基因,其預測序列如圖4A所示。雙熒光素酶報告基因驗證結果(圖4B)顯示,過表達miR-125b-5p可使熒光素酶活性顯著下降(t=6.58,P<0.05),而共轉染miR-125b-5p mimics和靶向位點發生突變的pmirGLO-CYTOR-mut載體,miR-125b-5p對熒光素酶活性未發生明顯作用。采用熒光定量PCR檢測CYTOR抑制后miR-125b-5p在Hela中表達水平,結果(圖4C)顯示,CYTOR抑制后顯著促進miR-125b-5p的表達(t=16.52,P<0.01)。通過對30例宮頸癌標本進行檢測發現,CYTOR與miR-125b-5p的表達呈負相關(r2=0.377,P<0.01,圖3D)。由此可知,miR-125b-5p與CYTOR存在直接作用,CYTOR可負調控miR-125b-5p的表達。
2.5 miR-125b-5p靶向調控HK2在宮頸癌細胞中的表達
通過生物信息學數據庫Stabase V3.0對miR-125b-5p的靶基因進行了預測,發現HK2是miR-125b-5p的候選靶基因,隨后采用熒光素酶報告基因驗證,miR-125b-5p可以結合HK2的3′UTR靶序列(圖5A),并且miR-125b-5p可以抑制HK2的表達(t=7.32,P<0.05,圖5B)。采用熒光定量PCR檢測miR-125b-5p抑制后對HK2 mRNA表達的影響,結果顯示,miR-125b-5p抑制后可顯著促進HK2 mRNA在Hela細胞中的表達(t=18.35,P<0.01,圖5C)。同樣對30例宮頸癌組織標本進行檢測,結果顯示miR-125b-5p與HK2的表達呈負相關(r2=0.265,P<0.01,圖5D)。上述結果表明,HK2是miR-125b-5p的靶基因,同時miR-125b-5p可負調控HK2的表達。
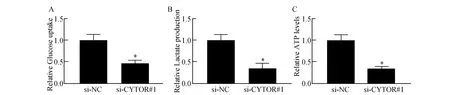
圖3 抑制CYTOR后對宮頸癌細胞有氧糖酵解能力的影響A:宮頸癌細胞葡糖糖攝取;B:宮頸癌細胞乳酸生成;C:宮頸癌細胞ATP生成與si-NC組比較,*P<0.05
3 討 論
通常認為,包括宮頸癌在內的惡性腫瘤的發生,內在癌基因的促進起到了十分關鍵的作用。因此,在過去幾十年,對癌基因及以其為靶點的研究成為熱門,傳統的觀點認為,癌基因就是蛋白質,因此惡性腫瘤的發生與蛋白質靶點的突變和異常相關,這使得研究者的焦點主要集中在基因編碼即編碼RNA領域,而忽視了占轉錄本上絕大部分的非編碼RNA,使得非編碼RNA產物在以往通常被稱之為“轉錄暗物質”。但近年來,隨著對基因表達調控尤其是表觀遺傳學的深入研究,非編碼RNA也是影響惡性腫瘤發生和發展的重要因素甚至是決定性因素。目前,非編碼RNA主要分為小分子RNA(microRNA)、環狀RNA(circular RNA, circRNA)、轉運RNA(transfer RNA,tRNA)和長鏈非編碼RNA(long non-coding RNA,LncRNA)等幾大類別,其中尤以LncRNA受到特別的關注。LncRNA是一大類長度超過200 bp的轉錄本,作為一種近年來新發現的非編碼RNA,被認為在調控惡性腫瘤的生物學行為中起到了關鍵作用,例如LncRNA參與了惡性腫瘤的發生、增殖、侵襲、轉移、抗凋亡、耐藥等諸多惡性表型[4]。例如在宮頸癌中,lncRNA HOXD簇反義RNA 1(HOXD cluster antisense RNA 1,HOXD-AS1)可以促進宮頸癌細胞的增殖[5];同樣的,結直腸腫瘤差異表達基因(Colorectal Neoplasia Differentially Expressed,CRNDE)也被認為是一個促進宮頸癌增殖和侵襲活性的癌基因[6]。CYTOR是一個近年來新發現的一個lncRNA,被認為在多種惡性腫瘤中發揮作用,例如在非小細胞肺癌中,CYTOR可以促進腫瘤細胞的增殖、侵襲并促進對放射治療的抗拒性[7]。又比如在結直腸癌細胞中,CYTOR可以促進腫瘤細胞的增殖,被認為是一個癌基因[8]。但目前為止,CYTOR在宮頸癌中的作用及機制如何,尚未見報道。本研究發現,CYTOR在宮頸癌組織和細胞中高表達,揭示了CYTOR在促進宮頸癌惡性表型中的作用。同時功能實驗證實,抑制CYTOR的表達可以明顯抑制宮頸癌細胞的增殖和侵襲活性,同時宮頸癌細胞的有氧糖酵解能力也顯著下降。這些實驗表明,CYTOR很可能是通過調節有氧糖酵解能力來調控宮頸癌細胞的增殖和侵襲活性的。
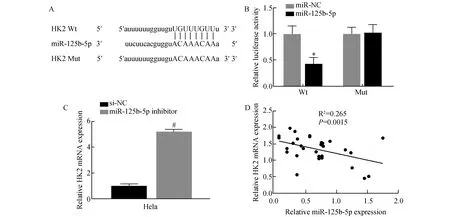
圖5 miR-125b-5p靶向調控HK2的表達A:HK2 mRNA 3UTR與miR-125b-5p存在互補關系;B:熒光素酶實驗證實HK2 mRNA與miR-125b-5p存在相互作用;C:抑制miR-125b-5p對HK2表達的影響;D:直線相關分析證實HK2與miR-125b-5p存在線性表達關系與miR-NC組比較,*P<0.05,與si-NC比較,#P<0.05
LncRNA可以通過多種途徑調控基因功能,例如與靶基因的啟動子區域結合調控靶基因轉錄,也可直接與信使RNA(messenger RNA,mRNA)結合調控靶基因的穩定性,但目前研究LncRNA的焦點還是集中在“分子海綿”這一獨特作用上。LncRNA可以特異性地與相應microRNA相結合,從而發揮“分子海綿”的作用影響microRNA對靶基因的調控[9]。例如UCA1通過吸附miR-206從而促進宮頸癌的轉移活性[10]。在本研究中,通過生物信息學和熒光素酶互作實驗證實,CYTOR可以競爭性吸附miR-125b-5p來促進癌基因HK2轉錄。miR-125b-5p被認為是一個抑癌基因,在多種惡性腫瘤中發揮抑癌作用。例如,miR-125b-5p可以抑制乳腺癌細胞的增殖和侵襲轉移[11];同樣的,在喉癌細胞中,miR-125b-5p可以抑制腫瘤細胞的增殖,其高表達可以提示喉癌患者具有良好的預后[12]。本研究也首次證實了miR-125b-5p在宮頸癌細胞中同樣發揮抑癌基因的作用,抑制CYTOR導致的miR-125b-5p活性提高可以抑制宮頸癌細胞的增殖和侵襲能力。因此,宮頸癌細胞中CYTOR的高表達,可能通過競爭性下調miR-125b-5p的活性,從而發揮癌基因的作用。
維持能量供給是細胞存活的先決條件之一,不同于正常細胞主要通過線粒體氧化途徑來供能,包括宮頸癌細胞在內的多種癌細胞,即使在氧氣充足的條件下,依然優先通過有氧糖酵解途徑來供能,這種特殊的有氧糖酵解活性,被認為是惡性腫瘤的十大重要特征之一[13]。因此,靶向有氧糖酵解通路,或者靶向調控有氧糖酵解的關鍵酶,被認為是抗腫瘤研究的熱門方向。HK2作為影響糖酵解途徑的關鍵限速酶之一,參與了多種腫瘤的發生發展,是一個潛在的腫瘤治療靶點[14]。本研究通過熒光素酶實驗證實,HK2可以與CYTOR/miR-125b-5p軸發生直接相互作用,CYTOR可能促進HK2的表達來促進宮頸癌細胞的增殖和侵襲活性,同時也增加了宮頸癌細胞的有氧糖酵解能力。同時表明,CYTOR/miR-125b-5p/HK2這一全新分子軸在宮頸癌的增殖侵襲以及有氧糖酵解調控上發揮重要作用。
綜上所述,本研究通過功能實驗證實,lncRNA CYTOR通過下調miR-125b-5p來上調HK2表達進而促進宮頸癌細胞增殖、侵襲和有氧糖酵解活性,從而促進宮頸癌的惡性表型。研究結果揭示CYTOR/miR-125b-5p/HK2有可能成為宮頸癌治療的有效靶點。但更具體的分子機制和靶向宮頸癌治療效果,有待今后進一步更細致深入的分子通路和動物實驗來證實。

