莫諾苷對小鼠T細胞體外活化與分化的影響
吳儀,仇欣,張燕,周婧文,李慈,趙傳祥,高鳳威,劉爍,姚雪,夏圣
(江蘇大學醫學院,江蘇鎮江212013)
植物山茱萸屬(Cornus)根據地理分布和形態學等可以細分為65種[1],大約在2 200年前,中草藥山茱萸(Cornus officinalis Sieb.et Zucc)就被記錄在《神農本草》中[2],其與中藥板藍根有相似的植物來源,具有抗炎、抗高血壓以及增強免疫系統的功能[3]。研究表明,屬于環烯醚萜苷類的莫諾苷和馬錢苷是中草藥山茱萸中主要的活性物質[4]。研究表明莫諾苷可以調控細胞Wnt/β-連環蛋白信號通路,而Wnt信號通路參與細胞增殖和不對稱細胞分裂的控制等[5]。因此,通過調控Wnt信號通路,莫諾苷具有防脫發[6]、抗心肌細胞凋亡[7]、促進細胞增殖、組織再生等廣泛的藥理作用。但是,目前這些研究大多局限于成骨細胞[8]、心肌細胞等組織細胞。
T細胞在發育、分化成熟的過程中伴隨著細胞增殖、歸巢等事件,Wnt信號在其中扮演著重要的角色。特異性敲除T細胞中β-連環蛋白,可導致其發育過程中細胞表面受體前體形成受損,細胞發育障礙[9]。但有關莫諾苷是否也會通過Wnt信號通路影響T細胞分化,尚不清楚。因此,本實驗中擬利用莫諾苷與抗原受體信號活化的T細胞共培養,探討山茱萸提取物莫諾苷對T細胞功能的影響。
1 材料和方法
1.1 材料
1.1.1 實驗動物 SPF清潔級C57BL/6小鼠(JAX 000664),同窩雌性,6~12周齡,體質量18~22 g,購自江蘇大學動物中心,合格證編號:No.201907363。
1.1.2 主要試劑 山茱萸莫諾苷提取物(成都普瑞法公司);RPMI-1640培養基、胎牛血清(美國Gibco公司);48、96孔細胞培養板(丹麥 Nunc公司);總RNA提取試劑Trizol、反轉錄試劑盒、SYBR Green熒光染料(日本TaKaRa公司);總蛋白提取RIPA裂解液、牛血清白蛋白(上海碧云天公司);AnnexinV、Th1、Th2流式細胞檢測試劑盒、IL-4試劑盒、TGF-βELISA試劑盒、抗小鼠IgG-HRP抗體、小鼠內參蛋白-HRP(杭州聯科公司);IFN-γELISA試劑盒、BCA試劑盒、蛋白指示條帶(美國Thermo公司);紅細胞裂解液、細胞刺激阻斷劑、功能性抗CD3抗體、功能性抗CD28抗體、抗小鼠Ki67 PercPCy5.5、抗小鼠CD25 PE、抗小鼠CD69 FITC、抗小鼠Foxp3 APC(美國 eBioscience公司);抗小鼠CD4 APC、抗小鼠CD8 APC、抗小鼠CD4 PE(美國Biolegend公司);小鼠β-連環蛋白抗體(美國CST公司);Tbx21、Gata3、淋巴樣增強因子 1(lymphoid enhance factor 1,LEF1)引物序列由上海生物工程公司合成。
1.1.3 主要儀器 超凈工作臺(蘇州凈化廠);細胞培養箱(美國Thermo公司);蛋白質免疫印跡系列設備、PCR儀、CFX96定量PCR儀(美國Bio-Rad公司);倒置式生物顯微鏡(日本Nikon公司);BD FACSCanto10C流式細胞儀(美國BD公司)。
1.2 小鼠脾臟淋巴細胞單細胞懸液的制備與計數
取適齡雌性C57BL/6小鼠,采用斷頸法處死,用手術剪和彎鑷無菌分離脾臟;置于預冷PBS中,將其剪碎至細小顆粒狀;并于300目篩網上過濾至無明顯紅色,即獲得脾臟單細胞懸液。將所獲懸液于4℃行1 000 r/min離心5 min,棄上清液;加入4 mL紅細胞裂解液,混勻,室溫靜置10 min;加入3倍體積的PBS終止反應;按上述條件再次離心、棄上清液;最后用1 mL含10%胎牛血清的RPMI-1640培養基重懸。用改良牛鮑氏計數板進行細胞計數后備用。
1.3 T細胞的活化及分組
抗CD3抗體包被:用無菌PBS將功能性抗CD3抗體原液(1 mg/mL)稀釋至5μg/mL,48孔板每孔加入200μL(96孔板每孔加入100μL),4℃包被過夜(>12 h);棄板中液體,預冷無菌PBS洗滌2遍;接種“1.2”中脾臟混合淋巴細胞,1×106/孔;用含10%胎牛血清的RPMI-1640培養基補至400μL/孔(96孔板補至200μL/孔);加入功能性抗CD28抗體原液(1 mg/mL),計算加入體積,保證終濃度為2μg/mL。鋪板完成后,將細胞分為2組,對照組和莫諾苷組。對照組不做任何處理培養96 h;莫諾苷組加入終濃度為10μmol/L的莫諾苷,于37℃、5%CO2條件下培養48 h;再次加入10μmol/L莫諾苷,繼續培養48 h;收集細胞進行后續實驗。
用于流式細胞術檢測T細胞亞群的細胞,需要在實驗前加入1×細胞刺激阻斷劑(原液500×)處理4~5 h,再收集檢測。
1.4 流式細胞術檢測T細胞活化、凋亡、增殖和分化的相應標志
收集“1.3”中T細胞,加入適量PBS洗滌2次;于4℃行1 000 r/min離心5 min;棄上清液,加入相應檢測不同表面標志的熒光抗體,1μL/管,4℃避光孵育30 min;PBS洗去游離抗體,加入適量PBS重懸細胞。用流式分析儀檢測對照組和莫諾苷組細胞相應表面熒光信號。
用于凋亡、增殖和細胞亞群檢測的細胞需在上述表面標志染好后,按照試劑盒說明書再加入相應破核、破膜試劑和熒光抗體,最后用相應緩沖液重懸細胞,用流式分析儀檢測細胞比例。
1.5 蛋白質印跡檢測T細胞中β-連環蛋白表達
收集“1.3”中2組T細胞,于4℃行1 000 r/min離心5 min;棄培養基,用PBS洗2遍;加入RIPA裂解液提取蛋白;用BCA試劑盒檢測蛋白濃度;行10%SDS-PAGE分離蛋白;120 V濕轉2 h,將所有目的蛋白和內參條帶轉至PVDF膜;5%牛血清白蛋白封閉1 h;剪下對應分子量的條帶,分別加入目的蛋白小鼠β-連環蛋白(1∶1 000)和內參蛋白抗體(1∶10 000),4℃孵育過夜;次日用TBST洗滌條帶3次,每次10 min;內參蛋白攜帶HRP基團可以直接進行暗室曝光,而 β-連環蛋白則需加入1∶10 000稀釋的抗小鼠IgG-HRP,室溫孵育1 h;TBST洗滌3次,每次10 min,行暗室曝光顯影。
1.6 ELISA檢測T細胞培養上清液中相關細胞因子的水平
收集“1.3”中2組T細胞上清液,按照ELISA試劑盒說明書的要求,分別檢測上清液中IFN-γ、IL-4和TGF-β的含量。
1.7 qRT-PCR檢測T細胞轉錄因子mRNA表達
收集“1.3”中2組T細胞,加入預冷PBS洗2遍;分別加入1 mL Trizol提取總RNA,按照反轉錄試劑盒說明書,將500 ng mRNA反轉錄為cDNA。以β-肌動蛋白為內參,cDNA為模板,定量檢測Th1、Th2轉錄啟動子Tbx21、Gata3和Wnt信號通路下游分子LEF1 mRNA水平。小鼠內參β-肌動蛋白序列:上游5′-TGGCGCTTTTGACTCAGGAT-3′,下游5′-GGGATGTTTGCTCCAACCAA-3′;小鼠Tbx21序列:上游5′-TGTGGATGTGGTCTTGGTGG-3′,下游5′-ATAAGCGGTTCCCTGGCAT-3′;小鼠Gata3序列:上游5′-GTCATCCCTGAGCCACATCT-3′,下游5′-AGGGCTCTGCCTCTCTAACC-3′;小鼠LEF1序列:上游5′-TCACTGTCAGGCGACACTTC-3′,下游5′-TGAGGCTTCACGTGCATTAG-3′;qRT-PCR反應體系:SYBR Green 5μL、雙蒸水3.6μL、上下游引物各0.2μL、cDNA 1μL,總反應體系 10μL。擴增條件為95℃ 5 s,57.8℃ 20 s(LEF1為56.5℃),72℃ 30 s,39次循環,用 2-ΔΔCT法計算相關基因表達。
1.8 統計學分析
流式實驗數據采用Flowjo 10.0進行分析處理,其他實驗數據采用GraphPad Prism 5.0軟件處理,各組樣本n均≥3,采用配對樣本t檢驗分析,P<0.05為差異有統計學意義。
2 結果
2.1 莫諾苷對T細胞增殖和活化的影響
如圖1所示,莫諾苷組與對照組細胞鏡下均可見細胞活化形成的集落,但集落大小和數量無顯著差異。莫諾苷組CD4+T細胞和CD8+T細胞增殖較對照組均有所上調,但差異無統計學意義(圖2)。由圖3可見,對照組和莫諾苷組間T細胞早期活化標志 CD69無明顯差異,但莫諾苷組 CD4+T和CD8+T細胞的晚期活化標志CD25熒光強度較對照組顯著增強(t=4.214,P=0.006;t=2.521,P=0.045)。
圖1 顯微鏡下觀察小鼠脾臟源T細胞形態
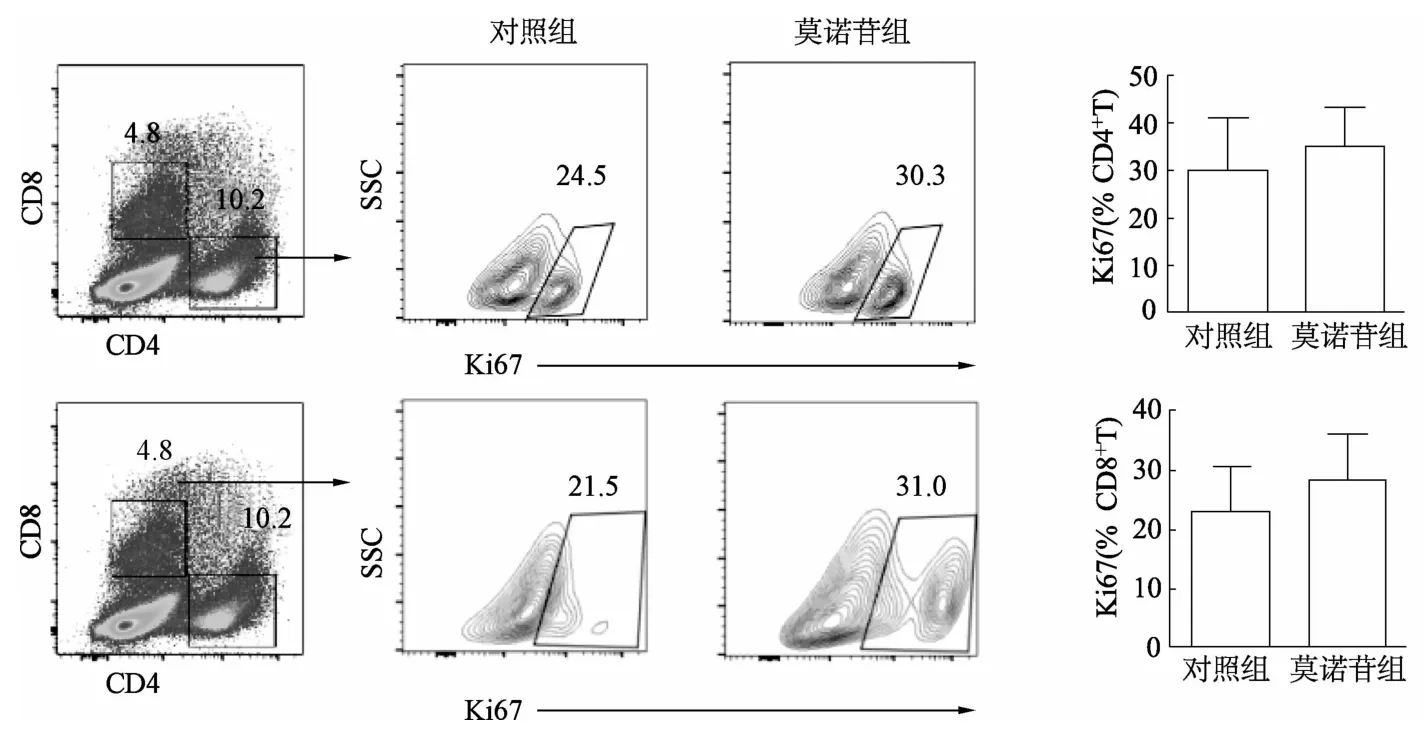
圖2 流式細胞術分析小鼠CD4+T和CD8+T細胞的增殖比例
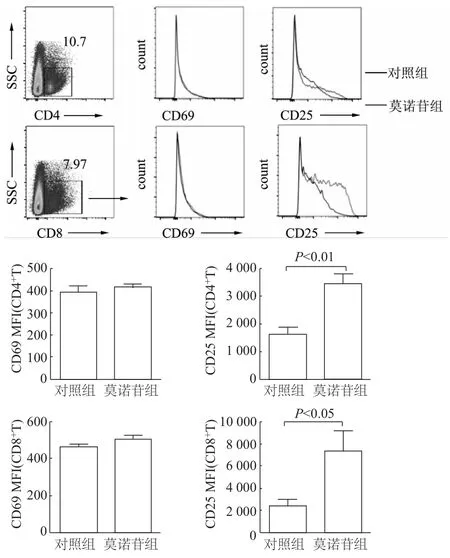
圖3 流式細胞術分析各組小鼠CD4+T和CD8+T細胞的活化情況
2.2 莫諾苷對T細胞凋亡的影響
與對照組相比,莫諾苷組CD4+AnnexinV+和CD8+AnnexinV+細胞比例降低,但差異無統計學意義(t=0.470,P=0.655;t=0.215,P=0.841)。見圖4。
2.3 莫諾苷對CD4+T細胞亞群體外分化的影響
與對照組相比,莫諾苷組T細胞分化功能明顯增強,分化的Th1、Th2和Treg亞群比例和細胞數均明顯升高(P均<0.05)。見圖5。
2.4 莫諾苷對T細胞活化轉錄因子和細胞因子分泌水平的影響
如圖6所示,與對照組相比,莫諾苷組Th1和Th2細胞發育的轉錄起始因子Tbx21 mRNA和Gata3 mRNA表達量均顯著增加(t=3.47,P=0.040;t=14.78,P=0.005)。與對照組相比,莫諾苷組T細胞分泌的IL-4水平明顯增加(t=3.402,P=0.009),但 IFN-γ水平差異無統計學意義。見圖7。
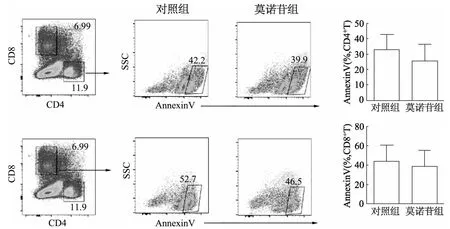
圖4 流式細胞術分析各組小鼠脾臟CD4+和CD8+T細胞的凋亡比例
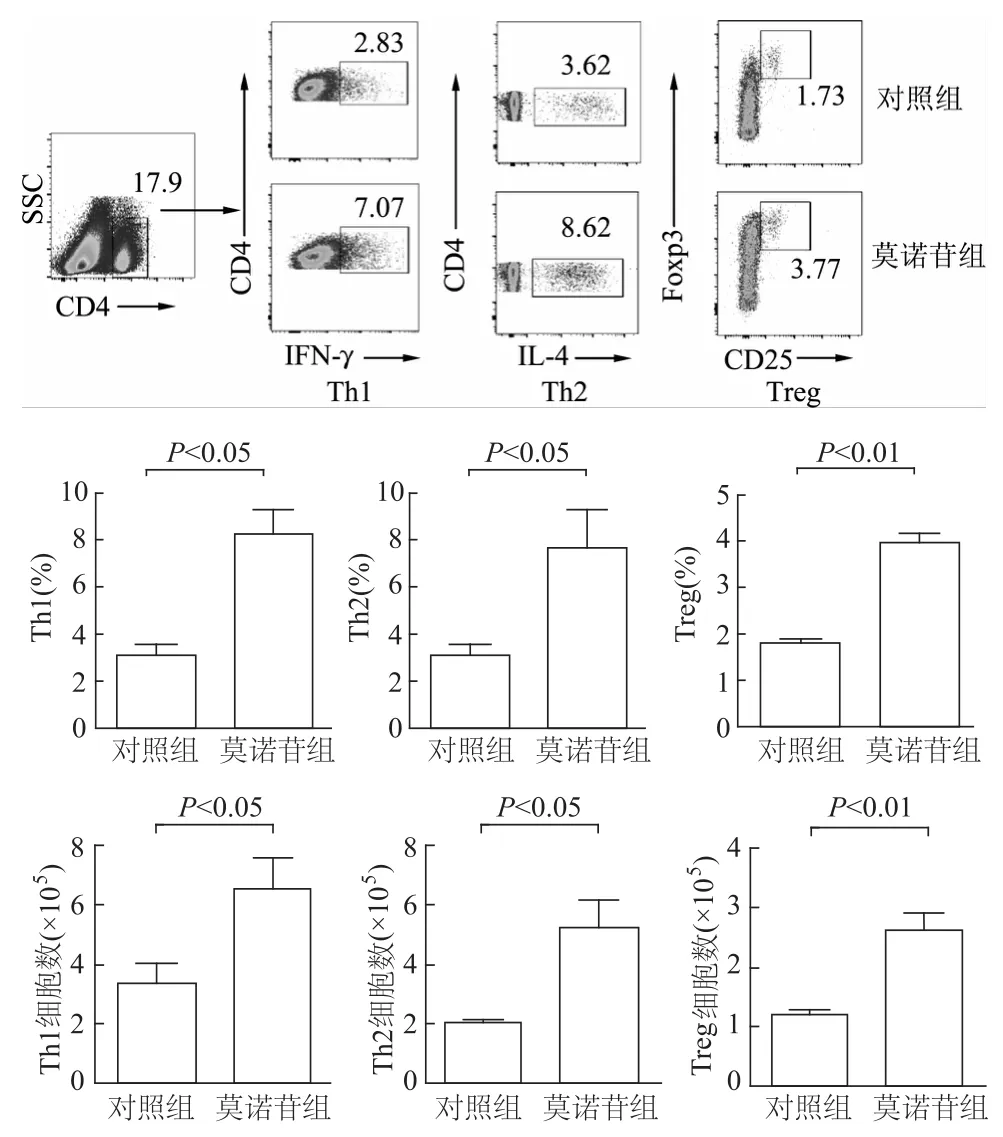
圖5 流式細胞術分析各組小鼠脾臟T細胞分化為Th1、Th2和Th17的情況
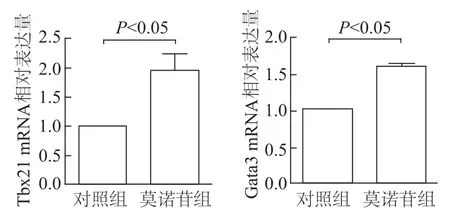
圖6 qRT-PCR法檢測各組小鼠脾臟T細胞Tbx21 m RNA和Gata3 m RNA的表達
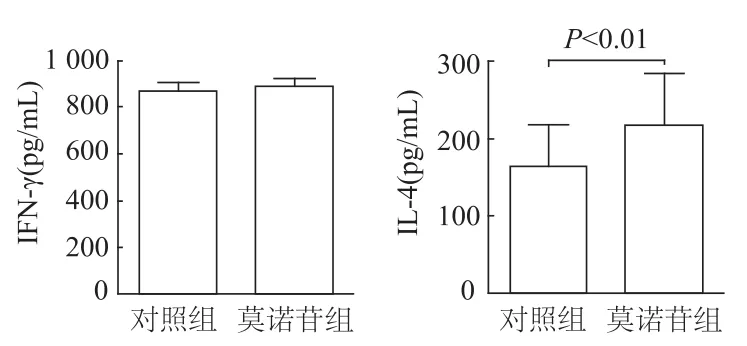
圖7 ELISA法檢測兩組T細胞IFN-γ和IL-4水平
2.5 莫諾苷對T細胞Wnt信號通路的影響
與對照組相比,莫諾苷組T細胞β-連環蛋白相對表達量明顯增加(t=16.47,P=0.004);LEF1 mRNA表達水平增強(t=2.605,P=0.048);同時細胞因子TGF-β表達水平顯著上調(t=2.664,P=0.029)。見圖8和圖9。
3 討論

圖8 蛋白質免疫印跡檢測各組小鼠脾臟T細胞β-連環蛋白水平
中國傳統醫學因其在慢性疾病中突出的優勢、穩定的療效且較西藥毒性低,受到了越來越多的關注[10]。山茱萸活性物質莫諾苷可通過調控Wnt信號通路,具有治療糖尿病[11]、抗炎鎮痛[12]等作用。Wnt信號通路主要由4條通路構成:β-連環蛋白、T細胞因子/淋巴細胞-增強子-結合因子通路、細胞極性通路和Wnt-Ca2+通路[13]。已有文獻表明,Wnt信號通路對于T細胞的發育也必不可少[14]。因此本研究通過實驗設計,在小鼠脾臟來源的T細胞中加入功能性CD3/CD28抗體,體外誘導T細胞活化、增殖和分化以評估山茱萸提取物莫諾苷是否能夠通過調控Wnt信號影響T細胞功能。
根據前期關于莫諾苷研究的文獻結果[15],本實驗選擇莫諾苷的處理濃度為5μmol/L和10μmol/L。在預實驗過程中,我們發現5μmol/L對于T細胞作用并不明顯,所以最終確定使用10μmol/L莫諾苷進行后續實驗。本實驗結果表明,與對照組相比,莫諾苷組T細胞中,Wnt信號通路下游分子β-連環蛋白和LEF1 mRNA表達量上調,活化的Wnt通路誘導細胞因子TGF-β分泌量增加,Treg細胞比例增加。同時莫諾苷組T細胞晚期活化標志CD25表達增加,T細胞分化為Th1、Th2功能增強,而轉錄起始因子Tbx21、Gata3等mRNA水平和細胞因子IL-4分泌增加也驗證T細胞分化能力增強。Wnt家族中Wnt5a能夠通過上調IL-12分泌從而促進Th1細胞的表達[16],但又有研究表明,Wnt信號通路中 T細胞因子能夠通過誘導Gata3表達,從而促進T細胞向Th2細胞分化[17]。由于Wnt信號通路的不同下游分子活化后本身就具有促進炎癥發生或者抑制炎癥反應的不同作用,這就可以解釋本實驗結果,加入莫諾苷后,多種Wnt信號通路下游分子被激活,導致Th1和Th2亞群分化比例和細胞數均升高。
本研究通過模擬外周T細胞活化的抗原刺激信號,驗證山茱萸提取物莫諾苷可促進T細胞活化與分化。但是由于莫諾苷對Wnt信號的多條通路均有影響,T細胞分化的各個亞群方向也受其影響,具體是何種機制在莫諾苷對T細胞功能調控中起主導作用,需要后續增加不同Wnt信號通路的抑制劑與莫諾苷共同處理培養T細胞實驗進一步驗證。

