沉默熱休克蛋白5可增敏青蒿琥酯誘導肝癌細胞鐵死亡
王康,張正陽,宋廉,龔愛華,王冬青,朱海濤
(1.江蘇大學醫學院,江蘇鎮江212013;2.江蘇大學附屬醫院影像科,江蘇鎮江212001)
肝癌全球死亡率居腫瘤性疾病第2位,現有的治療方案包括手術和非手術療法,效果有限[1]。鐵死亡是近年來發現的一種非凋亡、非壞死性細胞死亡方式,其所依賴的殺死腫瘤細胞的信號通路與經典的凋亡、壞死途徑完全不同[2-3]。因此,有望用誘導鐵死亡的手段來殺死一些耐凋亡、壞死的腫瘤細胞,比如肝癌細胞。青蒿琥酯是青蒿素衍生物的一種,可以通過誘導細胞內活性氧的過量聚集來殺死多種腫瘤細胞[4-5]。研究表明[6-8],青蒿素及其衍生物引起的細胞死亡為非凋亡非壞死性模式;同時有研究表明,青蒿琥酯可以引起胰腺癌細胞的鐵死亡[9],但其能否在其他組織來源的腫瘤細胞如肝癌細胞中引起鐵死亡目前仍不清楚。熱休克蛋白5(heat shock protein family A member 5,HSPA5)是內質網應激相關的一個關鍵蛋白,同時也是一種分子伴侶,當細胞受到各種有害刺激時,可以保護細胞避免死亡[10]。HSPA5表達與肝癌對鐵死亡的誘導劑Erastin、柳氮磺嘧啶的耐藥性相關[6,11],但 HSPA5是否與癌癥細胞對青蒿琥酯耐藥性相關仍不明確。本研究擬探討青蒿琥酯能否引起肝癌細胞的鐵死亡及HSPA5對青蒿琥酯誘導下的肝癌化療敏感性的影響。
1 材料與方法
1.1 材料
SMMC-7721人肝癌細胞株(中國科學院上海細胞研究所);青蒿琥酯、鐵死亡抑制劑ferrostatin-1、凋亡抑制劑 ZVAD-FMK、壞死抑制劑 necrosulfonamide(美國MedChemExpress公司);兔抗人多克隆抗體HSPA5,小鼠抗人多克隆抗體GAPDH,丙二醛檢測試劑盒均為美國Abcam公司產品;6孔板、96孔板(美國Corning公司);CCK-8試劑盒(北京智杰方遠科技有限公司);蛋白質印跡法全自動凝膠成像儀(中國Sage Creation公司);FACS Calibur流式細胞儀(美國BectonDickin-son公司);HSPA5過表達和干擾慢病毒套裝(蘇州復百澳生物科技有限公司,病毒滴度約為1×109IU/mL,載體為FV055);C11-BODIPY熒光染料(美國Thermo公司)。進行以下分組:對照組、青蒿琥酯組、青蒿琥酯+ferrostatin-1組、青蒿琥酯+ZVAD-FMK組、青蒿琥酯+necrosulfonamide組,分別與二甲基亞砜、20μmol/L青蒿琥酯、20μmol/L青蒿琥酯+1μmol/L ferrostatin-1、20μmol/L青蒿琥酯+1μmol/L ZVAD-FMK、20 μmol/L青蒿琥酯+0.5μmol/L necrosulfonamide共培養24 h。
1.2 方法
1.2.1 細胞培養 SMMC-7721細胞用DMEM高糖培養基(含10%胎牛血清、100 U/L青霉素、100 mg/L鏈霉素),于37℃、5%CO2及飽和濕度的細胞培養箱培養。
1.2.2 CCK-8法檢測細胞增殖率
1.2.2.1 選取青蒿琥酯最佳濃度 取對數生長期SMMC-7721細胞,接種于96孔板,每孔4 000個細胞,設3個復孔;次日細胞貼壁后,每孔加入100μL反應溶液(90μL無血清培養基+10μL CCK-8試劑),同時設立空白組(只含DMEM)進行校正,置于37℃、5%CO2恒溫恒濕培養箱培養2 h;用酶標儀測定450 nm波長處各孔光密度(D)值。
1.2.2.2 檢測不同細胞死亡方式抑制劑對青蒿琥酯殺傷SMMC-7721細胞的影響 取對數生長期SMMC-7721細胞,接種于96孔板,每孔4 000個細胞,設3個復孔;次日細胞貼壁后,進行以下分組:對照組、青蒿琥酯組、青蒿琥酯+ferrostatin-1組、青蒿琥酯+ZVAD-FMK組、青蒿琥酯+necrosulfonamide組,分別與二甲基亞砜、20μmol/L青蒿琥酯、20μmol/L青蒿琥酯+1μmol/L ferrostatin-1、20 μmol/L青蒿琥酯+1μmol/L ZVAD-FMK、20μmol/L青蒿琥酯+0.5μmol/L necrosulfonamide共培養24 h;CCK-8法測各組細胞活性(具體實驗操作方法同“1.2.2.1”)。
1.2.3 細胞分組及相應指標檢測
1.2.3.1 細胞分組 取對數期SMMC-7721細胞,加入胰酶置于37℃、5%CO2培養箱中消化5 min;用含血清培養液重懸制成細胞懸液,接種入2塊6孔板,每孔培養基補足至2 mL,于37℃、5%CO2培養箱中培養24 h;觀察細胞狀態良好,將細胞分為二甲基亞砜組、青蒿琥酯組、青蒿琥酯+去鐵胺組,分別用二甲基亞砜、20μmol/L青蒿琥酯、20μmol/L青蒿琥酯+100 mmol/L去鐵胺處理24 h。
1.2.3.2 脂質來源活性氧水平檢測 棄培養基,PBS沖洗2遍;每孔加入0.5 mL 0.25%胰酶(不含EDTA)消化,顯微鏡下觀察到細胞變圓時加入完全培養基終止消化,并輕輕吹打均勻;將細胞懸液以1 200 r/min,4℃離心5 min;棄上清液,用無血清培養基重懸。每1 mL細胞懸液中加入10 mmol/L C11-BODIPY(581/591)儲存液,使其終濃度為10μmol/L,輕輕吹打均勻后放入37℃、5%CO2的培養箱中避光孵育30 min;每隔5 min輕輕搖晃,以使細胞與C11-BODIPY(581/591)充分混勻;用無血清培養基洗滌細胞3次,以去除背景干擾。收集各組細胞懸液至流式管,室溫避光孵育5 min以去除死細胞干擾。流式細胞儀檢測(激發波長581 nm、發射波長591 nm)各組細胞的平均熒光強度。
1.2.3.3 丙二醛含量檢測 棄舊培養基,用PBS沖洗2遍;每孔加入100μL細胞裂解液,充分裂解細胞;將裂解后的樣品轉移至EP管,1 200 r/min,4℃離心5 min;取上清液,用BCA法測定蛋白濃度;按照產品說明書推薦比例配置丙二醛檢測工作液。將0.1mL樣品和0.2mL檢測工作液旋渦混勻器混勻;100℃加熱60min,冷卻至室溫;4℃1 200 r/min離心15 min,冷卻至室溫;取200μL上清液于96孔板中測定535 nm處各孔光密度值。按照以下公式計算細胞中丙二醛含量:丙二醛濃度(μmol/mg)=(D測定-D空白)/(D標準-D空白)×10/蛋白質質量濃度(mg/mL)。
1.2.4 HSPA5低表達和過表達細胞株的構建及轉染效率驗證 取對數期SMMC-7721細胞均勻接種至6孔板,每孔約5×105,接種3孔;用10%含血清DMEM于恒溫培養箱培養24 h;待細胞融合率達到70%左右時,分為3組:對照組、HSPA5-shRNA組、Flag-HSPA5組,分別每孔加入50μL空載(Vector)、HSPA5-shRNA、Flag-HSPA5病毒液;混勻后在恒溫培養箱中繼續培養6 h;更換為10%含血清的常規培養基繼續培養48 h。
1.2.4.1 qRT-PCR檢測HSPA5 mRNA表達水平
棄培養基,用PBS洗2遍;用Trizol法提取總RNA,反轉錄為cDNA;以cDNA為模板、GAPDH為內參,定量檢測擴增HSPA5的mRNA水平。qRT-PCR反應體系:SYBRGreen 5μL、雙蒸水4μL、上下游引物各0.25μL、cDNA 0.5μL,總反應體系為10μL。按如下條件進行反應:95℃預變性3 min;95℃變性10 s;60℃退火 30 s,40個循環。采用 2-△△CT表示目的mRNA的表達水平。HSPA5引物序列:上游5′-CTGTCCAGGCTGGTGTGCTCT-3′;下游5′-CTTGGTAGGCACCACTGTGTTC-3′。
1.2.4.2 蛋白質印跡法檢測HSPA5蛋白的表達
收集各組細胞,抽提總蛋白,裂解細胞時加入2×蛋白上樣緩沖液,100℃ 煮沸5 min;12 000 r/min,4℃離心10 min;取上清液,100 V行10%SDSPAGE分離蛋白;用半干電轉化法300 mA轉至PVDF膜(需提前在甲醇中浸泡3 min),轉膜2 h;5%BSA室溫封閉1 h;加入兔抗HSPA5抗體,小鼠抗GAPDH抗體(內參,稀釋比為1∶1 000,TBST為抗體稀釋液),4℃孵育過夜;次日用1×TBST洗滌3次,每次10 min;分別加入相應的兔、鼠二抗(稀釋比為1∶5 000)室溫孵育1 h;TBST洗膜3次,每次10 min;ECL發光試劑顯影。采用Image J軟件處圖像。
1.2.5 細胞轉染分組及相關指標檢測
1.2.5.1 細胞分組及轉染 取對數生長期空載、過表達及干擾HSPA5的SMMC-7721細胞,加入胰酶置于37℃、5%CO2培養箱中消化5 min;用含血清培養液重懸制成細胞懸液,分別接種于96孔板(用于CCK-8檢測)或6孔板(用于丙二醛含量檢測),每孔4 000個細胞,設3個復孔,每種細胞共種6個孔;次日細胞貼壁后,進行以下分組:二甲基亞砜+空載質粒組、二甲基亞砜+HSPA5-shRNA干擾質粒組、二甲基亞砜+Flag-HSPA5過表達質粒組、青蒿琥酯+空載質粒組、青蒿琥酯+HSPA5-shRNA干擾質粒組、青蒿琥酯+Flag-HSAPA5過表達質粒組;其中,二甲基亞砜+空載質粒組、二甲基亞砜+HSPA5-shRNA干擾質粒組、二甲基亞砜+Flag-HSPA5過表達質粒組與二甲基亞砜共培養24 h,青蒿琥酯+空載質粒組、青蒿琥酯共培養24 h。
1.2.5.2 CCK-8法檢測細胞活性 具體實驗操作方法同“1.2.2.1”。
1.2.5.3 丙二醛含量檢測 具體實驗操作方法同“1.2.3.2”。
1.3 統計學分析
采用SPSS 22.0統計軟件,計量資料以均數±標準差(±s)表示,兩組間比較采用獨立樣本t檢驗,多組間均數比較行單因素方差分析,組間多重比較采用LSD-t檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 青蒿琥酯最佳作用條件
與0μmol/L相比,20、40μmol/L青蒿琥酯處理組細胞存活率明顯降低(t=6.587,16.400,P均<0.05);其中20μmol/L青蒿琥酯處理SMMC-7721細胞時,藥物濃度達到半數致死量。故選20μmol/L青蒿琥酯作為最佳實驗濃度用于后續實驗。見圖1。
2.2 青蒿琥酯促進肝癌細胞鐵死亡
由圖2可見,青蒿琥酯組細胞活性明顯低于對照組(t=5.743,P<0.05),青蒿琥酯+ferrostatin-1組細胞活性明顯高于青蒿琥酯組(t=2.857,P<0.05),青蒿琥酯+ZVAD-FMK組和青蒿琥酯+necrosulfonamide組細胞活性與青蒿琥酯組比較,差異均無統計學意義(P>0.05)。由此說明,鐵死亡抑制劑可抑制青蒿琥酯的細胞毒作用,而凋亡或壞死抑制劑對青蒿琥酯的細胞毒作用抑制不明顯。

圖2 CCK-8法檢測各組細胞存活率
2.3 青蒿琥酯促進肝癌細胞脂質過氧化反應
與對照組相比,青蒿琥酯處理的SMMC-7721細胞脂質來源活性氧水平和丙二醛水平明顯增高(t=7.247,3.236,P均<0.05)。與青蒿琥酯組相比,青蒿琥酯+去鐵胺組細胞內脂質來源活性氧和丙二醛水平明顯降低(t=4.900,3.472,P均<0.05)。見圖3~4。由此表明,青蒿琥酯引起肝癌SMMC-7721細胞內脂質過氧化。同時,這種過氧化可被鐵離子螯合劑去鐵胺所抑制。
2.4 病毒感染SMMC-7721細胞后HSPA5 mRNA和蛋白的表達
與Vector組相比,HSPA5-shRNA組HSPA5 mRNA和蛋白表達水平明顯降低(t分別為12.480,8.141,P均<0.05),而 Flag-HSPA5組 HSPA5 mRNA和蛋白表達明顯增加(t分別為18.280,8.632,P均<0.05)。見圖5~6。由此表明,SMMC-7721細胞中HSPA5質粒干擾及過表達效率較高。
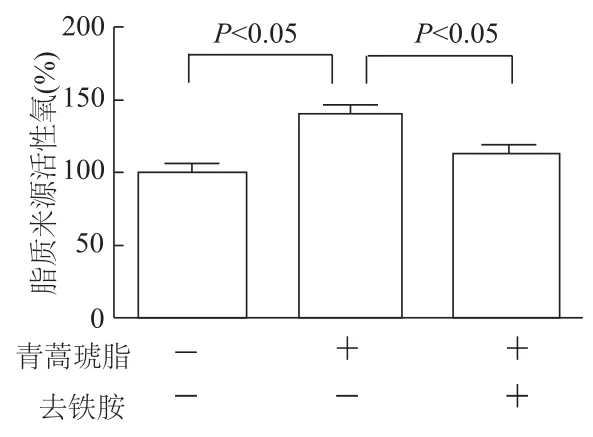
圖3 各組細胞內脂質來源活性氧水平比較

圖4 各組細胞內丙二醛水平比較

圖5 qRT-PCR法檢測HSPA5 mRNA的表達

圖6 蛋白質印跡法檢測感染病毒后HSPA5蛋白的表達
2.5 干擾HSPA5促進青蒿琥酯殺傷效力
由圖7可見,青蒿琥酯組細胞活性明顯低于對照組(t=17.09,P<0.05),青蒿琥酯+HSPA5-shRNA組細胞活性明顯低于青蒿琥酯組(t=2.841,P<0.05),而青蒿琥酯+Flag-HSPA5組細胞活性明顯高于青蒿琥酯組(t=8.491,P<0.05)。青蒿琥酯組細胞丙二醛水平明顯高于對照組(t=2.796,P<0.05),青蒿琥酯+HSPA5-shRNA組細胞丙二醛水平明顯高于青蒿琥酯組(t=6.720,P<0.05),而青蒿琥酯+Flag-HSPA5組細胞丙二醛水平明顯低于青蒿琥酯組(t=14.23,P<0.05)。見圖8。

圖7 CCK-8法檢測各組細胞活性

圖8 細胞內丙二醛水平
3 討論
本研究發現,在人肝癌SMMC-7721細胞中,鐵死亡特異性抑制劑ferrostatin-1可消除青蒿琥酯對肝癌細胞的殺傷作用,而凋亡抑制劑ZVAD-FMK或壞死抑制劑necrosulfonamide則起不到顯著的殺傷抑制作用;此外在青蒿琥酯的作用下,細胞內的脂質過氧化水平增高,而鐵離子螯合劑去鐵胺可以消除青蒿琥酯所導致的細胞內脂質過氧化,其機制可能與細胞內的鐵離子過載相關。有研究表明,青蒿琥酯可以在人胰腺癌細胞和人正常肝細胞中引起鐵死亡[5,12]。這與我們對青蒿琥酯可以誘導肝癌細胞發生鐵死亡的猜想相一致。但同時也有研究顯示,青蒿琥酯可以引起乳腺癌細胞發生凋亡[13]。這可能是由于不同組織來源的細胞對鐵死亡或者凋亡的敏感性不同所導致。
同凋亡壞死一樣,在青蒿琥酯誘導的鐵死亡中一些基因如HSPA5,可導致腫瘤細胞對青蒿琥酯產生耐藥性[14]。HSPA5表達與肝癌對鐵死亡誘導劑Erastin、柳氮磺嘧啶的耐藥性相關[6,11],但 HSPA5是否與癌癥細胞對青蒿琥酯耐藥性相關仍不明確。本研究用干擾質粒HSPA5-shRNA抑制HSPA5表達后,肝癌細胞對青蒿琥酯的化療抵抗能力明顯下降;在同樣濃度的青蒿琥酯處理下,干擾 HSPA5的SMMC-7721細胞活性明顯低于未干擾組,而脂質過氧化水平則高于未干擾組;由此表明,通過抑制腫瘤細胞中HSPA5蛋白表達可能增強青蒿琥酯化療效果,但HSPA5具體通過何種信號通路和機制來影響青蒿琥酯所調控的鐵死亡還需要進一步的研究證實。
本研究中,青蒿琥酯可有效地殺傷肝癌細胞,但只有在較大劑量(40μmol/L)時才能發揮較強的腫瘤殺傷作用。青蒿琥酯作為一種中藥提取物,如何把青蒿琥酯控制在安全劑量內,同時又能有效地抑制腫瘤細胞的生長,還有待于后續研究進一步探索。本實驗室正在積極嘗試各種藥物同青蒿琥酯的組合以尋找在較低的用藥劑量下即可達到有效抑制腫瘤生長的目的。
綜上所述,通過感染HSPA5-shRNA病毒可以增強肝癌細胞對青蒿琥酯的化療敏感度,其機制可能與鐵死亡引起的細胞內脂質成分過氧化相關。

