心肌營養素-1對抗NMDA受體腦炎致海馬神經元損傷的保護作用
李振宏 黃濤


【摘要】 目的:研究營養素-1(CT-1)干預治療抗N-甲基-D-天門冬氨酸(NMDA)受體腦炎誘導的神經元損傷的保護作用及機制,為抗NMDA受體腦炎提供新的治療靶點。方法:選擇剛出生的SD大鼠培養原代神經元細胞,把原代神經元細胞分為實驗組﹑對照組和正常組,分別建立抗NMDA受體腦炎誘導的神經元損傷模型,在實驗組中加入CT-1(10 ng/mL),應用臺盼藍染色法、免疫組織化學和TUNEL細胞凋亡檢測等技術,檢測CT-1對抗NMDA受體腦炎誘導神經元損傷的保護作用以及細胞凋亡基因Caspase-3表達水平。結果:各種濃度的谷氨酸均能誘導神經元凋亡,谷氨酸濃度為100﹑200 μmol/L時,細胞凋亡率高而死亡率并不高;加入CT-1神經元細胞,第1、2、3天,實驗組細胞存活率均高于對照組,細胞凋亡率、Caspase-3陽性細胞率均低于對照組,差異均有統計學意義(P<0.05)。結論:CT-1對抗NMDA受體腦炎導致的神經元損傷有保護作用,可能是通過促使凋亡基因Caspase-3表達下調,減少細胞凋亡發生,從而對抗NMDA受體腦炎誘導的神經元損傷起到保護作用。
【關鍵詞】 抗NMDA受體腦炎; 神經元; 損傷; 心肌營養素-1
【Abstract】 Objective:To study the protective effect and mechanism of cardiotrophin-1(CT-1)intervention on neuronal injury induced by anti-NMDA-receptor encephalitis and to provide a new therapeutic target for anti-NMDA-receptor encephalitis.Method:The primary neuron cells were cultured in newly born SD rats,they were divided into experimental group,control group and normal group,neuronal injury models induced by anti-NMDA-receptor encephalitis were established,CT-1(10 ng/mL)was added to experimental group.Trypan blue staining,immunohistochemistry and TUNEL cell apoptosis detection were used to detect the protective effect of CT-1 on neuronal injury induced by NMDA receptor encephalitis and the expression level of Caspase-3.Result:All concentrations of glutamate could induce neuronal apoptosis,when the concentration of glutamate was 100 and 200 μmol/L,the apoptotic rate was high and the mortality rate was not high.On the 1st,2nd and 3rd day after adding CT-l neurons,the survival rate of experimental group were higher than those of control group,and the apoptotic rate and Caspase-3 positive cell rate were lower than those of control group,the differences were statistically significant(P<0.05).Conclusion:CT-1 has protective effect against neuronal injury induced by anti-NMDA-receptor encephalitis,which may be through down-regulation of Caspase-3 expression and reduction of apoptosis,thereby protecting neurons from NMDA receptor encephalitis-induced neuronal injury.
【Key words】 Anti-NMDA-receptor encephalitis; Neuron; Injury; Cardiotrophin-1
First-authors address:Ganzhou Hospital Affiliated to Nanchang University,Ganzhou 341000,China
doi:10.3969/j.issn.1674-4985.2019.10.006
抗N-甲基-D-天門冬氨酸(N-methyl-D-aspartate,NMDA)受體腦炎是一種起病時臨床表現不典型,易被臨床工作者忽視的一種神經系統疾病,心肌營養素-1(cardiotrophin-1,CT-1)是Pennica等于1995年發現的一種細胞因子,與睫狀神經營養因子、白血病抑制因子、白介素6等同屬促神經生長因子家族[1-2]。近年來發現CT-l對中樞神經系統有重要作用,可通過其特異性受體對神經元起保護作用[3-5]。本研究針對抗NMDA受體腦炎的發病機制,通過建立抗NMDA受體腦炎體外培養模型,觀察CT-1對抗NMDA受體腦炎誘導神經元損傷的保護作用,了解CT-1對神經元的作用和機制,為抗NMDA受體腦炎的臨床研究提供新的靶點。現報道如下。
1 材料與方法
1.1 實驗動物 選擇剛出生的SD大鼠,進行原代神經元細胞培養。
1.2 方法
1.2.1 原代神經元培養 選擇剛出生的SD大鼠,用眼科鑷取出海馬,D-Hanks液清洗后,剪成1 mm3左右的小塊,在37 ℃溫度下用0.25%胰蛋白酶消化組織小塊后,調節細胞懸液濃度為1×106/mL,接種于經0.01%多聚賴氨酸預處理的細胞培養瓶中。神經元細胞培養9 d后,經過NF-200免疫細胞組織化學法鑒定,神經元占培養細胞的90%以上。
1.2.2 建立抗NMDA受體腦炎誘導的神經元損傷模型 當神經元細胞培養至第9天,隨機選取60個標本為實驗1組,15個樣本為對照1組,將實驗1組均分為4個小組,分別加入不同濃度谷氨酸(100、200、300、400 μmol/L),對照1組不加任何藥品處理,實驗1組中不同濃度的谷氨酸與神經元細胞作用15 min后更換新鮮培養液,24 h后進行臺盼藍染色和TUNEL細胞凋亡檢測。(1)臺盼藍染色檢測細胞存活率:神經元細胞經臺盼藍染色后,隨機計數15個視野中藍染神經元數,死亡細胞被染成藍色,未著色的細胞為存活細胞。神經元存活率=神經元存活數/細胞總數×100%。(2)TUNEL檢測細胞凋亡率:神經元細胞經TUNEL檢測,隨機計數15個視野中深棕色神經元數,凋亡細胞被染成深棕色,未著色的細胞為存活細胞。神經元凋亡率=神經元凋亡數/細胞總數×100%。
1.2.3 CT-1對抗NMDA受體腦炎誘導神經元損傷的保護作用 另隨機選取原代神經元細胞45個標本,將其均分為實驗組﹑對照組和正常組,各15個標本。實驗組在加谷氨酸前1天加入CT-1(10 ng/mL),對照組中加入相同劑量緩沖液,正常組不做處理。當神經元細胞培養至第9天,將低濃度谷氨酸(100 μmol/L)加入實驗組和對照組中,15 min后換回正常細胞培養液,正常組不加入谷氨酸。繼續培養細胞至1﹑2、3 d進行細胞存活率、凋亡率和細胞凋亡基因Caspase-3表達水平。Caspase-3基因表達檢測:采用免疫組化方法檢測Caspase-3基因表達,隨機計數15個視野中陽性神經元數和總神經元數,神經元中有棕色著色者為陽性神經元,Caspase-3基因陽性表達率=陽性神經元數/神經元總數×100%。
1.3 統計學處理 使用SPSS 19.0軟件對所得數據進行統計分析,計量資料用(x±s)表示,多組間比較采用方差分析,以P<0.05為差異有統計學意義。
2 結果
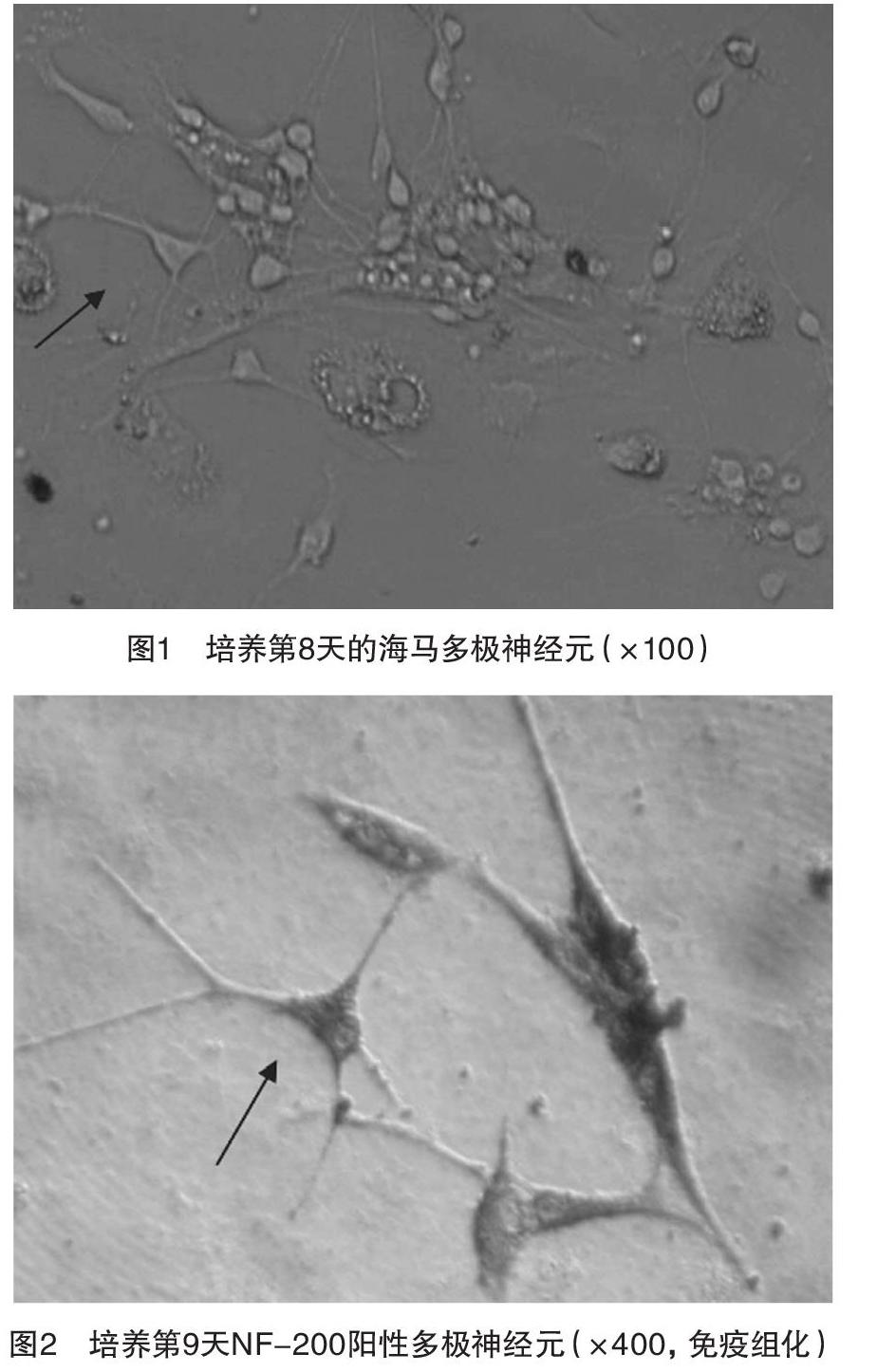
2.1 原代神經元培養和鑒定 神經元細胞接種細胞培養瓶后,可見細胞為懸浮在培養液中的小圓形細胞,邊界清楚,細胞密度很高;1 d后在培養瓶壁上可見大多數細胞基本貼壁,少數細胞可見軸突生長,軸突長度約占細胞體的一半;2 d后大多數細胞有軸突生長,長度約為胞體的2~3倍;3 d后神經元細胞胞體變大,軸突長度增長不明顯;第4~5天可見許多細胞碎片,為崩解的神經膠質細胞;培養第8天,軸突逐漸增長,彼此相互連接,形成網狀,見圖1;細胞培養第9天,免疫組織化學鑒定神經元,神經元細胞及其軸突被染成棕色,棕色陽性細胞占全部細胞的90%以上,見圖2。
2.2 抗NMDA受體腦炎誘導的神經元損傷模型分析 臺盼藍染色發現,不同濃度的谷氨酸作用于神經元細胞6 h后,可見部分細胞胞體腫脹,細胞軸突變短,1 d后部分腫脹細胞裂解;TUNEL染色發現,不同濃度的谷氨酸作用于神經元細胞1 d后,神經元細胞體積變小,細胞核固縮;各種濃度的谷氨酸均能誘導神經元凋亡,實驗1組不同濃度谷氨酸組細胞存活率均低于對照1組,凋亡率均高于對照1組,差異均有統計學意義(P<0.05),且隨著谷氨酸濃度逐漸升高,神經元細胞的存活率逐漸下降,細胞凋亡率逐漸上升,差異均有統計學意義(P<0.05),其中谷氨酸濃度為100﹑200 μmol/L時,細胞凋亡率隨著谷氨酸濃度的升高而升高,而濃度為200﹑300﹑400 μmol/L時,細胞凋亡率隨著谷氨酸濃度的升高而下降,見表1和圖3、4。
2.3 CT-1對神經元的保護作用
2.3.1 細胞凋亡率、存活率比較 當神經元細胞培養至第9天,加入100 μmol/L谷氨酸誘導凋亡后,TUNE檢測顯示:第1、2、3天,正常組細胞凋亡率均低于實驗組和對照組,且實驗組低于對照組,差異均有統計學意義(P<0.05);臺盼藍染色顯示:第1、2、3天,正常組細胞存活率均高于實驗組和對照組,且實驗組均高于對照組,差異均有統計學意義(P<0.05),見表2、圖5~9。
2.3.2 Caspase-3基因表達情況分析 細胞免疫組化技術檢測Caspase-3蛋白在神經元細胞中的表達情況,Caspase-3陽性細胞可見神經元胞漿和軸突著色;凋亡后第1、2、3天,正常組Caspase-3陽性細胞率均低于實驗組和對照組,且實驗組均低于對照組,差異均有統計學意義(P<0.05),見表3和圖10、11。
3 討論
抗NMDA受體腦炎是一種起病時臨床表現不典型,易被臨床工作者忽視的一種神經系統疾病,主要累及人體大腦邊緣系統,典型臨床表現以精神異常與癲癇發作為特征,其中大多數病人由腫瘤、感染等引起[6-12]。抗NMDA受體腦炎的發病機制迄今尚未完全闡明,目前大部分學者認為該病是抗NMDA抗體介導的免疫損傷所致,NMDA受體是一種谷氨酸離子型受體,由多種亞基組成的異四聚體,屬電壓門控通道,大量存在于大腦神經細胞中,其中主要分布在大腦海馬區等邊緣系統,功能主要是調節突觸傳遞及促發突觸重塑,異常激活常導致驚厥發作、精神異常等臨床表現[13-17]。
本研究在神經元細胞培養至第10天,當神經元發育成熟,細胞狀態良好時,用不同濃度的谷氨酸作用于神經元細胞,檢測細胞凋亡率,結果顯示,各種濃度的谷氨酸均能誘導神經元凋亡,實驗1組不同濃度谷氨酸組細胞凋亡率均高于對照1組,且隨著谷氨酸濃度逐漸升高,神經元細胞凋亡率逐漸上升,差異均有統計學意義(P<0.05),其中谷氨酸濃度為100﹑200 μmol/L時,細胞凋亡率隨著谷氨酸濃度的升高而升高,而濃度為200﹑300﹑400 μmol/L時,細胞凋亡率隨著谷氨酸濃度的升高而下降。而且本研究結果顯示,實驗1組不同濃度谷氨酸組細胞存活率均低于對照1組,且隨著谷氨酸濃度逐漸升高,神經元細胞的存活率逐漸下降,差異均有統計學意義(P<0.05)。由于谷氨酸濃度為100﹑200 μmol/L時,細胞凋亡率高而細胞死亡率并不高,提示100﹑200 μmol/L的谷氨酸為誘導神經元凋亡的最佳濃度。在證實了低濃度的谷氨酸可引起神經元凋亡之后,筆者在使用谷氨酸誘導神經元凋亡的前1天,在實驗組神經元細胞中加入CT-1,然后采用TUNEL檢測和臺盼藍染色等方法來評價CT-1對神經元的保護作用,結果顯示,第1、2、3天,正常組細胞凋亡率均低于實驗組和對照組,且實驗組低于對照組,差異均有統計學意義(P<0.05),正常組細胞存活率均高于實驗組和對照組,且實驗組均高于對照組,差異均有統計學意義(P<0.05),說明加入了CT-1的實驗組細胞存活率明顯高于對照組,而細胞凋亡率卻明顯低于對照組,提示CT-1對抗NMDA受體腦炎導致的神經元損傷具有抑制作用,對神經元具有保護作用。而其對神經元的保護作用,可能主要是通過抑制凋亡的途徑來實現的。
Caspase家族在介導細胞凋亡的過程中起著非常重要的作用,其中Caspase-3為關鍵的執行分子,其在凋亡信號傳導的許多途徑中發揮作用。Caspase-3正常以酶原的形式存在于胞漿中,在凋亡的早期階段被激活,活化的Caspase-3由兩個大亞基和兩個小亞基組成,裂解相應的胞漿胞核底物,最終導致細胞凋亡[18-20]。在抗NMDA受體腦炎導致的神經元凋亡的機制中,為探究有無Caspase-3的參與,而CT-1對其表達有無抑制作用,筆者作了Caspase-3免疫組化,結果顯示:凋亡后第1、2、3天,正常組Caspase-3陽性細胞率均低于實驗組和對照組(P<0.05),提示谷氨酸損傷使Caspase-3蛋白表達增加,Caspase-3參與了抗NMDA受體腦炎導致的神經元凋亡的機制;實驗組Caspase-3蛋白表達低于對照組(P<0.05),提示CT-1可抑制Caspase-3蛋白表達,因此其抑制凋亡的作用可能與抑制Caspase-3蛋白表達有關。
綜上所述,本研究提示低濃度谷氨酸可作為抗NMDA受體腦炎導致的神經元凋亡的良好模型,CT-1對抗NMDA受體腦炎導致的神經元損傷有保護作用,可能是通過促使凋亡基因Caspase-3表達下調,減少細胞凋亡發生,從而對抗NMDA受體腦炎誘導的神經元損傷起到保護作用。
參考文獻
[1] Viaccoz A,Desestret V,Ducray F,et al.Clinical specificities of adult male patients with NMDA receptor antibodies encephalitis[J].Neurology,2014,82(7):556-563.
[2] Dong Y,Kalueff A V,Song C.N-methyl-d-aspartate receptor-mediated calcium overload and endoplasmic reticulum stress are involved in interleukin-1beta-induced neuronal apoptosis in rat hippocampus[J].J Neuroimmunol,2017,307(15):7-13.
[3] Nardou R,Ferrari D C,Ben-Ari Y.Mechanisms and effects of seizures in the immature brain[J].Semin Fetal Neonatal Med,2013,18(4):175-184.
[4] Armangue T,Leypoldt F,Málaga I,et al.Herpes simplex virus encephalitis is a trigger of brain autoimmunity[J].Ann Neurol,2014,75(3):317-320.
[5] Sayin U,Hutchinson E,Meyerand M E,et al.Age-dependent long-term structural and functional effects of early-life seizures:Evidence for a hippocampal critical period influencing plasticity in adulthood[J].Neuroscience,2015,288(12):120-134.
[6] Grabrucker S,Jannetti L,Eckert M,et al.Zinc deficiency dysregulates the synaptic ProSAP/Shank scaffold and might contribute to autism spectrum disorders[J].Brain,2014,137(Pt1):137-152.
[7] Suzuki H,Kitada M,Ueno S,et al.Anti-N-methyl-D-aspartate receptor encephalitis preceded by dura materlesions[J].Neurol Sci,2013,34(6):1021-1023.
[8] Ni H,Ren S Y,Zhang L L,et al.Expression profiles of hippocampal regenerative sprouting-related genes and their regulation by E-64d in a developmental rat model of penicillin-induced recurrent epilepticus[J].Toxicol Lett 2013,217(12):162-169.
[9] Tian T,Ni H,Sun B L.Neurobehavioral deficits in a rat model of recurrent neonatal seizures are prevented by a ketogenic diet and correlate with hippocampal Zinc/Lipid transporter signals[J].Biol Trace Elem Res,2015,167(2):251-258.
[10] Scholl E A,Dudek F E,Ekstrand J J.Neuronal degeneration is observed in multiple regions outside the hippocampus after lithium pilocarpine-induced status epilepticus in the immature rat[J].Neuroscience,2013,252(11):45-59.
[11] Faylon P,Koltes D,Spurlock M.Regulation of lipid droplet-associated proteins following growth hormone administration and feed restriction in lactating Holstein cows[J].J Dairy Sci,2014,97(5):2847-2855.
[12] Zhao Y,Pan R,Li S.Chelating intracellularly accumulated Zinc decreased ischemie brain injury through reducing neuronal apoptotic death[J].Stroke,2014,45(4):1139-1147.
[13] Faylon M P,Koltes D E,Spurlock D M.Regulation of lipid droplet-associated proteins following growth hormone admin- istration and feed restriction in lactating Holstein cows[J].J Dairy Sci,2014,97(5):2847-2855.
[14] Mann A P,Grebenciucova E,Lukas R V.Anti-N-methyl-D-aspartate-receptor encephalitis:diagnosis,optimal management,and challenges[J].Ther Clin Risk Manag,2014,10(3):517-525.
[15] Ni H,Ren S Y,Zhang L L,et al.Expression profiles of hippocampal regenerative sprouting-related genes and their regulation by E-64d in a developmental rat model of penicillin-induced recurrent epilepticus[J].Toxicol Lett,2013,217(12):162-169.
[16] Henshall D C,Engel T.Contribution of apoptosis-associated signaling pathways to epileptogenesis:lessons from Bcl-2 family knockouts[J].Front Cell Neurosci,2013,7(3):110-112.
[17] Strauss U,Br?uer A U.Current views on regulation and function of plasticity-related genes(PRGs/LPPRs)in the brain[J].Biochim Biophys Acta,2013,1831(1):133-138.
[18] Blanco-Alvarez V M,Lopez-Moreno P,Soto-Rodriguez G,et al.
Subacute zinc administration and L-NAME caused an increase of NO,zinc,lipoperoxidation,and caspase-3 during a cerebral hypoxia-ischemia process in the rat[J].Oxid Med Cell Longev,2013,2013:240560.
[19] Vander Weele C M,Saenz C,Yao J,et al.Restoration of hippocampal growth hormone reverses stress-induced hippocampal impairment[J].Front Behav Neurosci,2013,25(7):66-69.
[20] Henshall D C,Engel T.Contribution of apoptosis-associated signaling pathways to epileptogenesis:Lessons from Bcl-2 family knockouts[J].Front Cell Neurosci,2013,7(11):110.
(收稿日期:2018-08-13) (本文編輯:董悅)

