重組人白介素35質粒的構建及鑒定
顧香 陳吉泉 李兵

【摘要】 目的:通過分子生物學技術構建重組人白介素35(IL-35)質粒,為進一步研究人IL-35的生物學功能奠定基礎。方法:用KG-1細胞(人白血病細胞)擴增p35和EBI3的cDNA,將兩者先后連接至pSectag2A質粒中,最后把Linker連接至pSectag2A-p35-EBI3中,構建成pSectag2A-IL-35質粒。結果:經(jīng)測序等方法鑒定重組質粒中p35和EBI3序列與Genbank中(p35 NM-000882和EBI3 NM-005725)公布的序列一致。結論:成功構建pSectag2A-IL-35真核表達載體。
【關鍵詞】 重組; PCR; IL-35; 質粒
doi:10.14033/j.cnki.cfmr.2019.17.078 文獻標識碼 B 文章編號 1674-6805(2019)17-0-03
【Abstract】 Objective:To construct recombinant human IL-35 expression vector by molecular biology technique,which could lay a foundation for further study of the biological function of IL-35.Method:EBI3 and p35 were amplified by PCR from the cDNA library derived from the KG-1 cells.And they were cloned into pSectag2A vector.Finally Linker was cloned into pSectag2A-EBI3-p35,and pSectag2A-IL-35 plasmid was successfully reconstructed.Result:The pSectag2A-IL-35 vector was verified by DNA sequencing,whose sequencing were consistent with those published in Genbank(EBI3 nm-005725,p35 nm-000882).Conclusion:Psectag2a-IL-35 eukaryotic expression vector is successfully constructed.
【Key words】 Recombinant; PCR; IL-35; Plasmid
First-authors address:Shanghai Changzheng Hospital,Second Military Medical University,Shanghai 200003,China
IL-35是白介素12家族的一員,1997年Devergne等[1]報道了IL-35是由白介素12的p35亞基(IL-12 p35,即p35)和EB病毒誘導基因3(EBI3)構成。p35及EBI3基因編碼分子量分別為35、34 kD的糖蛋白[2]。2007年Collison等[3]經(jīng)小鼠體內實驗初步證實,調節(jié)性T細胞(Treg細胞)可高表達EBI3和p35,且兩者的二聚體能加強Tregs的免疫抑制功效。2007第13屆免疫學國際會議上,由Vignali首次提議該二聚體命名為IL-35,最后成功獲批。自此,IL-35就成為免疫學、分子生物學等領域研究的熱點。本實驗擬構建人IL-35質粒,為深入研究IL-35的生物學作用及其機制奠定基礎。
1 材料與方法
1.1 材料
1.1.1 細胞株和質粒 人白血病細胞株KG-1由華東理工大學代同成博士惠贈,pSectag2A載體由英國格拉斯哥大學Wei Xiaoqing教授惠贈。
1.1.2 主要試劑 限制性內切酶HindⅢ、EcoRⅠ、NotⅠ、XhoⅠ,DL2000 Marker、T4DNA連接酶、質粒抽提試劑盒(北京全式金生物技術有限公司)、T載體(TAKARA)、DNA膠回收試劑盒、RNA提取試劑。
1.1.3 培養(yǎng)基 DMEM高糖培養(yǎng)基購自GIBICO公司,Hyclone胎牛血清。
1.2 方法
1.2.1 p35和EBI3 cDNA的克隆 按照p35和EBI3在NCBI的GenBank中的cDNA序列,利用Primer Premier 5軟件設計引物。依照pSectag2A質粒圖譜,篩選酶切位點。在EBI3上游引物的5端加上4個保護堿基并引入HindⅢ酶切位點:AAAGAAGCTTTGCCCGCCCTGCAGTGGA,EBI3下游引物的5端加上5個保護堿基并引入EcoRⅠ及NotⅠ酶切位點:ATTAAGAATTCGCGGCCGCGCCCAGGCTCATTGTGG;在p35上游引物的5端加上10個保護堿基并引入NotⅠ酶切位點:ATATTAGAATGCGGCCGCAACCTCCCCGTGGCCAC,p35下游引物的5端加上4個保護堿基并引入XhoⅠ酶切位點:GGCCCTCGAGGGAAGCATTCAGATAGCTCAT;Linker引物均引入NotⅠ酶切位點,HLS:GGCCGCGGTGGTGGTGGTTCTGGTGGTGGTGGTTCTGGTGGTGGTGGTTCTGC,HLA:GGCCGCAGAACCACCACCACCAGAACCACCACCACCAGAACCACCACCACCGC。引物由上海生工生物工程公司合成。
1.2.2 KG-1細胞RNA的提取及PCR擴增目的片段 用PBS沖洗細胞2遍,按每106個細胞加入1 ml的Trizol,將細胞輕輕沖洗下來,收集至1.5 ml離心管中,隨后加入200 μl氯仿,經(jīng)過劇烈震蕩,4 ℃,13 000 r/min離心15 min,可分3層,上層為RNA水相,將其吸出并加入500 μl異丙醇,冰上靜置10 min,4 ℃,12 000 r/min離心15 min,棄上清,加入1 ml預冷的用DEPC水配制的75%乙醇,混勻后4 ℃,12 000 r/min離心5 min,棄上清,加入30 μl的焦碳酸二乙酯水溶解。
把上述RNA逆轉錄合成cDNA文庫,逆轉錄-聚合酶鏈反應的反應體系:5×PrimeScript RT Master Mix 2 μl,Total RNA 7 μl,RNase Free 1 μl;反應參數(shù):37 ℃ 30 min;85 ℃ 5 s,4 ℃ 10 min。
以上述引物為引物,將逆轉錄獲得的cDNA為模板,擴增目的基因。PCR反應參數(shù):94 ℃ 3 min;94 ℃ 30 s,55℃ 30 s,72 ℃ 45 s,30個循環(huán);72 ℃ 5 min。擴增產(chǎn)物EBI3、p35去掉信號肽序列、起始及終止密碼子,大小為642 bp及591 bp。
1.2.3 IL-35-pSectag2A重組真核表達載體的構建 PCR產(chǎn)物經(jīng)1%瓊脂糖凝膠電泳,凝膠成像系統(tǒng)觀察并照相回收目的片段。將膠回收的產(chǎn)物EBI3及p35連接到T載體上,轉化DH5α感受態(tài)細胞,挑取單克隆于3 ml LB培養(yǎng)基中,37 ℃,120 r/min培養(yǎng)過夜。提取質粒,對EBI3利用HindⅢ、EcoRⅠ進行雙酶切,用T4連接酶將酶切的目的片段和同樣酶切的pSectag2A載體片段分別進行黏性末端的連接,轉化培養(yǎng),提取質粒,經(jīng)PCR鑒定后測序。
測序正確后,將p35經(jīng)NotⅠ、XhoⅠ雙酶切,用T4連接酶將酶切的目的片段和同樣酶切的pSectag2A-EBI3載體片段進行連接,轉化培養(yǎng),抽提質粒,經(jīng)PCR鑒定后測序。
若測序正確,以退火反應獲得Linker。退火體系:LinkerS:5 μl,LinkerA:5 μl,Buffer:10 μl,ddH2O:80 μl。退火參數(shù):90 ℃ 5 min,37 ℃ 1 h。在退火產(chǎn)物中加入100 μl ddH2O,并加入600 μl無水乙醇,混勻后放入-20 ℃冰箱過夜,12 000 r/min,離心5 min,棄上清,待酒精揮發(fā)完后加入20 μl ddH2O,混勻后與經(jīng)NotⅠ單酶切的pSectag2A-EBI3-p35載體連接,轉化培養(yǎng),抽提質粒,經(jīng)PCR鑒定后測序。
2 結果
2.1 p35和EBI3基因的克隆
通過逆轉錄-聚合酶鏈反應擴增獲得p35、EBI3基因片段,RT-PCR產(chǎn)物在1%瓊脂糖凝膠電泳后可見大小約為591 bp及642 bp的條帶,所獲條帶與預期大小相符(圖1),可將其連接至pUCm-T載體。
2.2 pUCm-T-EBI3、pUCm-T-p35的酶切產(chǎn)物
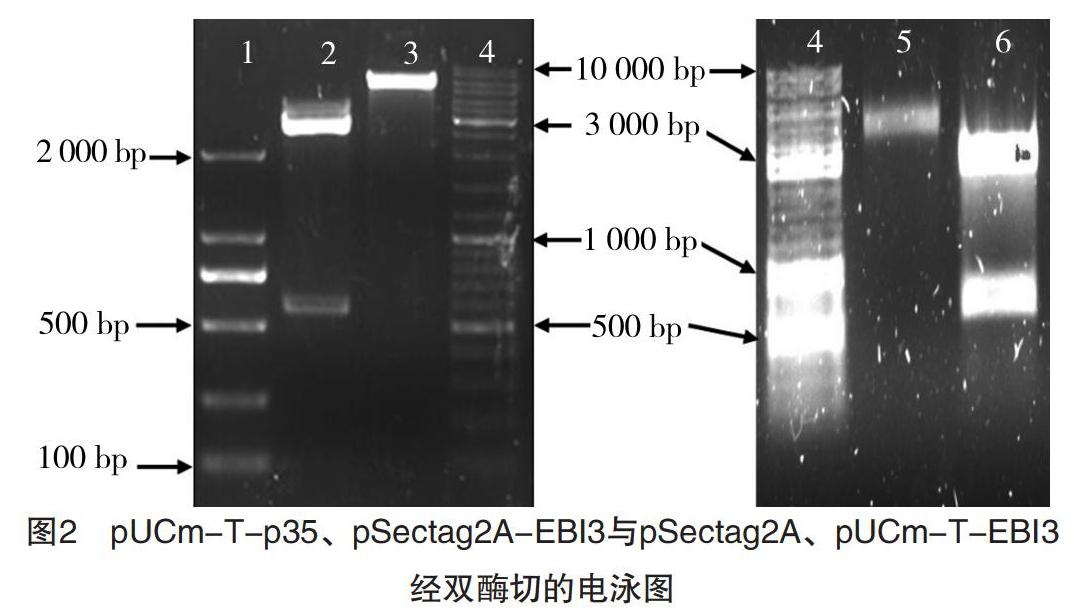
RT-PCR產(chǎn)物EBI3與pUCm-T連接,同時與pSectag2A經(jīng)HindⅢ、EcoRⅠ雙酶切;p35與pUCm-T連接,并與pSectag2A-BBI3經(jīng)NotⅠ、XhoⅠ雙酶切。上述酶切產(chǎn)物經(jīng)1%瓊脂糖凝膠電泳,結果見圖2。圖2中1泳道為DL 2000 DNA Marker,2泳道顯示大小兩條帶,其中小片段大小與預期大小相符(591 bp);3泳道所顯示條帶的大小與預期大小相符(5 707 bp);4泳道為10 000 bp DNA Marker,5泳道顯示一條帶,其大小與理論值(6 349 bp)一致,6泳道顯示大小兩條帶,其中小片段大小與預期大小相符(642 bp),最后將目的片段p35和EBI3切膠回收,分別與pSectag2A及pSectag2A-EBI3連接。
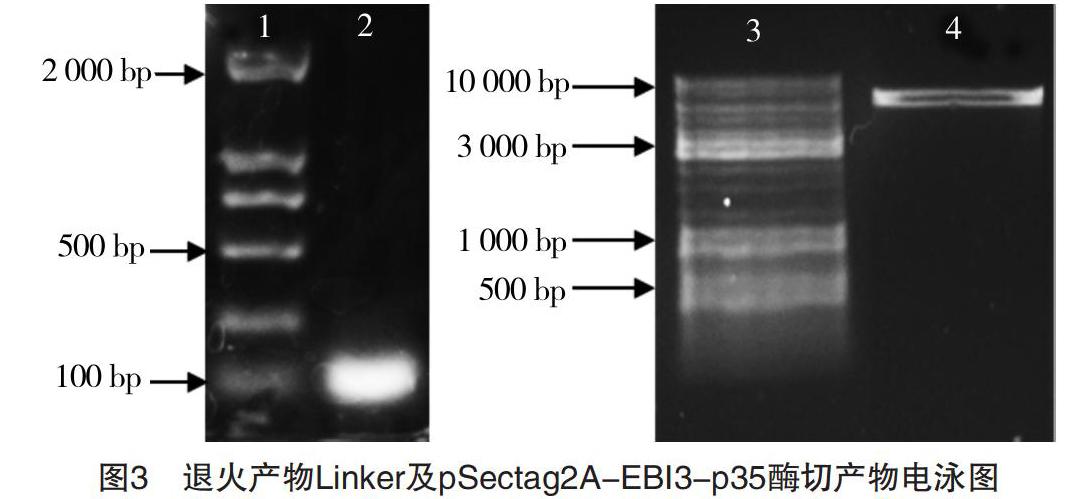
退火獲得Linker產(chǎn)物,經(jīng)1%瓊脂糖凝膠電泳,結果見圖3。圖3中2泳道顯示一條帶,大小與理論值(51 bp)相符,未見其他非特異性條帶。
EBI3及p35片段先后連接至pSectag2A構成重組質粒pSectag2A-EBI3-p35,經(jīng)過NotⅠ單酶切的產(chǎn)物,隨后經(jīng)1%瓊脂糖凝膠電泳,結果如圖3所示。圖3中4泳道顯示的條帶為線性化的pSectag2A-EBI3-p35載體,大小與理論值(6 349 bp)相符,切膠回收目的條帶,最后與Linker連接。
2.3 重組IL-35-pSectag2A真核表達載體的鑒定。
以HES、HEA為引物PCR鑒定重組載體pSectag2A-EBI3,結果示圖4中2、4、5泳道顯示一條帶,大小與理論值(642 bp)一致,表明pSectag2A與目的片段EBI3連接成功。用測序引物T7/BGH對pSectag2A質粒進行雙向測序,測序結果與NCBI中GenBank上的序列(p35 NM-000882,EBI3 NM-005725)完全一致。
3 討論
1997年,EBI3-p35由Devergne首次發(fā)現(xiàn)[1],在2007年正式被命名為IL-35,后者是IL-12家族的一員,屬于I型細胞因子超家族成員,由α鏈p35和β鏈EBI3組成[4-5]。IL-35主要由Treg、調節(jié)性B細胞(Breg)細胞分泌[3]。在Treg表面,IL-35的信號通路由信號傳導及轉錄激活因(STAT)STAT1-STAT4,STAT4-STAT4,STAT1-STAT1介導[6];而在Breg表面,則由STAT1-STAT3介導[7]。
研究發(fā)現(xiàn),IL-35是具有重要免疫調節(jié)功能的細胞因子[8],通過增強Treg細胞的功能,抑制Th17細胞的增殖分化,發(fā)揮免疫抑制功能,抑制炎癥反應、防止過度的自身免疫反應的發(fā)生[9]。由此可見,IL-35在諸多疾病中,均具有不容小覷的作用。本實驗成功構建了pSectag2A-IL-35真核表達載體,為體內外進一步研究IL-35的功能和作用機制奠定了基礎。
參考文獻
[1] Devergne O,Birkenbach M,Kieff E.Epstein-Barr virus-induced gene 3 and the p35 subunit of interleukin 12 form a novel heterodimeric hematopoietin[J].Proc Natl Acad Sci USA,1997,94(22):12041-12046.
[2]石銀月,武桂萍,顏學兵.IL-12細胞因子家族的新成員—IL-35[J/OL].中華實驗和臨床感染病雜志:電子版,2012,2(6):159-161.
[3] Collison L W,Workman C J,Kuo T T,et al.The inhibitory cytokine IL-35 contributes to regulatory T-cell function[J].Nature,2007,450(7169):566-569.
[4]王志會.IL-35在免疫相關疾病中的研究進展[J].華中科技大學學報:醫(yī)學版,2015,2(44):239-242.
[5]黃崇標,田野,崔焱,等.白細胞介素35的在腫瘤發(fā)展中的作用[J].中國肺癌雜志,2016,19(4):230-235.
[6]陳爽,鞠曉紅,鄭文彧,等.IL-35與人類疾病關系的研究進展[J].免疫學雜志,2014,7(30):645-649.
[7]蔣瑜,張松照.細胞因子IL-35研究進展[J].國際檢驗醫(yī)學雜志,2017,12(38):1639-1641.
[8]姚國泰,陳勵.IL-35與人類自身免疫性疾病的關系[J].細胞與分子免疫學雜志,2016,32(7):993-999.
[9]韓麗,李培,武伏旭.IL-35在腫瘤中的研究進展[J].免疫學雜志,2018,10(34):906-911.
(收稿日期:2019-01-08) (本文編輯:何玉勤)

