一株拮抗茶炭疽病菌的木霉菌的分離、篩選及鑒定
趙興麗,張金峰,周玉鋒*,趙玳琳,張莉,周羅娜,陶剛*
一株拮抗茶炭疽病菌的木霉菌的分離、篩選及鑒定
趙興麗1,張金峰2,周玉鋒1*,趙玳琳3,張莉4,周羅娜1,陶剛3*
1. 貴州省農業科學院農業生物技術重點實驗室,貴州 貴陽 550006;2. 貴州省農業科學院茶葉研究所,貴州 貴陽 550006;3. 貴州省農業科學院植物保護研究所,貴州 貴陽 550006;4. 貴州省農業科學院草業研究所,貴州 貴陽 550006
為獲得對茶炭疽病有生物防治效果的拮抗木霉菌,本文采用梯度稀釋法從茶樹根際土壤中分離獲得23株木霉菌,并通過平板對峙法和抑菌圈法從中篩選出1株強拮抗茶炭疽病菌的木霉菌株LS17110205。該菌株對茶炭疽病菌抑菌率達76.96%,并能在茶炭疽病菌菌落上產生大量白色菌絲及綠色分生孢子,使茶炭疽病菌菌落萎縮,顏色變暗;其發酵液也能有效抑制茶炭疽病菌菌絲生長,抑制率達70.08%。掃描電鏡觀察發現,菌株LS17110205發酵液能使茶炭疽菌菌絲表面皺縮。基于形態學特征結合分子系統發育樹分析,將菌株LS17110205鑒定為。該研究結果為茶炭疽病的生物防治提供一定的理論基礎。
根際土壤;抑菌率;茶炭疽病;鑒定;木霉菌
茶炭疽病是茶樹主要病害之一,全國各地茶園均有發生,特別是在我國西南和華南茶區。該病主要由炭疽菌(s spp.)引起,病菌通常從嫩葉的背部侵入,然后萌發形成芽管侵入葉片組織[1],在茶樹成葉上顯癥,并影響茶樹的生理代謝,使茶樹出現大量落葉,嚴重時會導致植株枯死,直接影響茶樹產量和茶葉品質[2-3]。目前,茶炭疽病的防治主要是以化學藥劑為主,但過量使用藥劑會引起農藥殘留和病原抗藥性等問題。茶葉是一種直飲品,其安全性與我們的身體健康密切相關。由于人們對環境保護和食品安全問題的重視,傳統化學防治方法所帶來的弊端變得更加突出。
目前,以木霉菌(spp.)等生防微生物為主要成分的生防菌劑已經成為部分化學農藥和化學肥料替代品和減量品[4-6]。木霉菌分布廣泛[7],存在于土壤、根圍、葉片、種子和球莖等生態環境中[8],營腐生生活。國內外相關文獻報道顯示,木霉菌對包括茶樹病害在內的多種植物病害具有防治效果[9-11],同時能夠促進植物生長[12]。研究表明,在修剪后的茶樹切口上施用木霉菌(和)制劑,可以有效抑制茶根腐病和茶枝梢黑點病的發生[13]。Onsando等[14]1994年的研究中發現、和對茶樹根腐菌(spp.)具有較強的抑制作用;若在接種輪斑病菌前接種木霉菌,能顯著抑制輪斑病菌(spp.)的侵染[15]。本研究通過收集茶樹根際木霉菌資源,篩選拮抗木霉菌,并評價了菌株LS17110205對茶炭疽病菌的抑制效果,為茶樹炭疽病的生物防治提供資源和理論依據。
1 材料與方法
1.1 試驗材料
1.1.1 供試菌株
茶炭疽病菌()為本實驗室分離保存。茶炭疽病病樣采自貴州省松桃縣正大鎮茶園,通過單孢分離技術獲得純化菌株,基于ITS序列和形態學特征將其鑒定為。
1.1.2 供試培養基
PDA培養基:土豆200?g、瓊脂粉15~20?g、葡萄糖20?g、蒸餾水1?000?mL;PDB液體培養基:土豆200?g、葡萄糖20?g、蒸餾水1?000?mL;虎紅酸鈉培養基:土豆200?g、瓊脂粉15~20?g、葡萄糖20?g、氯霉素0.3?g、虎紅鈉鹽0.02?g、蒸餾水1?000?mL;丙酸鈉培養基:土豆200?g、瓊脂粉15~20?g、葡萄糖20?g、慶大霉素0.05?g、丙酸鈉0.05?g、蒸餾水1?000?mL。
1.1.3 供試試劑及主要儀器
Ezup柱式真菌基因組DNA抽提試劑盒(上海生工生物工程股份有限公司),2×PCRMaster Mix酶[天根生化科技(北京)有限公司]。S-3400N掃描電子顯微鏡(日本日立公司)。
1.2 茶樹根際木霉菌分離與篩選
1.2.1 梯度稀釋法分離菌株
利用五點法從貴州省雷山縣銀球茶主產區采集茶樹根際土。室溫風干,混勻。稱取10?g土樣倒入裝有90?mL滅菌蒸餾水的三角瓶中,150?r·min-1振蕩30?min,使土樣中的微生物充分混勻,得到10-1濃度的土壤懸液。在超凈工作臺中將10-1濃度的土壤懸液用滅菌蒸餾水逐一稀釋成10-2、10-3和10-4的不同濃度。靜置30?s,用移液槍分別取濃度為10-3和10-4的土壤懸液上清液100?μL滴于PDA平板上,用滅菌的涂布棒涂勻,28℃黑暗倒置培養至有菌落形成,取菌餅轉接到新的PDA培養基上進行純化,重復2次,采用硫酸紙袋進行–20℃低溫冷凍保存。
1.2.2 平板對峙法初篩
用打孔器分別取茶炭疽病菌()與待測木霉菌菌餅,直徑為5?mm,將兩菌餅接于同一PDA平板上,相距5.5?cm,每組5個重復,以單接茶炭疽病菌為對照,置于28℃培養,7?d后測量茶炭疽病菌朝向木霉菌的菌落半徑,計算木霉菌的抑制率。同時統計木霉菌對茶炭疽病菌的覆蓋率。通過對峙培養挑選對茶炭疽病菌的抑制率大于或等于70%且覆蓋率為Ⅲ級的木霉菌株進行復篩。覆蓋率分級標準參考陳書華等[16]的研究。
1.2.3 抑菌圈法復篩
無菌條件下取6個直徑為5?mm的木霉菌菌餅接入PDB培養基中,28℃、200?r·min-1培養4?d,7?830?r·min-1、常溫離心10?min,取上清液通過0.22?μm濾膜。按木霉菌發酵液∶PDA=1∶9的比例將木霉菌發酵液加入到PDA培養基中,混勻倒平板,取茶炭疽病菌菌餅接種于平板中央。25℃培養5?d,十字交叉法測量茶炭疽病菌菌落半徑,計算其抑菌效果。
1.2.4 掃描電鏡觀察
利用掃描電鏡觀察木霉菌發酵液對茶炭疽病菌菌絲的影響,具體操作如下:
(1)樣品前處理:打孔器取大小為5?mm×5?mm的茶炭疽病菌菌餅,放到2.5%戊二醛中,菌餅需完全淹沒,放入4℃冰箱中過夜,進行固定;用0.1?mmol·L-1磷酸緩沖(PBS)洗滌3次,每次10~15?min;之后用濃度為55%、65%、75%、85%、95%以及100%叔丁醇對茶炭疽病菌菌餅進行梯度脫水,每個濃度約10~15?min,放入冷凍干燥儀,抽真空,進行冷凍干燥。
(2)鍍金處理:利用導電膠把干燥后的菌餅粘于電鏡樣品放置的底座上,體視鏡下用鑷子將菌餅完全固定,洗耳球去除表面碎屑后,進行鍍金處理。
1.3 菌株LS17110205的鑒定
1.3.1 形態特征觀察
菌株LS17110205培養5?d后,挑取PDA平板上的菌落,制水玻片顯微觀察該木霉菌的形態特征并拍照。
1.3.2 基因組DNA提取、序列測定及系統發育樹的構建
菌株LS17110205培養5?d后,用滅菌手術刀刮取菌絲及孢子,參照Ezup柱式真菌基因組DNA抽提試劑盒說明書提取菌株LS17110205的基因組DNA,采用引物:ITS1/ITS4(5′-TCCGTAGGTGAACCTGCGG- 3′/5′-TCCTCCGCTTATTGATATGC-3′)[17]進行PCR擴增。PCR反應體系(25?μL):2×Master Mix 12.5?μL,DNA模板1?μL,引物各1?μL,ddH2O 9.5?μL,滅菌超純水作為對照。PCR擴增程序分別為:94℃預變性5?min;94℃變性30?s,56℃退火30?s,72℃延伸1?min,35個循環;72℃延伸10?min。通過1%瓊脂糖凝膠電泳檢測PCR產物條帶亮度后,委托上海生工公司進行序列測定,并將所測rDNA-ITS序列通過NCBI上的BLAST軟件(https://blast.ncbi.nlm.nih.gov/Blast.cgi)進行同源性比較。BioEdit軟件對測序序列和下載自NCBI-Gen Bank的序列進行多位點序列比對,并對其進行手動校正,校正后的序列采用MEGA 5.1軟件將各基因序列按ITS→TEF的順序首尾相連,保存為fast格式,再利用格式轉換網站(http://www.sing-group.org/ALTER)將其轉化為phy格式,并通過最大似然法分析構建最大似然樹(Maximum likehood phylogenetic tree)[18]。
1.4 數據分析
數據采用Excel 2007和DPS 7.05軟件進行方差分析,并通過LSD法比較各處理間的差異顯著性(<0.05)。
2 結果與分析
2.1 茶樹根際木霉菌分離及拮抗木霉菌的篩選
采用土壤梯度稀釋涂布法從茶樹根際土壤中分離純化得到23株木霉菌。對峙培養初篩表明,23株木霉菌對茶炭疽病菌都有抑制作用(圖1),其中有9株木霉菌對茶炭疽病菌的抑菌率大于70%且覆蓋率為Ⅲ級(表1)。抑菌圈法復篩結果顯示,茶炭疽病菌在含木霉菌發酵液的PDA平板上不能形成明顯的抑菌圈。通過對9株木霉菌復篩后,發現其中4株木霉菌對茶炭疽病菌有抑制作用(表2)。
經初篩和復篩后,23株木霉菌中對茶炭疽病菌抑制效果最佳的為菌株LS17110205。結合表1和表2,菌株LS17110205對茶炭疽病菌的生長抑制率為76.96%,對峙培養5?d后該木霉菌菌絲覆蓋茶炭疽病菌菌落的3/4以上,并在茶炭疽病菌菌落上產生大量白色菌絲,茶炭疽病菌菌落萎縮,顏色變暗(覆蓋率為Ⅲ級)(圖1),其發酵液對茶炭疽病菌具有較強的抑制效果,抑制率達70.08%。掃描電鏡顯微觀察表明,與對照相比,菌株LS17110205的發酵液能使茶炭疽菌菌絲失水,表面呈褶皺狀(圖2)。
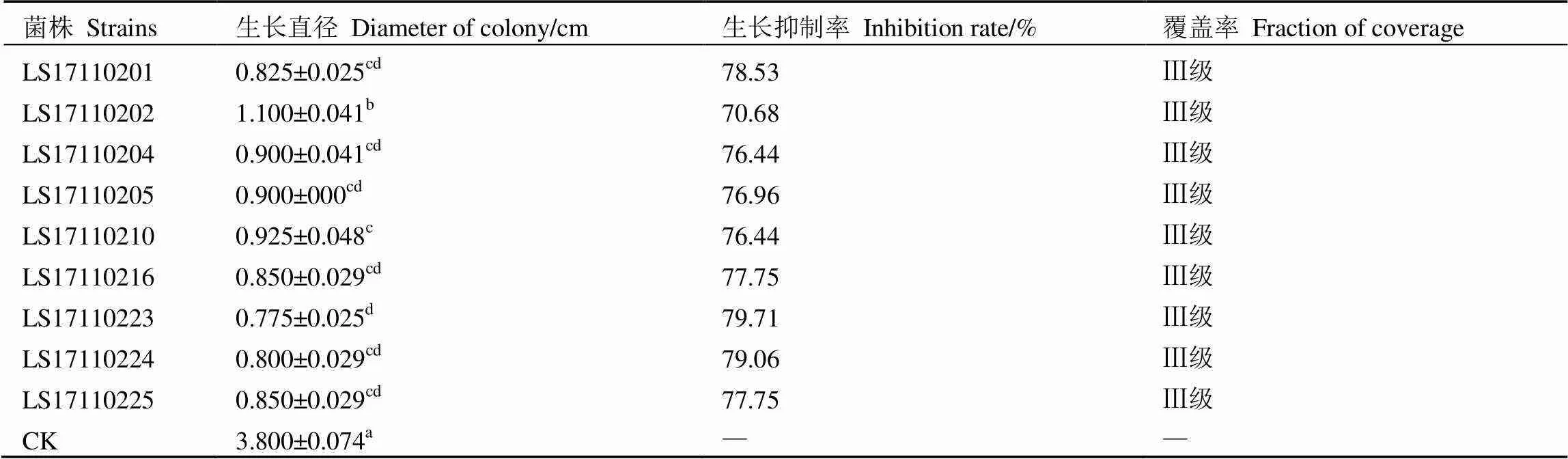
表1 拮抗木霉菌對茶炭疽病菌的抑制作用
注:表中數據為平均值±標準差,同列數據后不同小寫字母表示差異顯著(0.05)。下同
Note: The data are mean±SD. Lowercase letters in the same column mean significant difference (0.05). The same below

表2 木霉菌株發酵液對茶炭疽菌的抑制作用

圖2 木霉菌株發酵液對茶炭疽菌菌絲的影響
2.2 木霉菌株LS17110205的種類鑒定
2.2.1 培養特性及形態學特征描述
在PDA培養基上培養5?d后,菌株LS17110205平板正面形成綠色菌落,平板背面呈現為綠色,無色素和特殊氣味產生,菌落日均生長速度約為3.8?cm·d-1,有大量氣生菌絲產生,有同心輪紋,菌落絨毛狀至氈狀,平板邊緣形成綠色產孢區。分生孢子簇棉絮狀,有單個分生孢子梗分枝,直徑約為6.99?μm;分生孢子梗上的瓶梗呈對稱分布,安瓿形,直徑約為5.19?μm;分生孢子球形至亞球形或不規則性,光滑、淡綠色,大小為(4.67~5.97)?μm ×(5.03~8.56)?μm(圖3)。根據菌株LS17110205的培養特性和形態學特征,初步確定其分類地位為[19-22]。
2.2.2 序列測定及多基因系統發育學分析
木霉菌株LS17110205的rDNA-ITS基因序列GenBank數據庫登錄號為MK421515。測序結果經BLAST同源性比對的結果與下載至GenBank的部分木霉菌的ITS及TEF序列(表3)進行分子系統發育學分析,選擇作為外群,構建木霉菌的分子系統發育樹,結果表明菌株LS17110205和聚為同一分支(圖4),且具有較高的支持率,結合菌株LS17110205的形態學特征[23-25],將該菌株鑒定為。
3 討論
茶炭疽病的發生與流行受氣候、管理和品種抗性等因素的影響,高溫高濕的環境適宜茶炭疽菌的生長與繁殖。研究表明,茶炭疽菌分生孢子可以附著在葉表面存活5個月左右[26],茶炭疽菌分生孢子在土壤及植物組織中的長期存活會使得茶炭疽病連年發生和擴散,給茶農造成重大的經濟損失。目前,對茶炭疽病的防治主要采用化學殺菌劑,但化學農藥的過量和不合理的使用會造成農藥殘留等問題,直接影響人們的身體健康和生活環境,解決這個問題關鍵是生物防治等綠色防控技術的應用。
利用生防菌研制的生防制劑來防治茶樹炭疽病是一種綠色、安全、有效的途徑。國內外已報道的生防菌很多,主要包括放線菌[27]、枯草芽孢桿菌[28]以及木霉菌[29]等。近年研究表明,木霉菌是一種重要的生防真菌,其生防機制主要包括:競爭營養和定殖位點、抗生作用、重寄生作用及誘導植物抗性等作用[30]。如馮俊清[31]等用還原糖法測定了鉤狀木霉()不同發酵時間幾丁質酶活力的變化,結果表明,幾丁質酶活性在45?h達到最大,用電子顯微鏡觀察發現不同發酵時間的木霉菌都能降解和破壞辣椒白絹病致病菌的菌絲,并推斷木霉菌生防作用的重要機制是產生了幾丁質酶。而Hanhong等[32]研究發現木霉菌可誘導植株產生防御體系從而延緩辣椒疫病()發生。隨著研究深入,生防木霉菌正不斷被發現,如姬承東等[33]通過分離和篩選獲得2株強拮抗木霉菌:加納木霉()GCPL175和木霉菌株GCPL12,它們的發酵液的無菌濾液對環柄菇屬菌(spp.)1506的抑菌率分別達61.23%和73.13%;且其防控方法也在不斷改進,如劉明鑫等[34]通過變換立枯絲核菌()和棘孢木霉菌()437的施用順序發現,木霉菌和病原菌在同時施用時對枯萎病的防效最高。為了使木霉菌能夠有效的應用到茶樹病害綠色防控上,本研究立足茶園生境,將來自茶樹根際土壤中的木霉菌資源,通過初篩和復篩從中篩選獲得具有生防潛能的木霉菌株LS17110205,該菌株對茶炭疽病菌具有顯著的抑制作用,具有較強的開發潛能;此外還發現該木霉菌株的發酵液能夠使茶炭疽病菌菌絲失水皺縮,具體原因有待下一步研究。
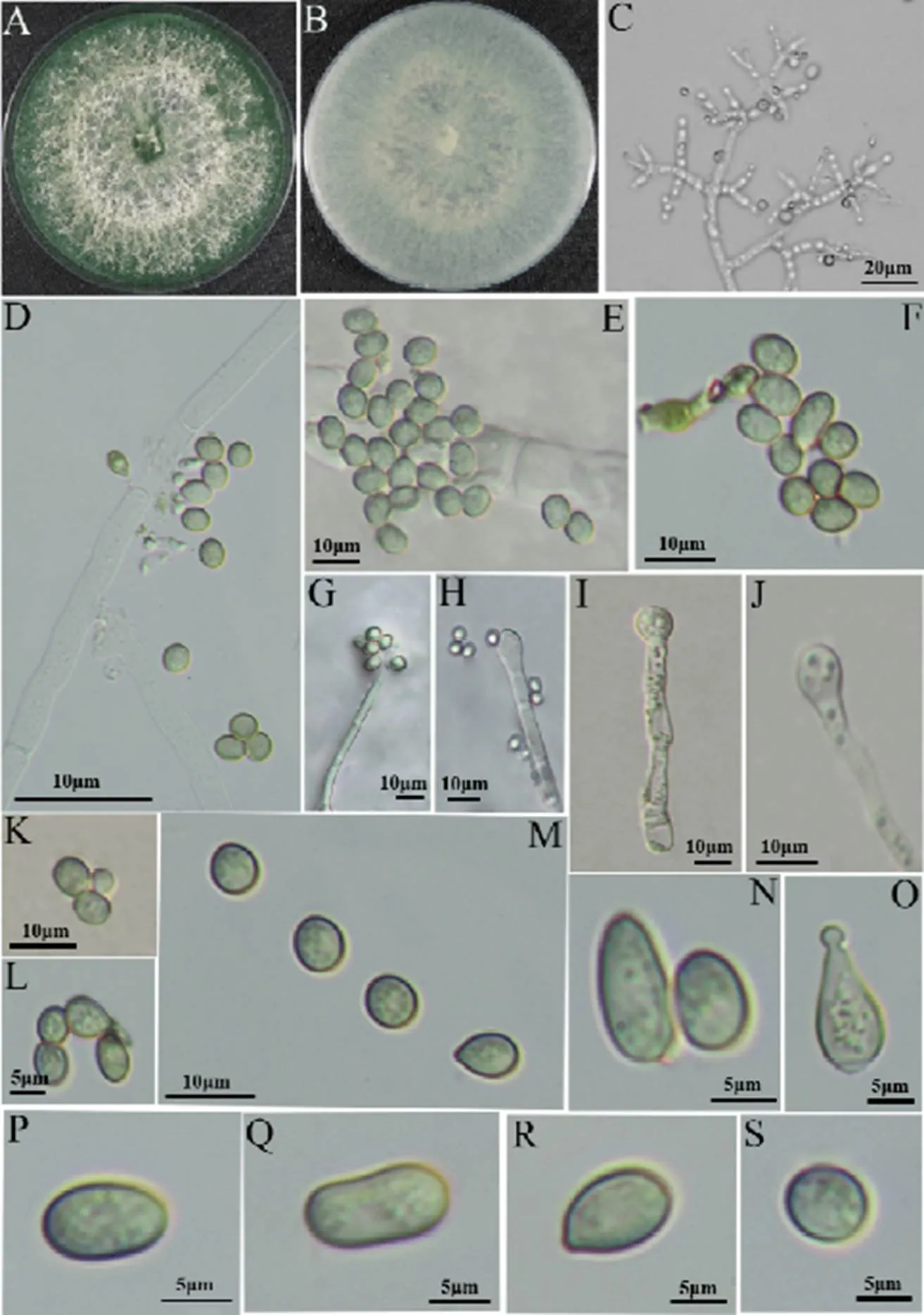
注:A、B菌落正反面;C、H—J分生孢子梗;D、E菌絲周圍聚集大量分生孢子;F、G分生孢子簇;K、L分生孢子上的附著胞;M—S分生孢子
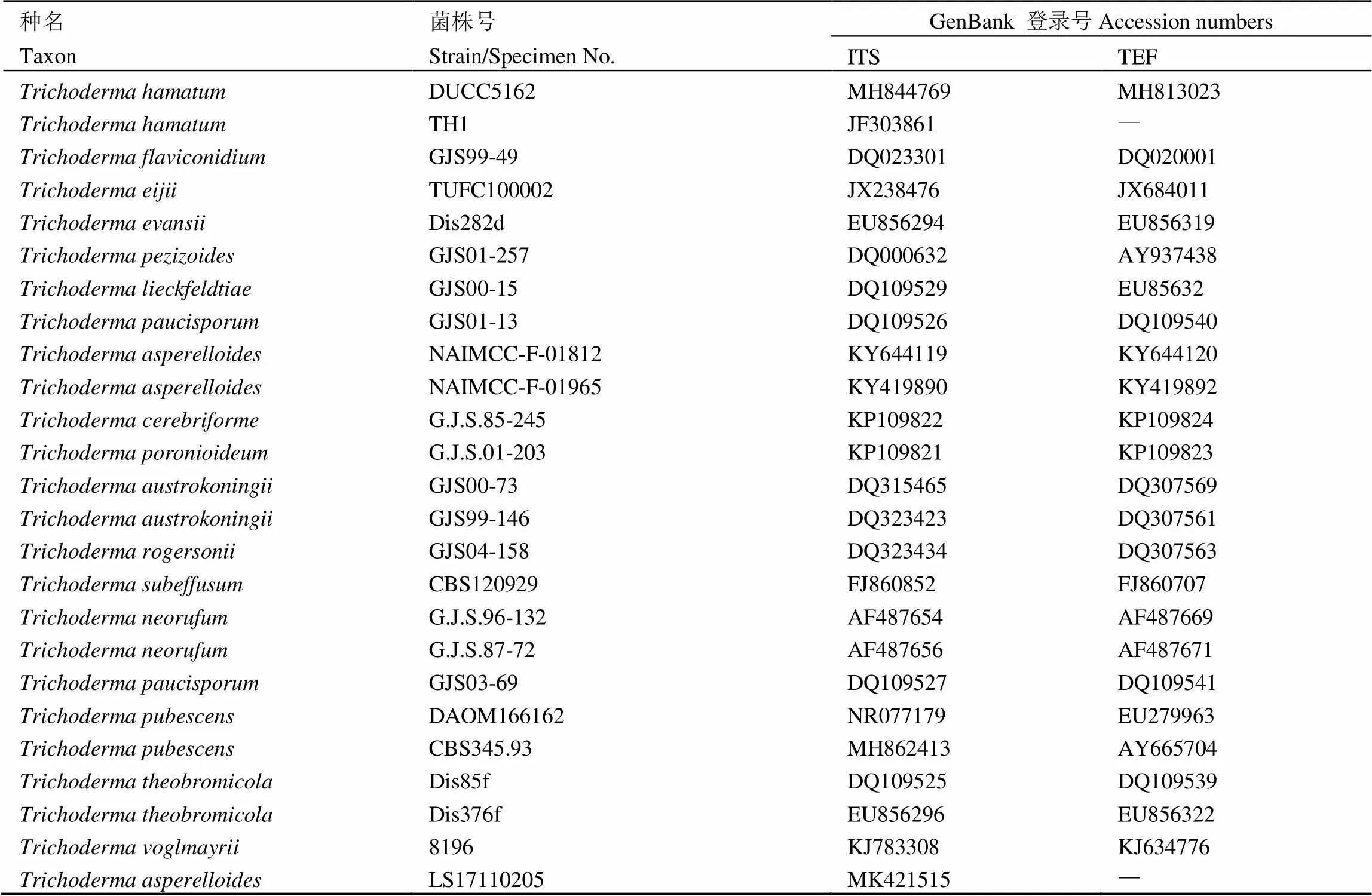
表3 用于系統發育分析的真菌的種名、菌株號及GenBank登錄號
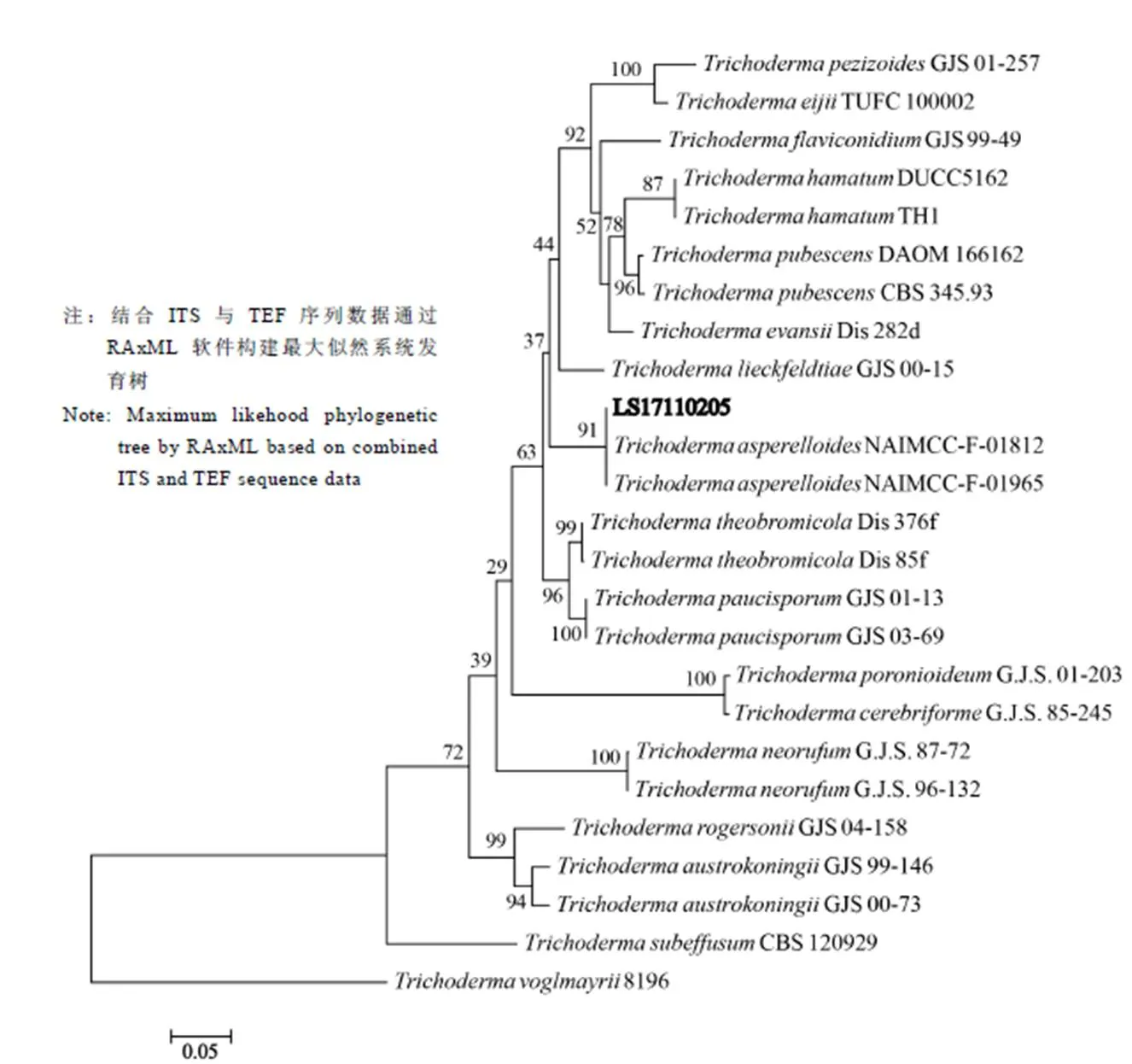
圖4 菌株LS17110205與相關種的系統發育樹
近幾年,隨著生物技術的發展與應用,多基因系統進化分析在木霉菌分類研究中得到廣泛應用[35-36],木霉屬內組、種之間的關系發生了較大的變化[37-38]。為了明確生防木霉菌LS17110205的分類地位,研究結合形態學特征和多基因系統進化分析,將菌株LS17110205鑒定為。
研究結果為木霉菌株LS17110205拮抗茶炭疽病菌的機制研究和木霉菌菌劑的開發利用提供前提和重要的理論基礎。
致謝:本文在木霉菌分離方法技術方面得到中國農業科學院農業資源與農業區劃研究所顧金剛老師的幫助,特此感謝!
[1] 劉威, 袁丁, 尹鵬, 等. 茶樹炭疽病的研究進展[J]. 熱帶農業科學, 2016, 36(11): 20-26.
[2] 李楊, 李河, 周國英, 等. 海南省3種油茶炭疽病菌的致病力及其生物學特性研究[J]. 熱帶作物學報, 2016, 37(10): 1956-1961.
[3] 賴建東. 炭疽菌侵染后茶樹cDNA-AFLP體系構建和基因差異表達研究[D]. 福州: 福建農林大學, 2016.
[4] 臺蓮梅, 高俊峰, 左豫虎, 等. 長枝木霉菌T115D誘導大豆葉片防御酶活性及疫病盆栽防治效果[J]. 中國生物防治學報, 2018, 34(6): 897-905.
[5] Luigi L, Giuseppe C, Maria B M M, et al. Inoculation ofordifferentially modulates metabolite profiling of wheat root exudates [J]. Phytochemistry, 2019, 157: 158-167.
[6] Daliakopoulos I N, ApostolakisA K, Wagner A,et al. Effectiveness ofin soil and yield conservation of tomato crops under saline irrigation [J]. Catena, 2019, 175: 144-153.
[7] Braithwaite M, Johnston P R, Ball S L, et al.down under: species diversity and occurrence ofin New Zealand [J]. Australasian Plant Pathol, 2017, 46(1): 11-30.
[8] Cook R J, Baker K F. The nature and practice of biological control of plant pathogen [M]. Sao Paulo: American phytopathological society, 1983: 318.
[9] Ciro H S, Juliana F S D, Ana P C S, et al.antagonism to ninestrains and biological control of white mold disease in soybean plants [J]. Biocontrol science and technology, 2018, 28(2): 142-156.
[10] Kapuganti J G, Luis A J M, Yariv B.suppresses nitric oxide generation elicited byinroots [J]. Molecular Plant-Microbe Interactions, 2014, 27(4): 307-314.
[11] Anil K, Toshy A, Renu K, et al. In-vitro antagonism ofspp. againstandand their response towards growth of cucumber, bottle gourd and bitter gourd [J]. European Journal of Plant Pathology, 2015, 141(3): 523-543.
[12] 徐文, 黃媛媛, 黃亞麗, 等. 木霉-植物互作機制的研究進展[J]. 中國生物防治學報, 2017, 33(3): 408-414.
[13] Verma DP, Mouli BC. Scope for biofertilizers in tea cultivation in South India [J]. Planters Chronicle. 1995, 90(10): 495-497, 499.
[14] Onsando J M, Waudo S W. Interaction betweena species androot rot fungus of tea in Kenya [J]. International Journal of Pest Management. 1994, 40(1): 69-74.
[15] 高旭暉, 高曙暉. 茶樹葉面微域環境的病理剖析[J]. 中國茶葉加工, 2000(4): 34-37.
[16] 陳書華, 李梅, 蔣細良, 等. 防治人參銹腐病木霉菌的篩選及防治效果[J]. 中國生物防治學報, 2016, 32(2): 265-269.
[17] White T J, Bruns T D, Lee S B, et a1. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics [M]//Innis M A, Gelfand D H, Sninsky J J, et a1. PCR protocols: a guide to methods and applications. San Diego: Acad. Press, 1990: 315-322
[18] Stamatakis A. RAx ML-VI-HPC: maximum likelihood-based phylogenetic analyses with thousands of taxa and mixed models [J]. Bioinformatics, 2006, 22(21): 2688-2690.
[19] 楊合同. 木霉分類與鑒定[M]. 北京: 中國大地出版社, 2009: 65-66.
[20] Samuels G J.: Systematics, the sexual state, and ecology [J]. Phytopathology, 2006, 96(2): 195-206.
[21] Wieland M, Renate M, Thomas B, et al. The use of DNA-fingerprint analysis in the classification of some species of theaggregate [J]. Current Genetics, 1992, 21(1): 27-30.
[22] Braithwaite M, Johnston P R, Ball S L, et al.down under: spesies diversity and occurrence ofin New Zealand [J]. Australasian Plant Pathol, 2017, 46(1): 11-30.
[23] Mahmoud H E, Amgad A S, Anas E,et al. Characterization of novelisolates to select effective biocontrol agents against tomato Fusarium Wilt [J]. Plant Pathol. J, 2015, 31(1): 50-60.
[24] 張廣志, 楊合同, 張新建, 等. 木霉現有種類名錄[J]. 菌物學報, 2014, 33(6): 1210-1230.
[25] Pratik J, Pandey R N. Morphological and molecular characterization for identification of isolates ofspp. From rhizospheric soils of crops in middle Gujarat [J]. Indian Phytopath, 2017, 70(2): 238-245.
[26] 朱克恭. 樹木炭疽病[J]. 森林病蟲通訊, 1989(2): 37-40.
[27] 劉紅艷, 李維, 向芬, 等. 茶炭疽病拮抗放線菌的分離篩選與鑒定[J]. 茶葉通訊, 2017, 44(4): 24-27.
[28] Gyoung H K, Myoung T L, Jae S H, et al. Biological control of tea anthracnose using an antagonistic bacterium of bacillus subtilis isolated from tea leaves [J]. Plant Pathology. 2009, 25(1): 99-102.
[29] 趙興麗, 陶剛, 趙玳琳, 等. 鉤狀木霉ACCC31649的GFP標記及其對辣椒定殖和促生作用[J]. 植物營養與肥料學報, 2017, 23(5): 1276-1285.
[30] 徐文, 黃媛媛, 黃亞麗, 等. 木霉-植物互作機制的研究進展[J]. 中國生物防治學報, 2017, 33(3): 408-414.
[31] 馮俊清. 木霉的分離鑒定及對辣椒白絹病抑制效果和機制研究[D]. 長沙: 湖南農業大學, 2010.
[32] Hanhong B, Daniel P R, Hyoun S L, et al. Endophyticisolates from tropical environments delay disease onset and induce resistance againstin hot pepper using multiple mechanisms [J]. Molecular Plant-Microbe Interactions, 2011, 24(3): 336-351.
[33] 姬承東, 李劍峰. 高爾夫草坪蘑菇圈真菌拮抗木霉菌株的篩選及其抑菌作用[J]. 草原與草坪, 2017, 37(3): 81-85.
[34] 劉明鑫, 馬光恕, 廉華, 等. 棘孢木霉T437對黃瓜幼苗根系生理特性及立枯病防效的研究[J]. 現代化農業, 2018 (6): 29-31.
[35] Woo S L, Di B P, Senatore M, 等. Identification and characterization ofspecies aggressive toin Italy [J]. 浙江大學學報(農業與生命科學版), 2004, 30(4): 469-470.
[36] 池玉杰, 伊洪偉. 生防長枝木霉菌培養特性及形態學與系統發育學鑒定[J]. 東北林業大學學報, 2016, 44(1): 103-106, 119.
[37] 章初龍, 徐同. 木霉屬及其有性型分類學與分子系統學研究進展[J]. 浙江大學學報(農業與生命科學版), 2003, 29(4): 109-118.
[38] 袁志林, 陳益存, 章初龍, 等. 中國木霉屬內生真菌一個新記錄種(英文) [J]. 菌物學報, 2008, 27(4): 608-610.
Isolation, Screening and Identification of A Strain ofAntagonizing Tea Anthracnose
ZHAO Xingli1, ZHANG Jinfeng2, ZHOU Yufeng1*, ZHAO Dailin3,ZHANG Li4, ZHOU Luona1, TAO Gang3*
1. Guizhou Academy of Agricultural Sciences key laboatory of agricultural biotechnology, Guiyang 550006, China; 2. Guizhou Academy of Agricultural Sciences tea research institute, Guiyang 550006, China; 3. Guizhou Academy of Agricultural Sciences institute of Plant Protection, Guiyang 550006, China; 4. Guizhou Academy of Agricultural Sciences grass industry research institute, Guiyang 550006, China
To obtain antagonisticfor biocontrol of tea anthracnose, the twenty-threestrains were isolated fromrhizosphere-soil by taking gradient dilution. Among them, the strain LS17110205 against tea anthracnose was screened by using dual-culture and inhibition zone assay.The results show that the inhibitory rate of LS17110205 against tea anthracnose was up to 76.96% and a large number of white hyphae and green spores were produced on the colony of tea anthracnose, which caused the tea anthracnose colony to shrink and became dark. The fermentation liquid of LS17110205 was effective against pathogenhyphae, and the inhibitory rate was70.08%. The results show that the fermentation of the strain LS17110205 caused the tea anthracnose mycelia to shrink on the surface by scanning electron microscope analysis. LS17110205 was identified ason the basis of the morphological characteristicsand phylogenetic tree. The results provided theoretical basis in biocontrol of tea anthracnose.
rhizosphere-soil, inhibitory rate, tea anthracnose, identification,spp.
S571.1;S435.711
A
1000-369X(2019)04-431-09
2018-12-06
2019-02-13
國家現代農業(茶葉)產業技術體系建設專項資金項目(CARS-19)、國家重點研發計劃項目子課題(2016YFD0200906、2017YFD0201102)、黔科合平臺人才[2017]5717號、黔農科院自主創新科研專項字[2014]009號
趙興麗,女,碩士,主要從事植物真菌病害的防治方面的研究。*通信作者:gzzhouyf@163.com,ttg729@sina.com

