養殖池塘底泥預處理方法對BiologEco板分析結果的影響
周可 謝鳳行 張峰峰 孫海波 趙玉潔 趙瓊


摘 ? ?要:為探討不同預處理方法對養殖池塘底泥Biolog Eco板分析結果的影響,以南美白對蝦養殖池塘周邊底泥1#和中部底泥2#為研究對象,考察了文獻中常用的5種預處理方法底泥微生物群落平均顏色變化率( Average well color development,AWCD)、碳源利用模式和多樣性指數的差異。結果表明,培養3 d后周邊底泥1#樣品異養細菌總數(7.73×105 CFU·mL-1)顯著低于中部底泥2#樣品(3.48×107 CFU·mL-1)(P<0.05)。不同預處理方式底泥微生物群落的AWCD值、六類碳源利用情況、多樣性指數及主成分分析差異較大。240 h時,1#底泥方法4和方法5除對胺類碳源的利用(方法5顯著高于方法4)外,微生物群落的上述其他指標差異均不顯著(P>0.05),但有多項指標顯著優于方法1、2、3(P<0.05);2#底泥方法5處理微生物群落的多項指標顯著優于方法1~4;且無論在1#底泥還是2#底泥,方法5主成分分析的平行點均較為集中,說明其平行性較好。因此建議采用方法5進行養殖池塘底泥的預處理,即10%底泥稀釋液在250 r·min-1轉速下振蕩30 min,經600 r·min-1離心10 min,離心上清液直接接入Biolog Eco板。
關鍵詞:養殖池塘;底泥微生物群落;Biolog Eco微平板;底泥預處理方式
中圖分類號:S967.4; Q93 ? ? ? ? ? ?文獻標識碼:A ? ? ? ? DOI 編碼:10.3969/j.issn.1006-6500.2019.08.003
Abstract: In order to explore the effects of sediment pretreatment methods on the results of Biolog EcoPlate analysis in aquaculture ponds, the sediments around and in the middle of the ponds of Penaeus vannamel were taken as research objects. The differences of average well color development (AWCD), utilization of six grouped carbon source, diversity indices and the principal component analysis of sediment microbial communities were examined under five pretreatment methods commonly used in literature. The results showed that the total number of cultivable bacteria in 1# sediment (7.73×105 CFU·mL-1) were significant less than in 2# sediment(3.48×107 CFU·mL-1)after 3 day of incubation(P<0.05). And there were large differences in AWCD values, utilization of six grouped carbon sources, diversity indices and principal component analysis of sediment microbial communities under different pretreatment methods. At 240 h of incubation, there was no significant differences in above indexes of 1# sediment between methods 4 and 5 except for the utilization of amine carbon sources (method 5 was significant higher than method 4), but many indexes in the two methods ?were significant superior to method 1, 2 and 3 (P<0.05); multiple indexes of 2# sediment treated by method 5 were significantly higher than those of method 1, 2, 3 and 4(P<0.05); the parallel points of method 5 in PCA plots were aggregated indicating that the data was stable no matter in 1# sediment or 2# sediment. The results suggested that method 5 was the optimal method for pretreating aquaculture pond sediment, and the method was as follows: 10 g of sediment were transferred to a conical flask containing 90 mL 0.85% sterilized saline, shaking for 30 minutes at 250 r·min-1, the suspension was centrifuged for 10 minutes at 600 r·min-1, and the centrifugal supernatant was directly inoculated into the Biolog EcoPlates.
Key words: aquaculture pond; microbial community in sediment; Biolog Eco ? Plates; preprocessing methods of sediment
目前探究微生物多樣性的方法種類較多,Biolog方法是以研究代謝功能多樣性與活性為主的一種方法,是由美國BIOLOG公司于1989年發展起來的。Biolog方法的原理是通過微生物對多種碳底物的不同利用類型來反映微生物群落的功能多樣性[1]。Biolog方法可以直接反映微生物種群的總體活性,在表征細菌群落動態變化的時空尺度上有顯著的優勢[2-3],且具有數據量大、方便、快捷等優點,近年來被廣泛應用于土壤、水體和環境等領域[4-9]。
土壤中菌體濃度較高,利用Biolog Eco板開展微生物群落研究時,一般先制備土壤懸浮液再稀釋1 000倍或10 000倍[10-11],以避免土壤顆粒對顯色反應的干擾,同時最小化土壤樣品中化合物帶來的可能影響[12]。Biolog Eco微平板法研究中采用的土壤預處理方法有多種,主要通過振蕩、靜置、稀釋或離心等方式制備菌懸液接入Biolog Eco板[13]。
池塘底泥是池塘底部土壤、沉積物或淤泥的統稱,是池塘生態系統的重要組成部分[14]。不同池塘的土壤性質不同,同一口池塘不同位置的土壤組成也有所不同。一般而言,池塘中間底泥比靠近岸邊底泥質地更細,有機質含量相對較高[15]。目前尚少見池塘底泥的預處理方法對Biolog Eco板分析結果的影響研究。因此,本項目采用了5種常用的土壤和底泥預處理方法,對比不同預處理方法對池塘周邊底泥和中部底泥微生物群落功能多樣性的影響,以確定底泥預處理的合理方法,為開展底泥微生物群落研究提供參考。
1 材料和方法
1.1 養殖池塘的選擇及養殖管理
底泥取自天津市西青區津靜公路北側1處魚蝦混養池塘,東經117°05',北緯39°10',池塘面積為4 hm2,2017年5月20日每公頃放蝦苗30萬尾,鯉魚苗4 500尾,鰱魚3 000尾,鯽魚6 000尾,草魚300尾,養殖期間投喂魚飼料。
1.2 樣品采集
2017年6月12日用柱狀采泥器在池塘四周和中心分別采集泥樣,周邊和中部底泥分別命名為1#樣、2#樣。取樣時,用無菌藥匙剝去約0.5 cm表層泥,收集5 cm以上的底泥,每種底泥分別在3個位置取樣后混合,裝入無菌取樣瓶,低溫保存帶回實驗室開展Biolog Eco微平板試驗。泥樣的理化指標如表1所示。
1.3 測定方法
1.3.1 總異養細菌總數的測定 ? ?將所取底泥利用0.85%滅菌生理鹽水進行梯度稀釋,取合適稀釋度的0.1 mL稀釋液涂布營養瓊脂平板,28 ℃倒置培養3 d計算菌落總數。
1.3.2 底泥的預處理方法 ? ?底泥的預處理方法包括以下5種。
(1)準確稱取相當于10 g干泥的新鮮底泥,加入裝有無菌生理鹽水的三角瓶中(帶玻璃珠)制成10%底泥稀釋液,200 r·min-1振蕩30 min,靜置10 min后取上清液稀釋到10-3[16];
(2)準確稱取相當于10 g干泥的新鮮底泥,加入裝有無菌生理鹽水的三角瓶中(帶玻璃珠)制成10%底泥稀釋液,250 r·min-1振蕩30 min,靜置10 min后取上清液稀釋到10-3[10];
(3)準確稱取相當于10 g干泥的新鮮底泥,加入裝有無菌生理鹽水的三角瓶中(帶玻璃珠)制成10%底泥稀釋液,250 r·min-1振蕩30 min,取30 mL底泥懸浮液于50 mL離心管中,以600 r·min-1離心10 min,離心液稀釋到10-2;
(4)準確稱取相當于10 g干泥的新鮮底泥,加入裝有無菌生理鹽水的三角瓶中(帶玻璃珠)制成10%底泥稀釋液,250 r·min-1振蕩30 min,不靜置,底泥懸浮液直接稀釋到10-3;
(5)準確稱取相當于10 g干泥的新鮮底泥,加入裝有無菌生理鹽水的三角瓶中(帶玻璃珠)制成10%底泥稀釋液,250 r·min-1振蕩30 min,取30 mL底泥懸浮液于50 mL離心管中,以600 r·min-1離心10 min,離心液直接接入平板[17-18]。
1.3.3 Biolog Eco微平板操作 ? ?用八道移液器將底泥預處理樣液加入預熱的Biolog Eco板中,每孔加150 μL,將加好樣的Biolog Eco板加蓋放入保鮮盒中,25 ℃培養,每隔24 h利用酶標儀(Biotek Elx808)讀取各孔在750 nm和590 nm 波長下的吸光度數值。
1.4 數據處理和分析
1.4.1 池塘底泥微生物群落平均活性 ? ?Biolog Eco板具有96個孔31種碳源,每種碳源設3個重復。采用OD590-OD750的值表示微生物代謝活性,OD590和OD750的值為分別減去相應對照孔的吸光值,當上述差值為負或小于0.06時修正為0[19]。
2 結果與分析
2.1 底泥不同預處理方式的AWCD曲線
培養3 d后1#和2#號樣品的異養細菌總數(表1)分別為7.73×105 CFU·mL-1和3.48×107 CFU·mL-1,2#樣品顯著高于1#(P<0.05)。從圖1可知,1#樣5種方法AWCD值曲線的整體趨勢相同,AWCD曲線在經過一定延遲后迅速升高,進入指數增長,然后隨著時間的延長趨于穩定,達到穩定的時間點分別為192,192,192,168,144 h,在240 h時方法2、方法4和方法5的AWCD值沒有顯著差異(P>0.05),但顯著高于方法3和方法1(P<0.05);2#樣5種方法AWCD值曲線差異較大,達到穩定的時間點分別為96,96,192,168,144 h,方法1和2的AWCD值在240 h內未出現指數增長,方法3、4、5的AWCD曲線數值差別較大,240 h時方法5的AWCD值顯著高于其它方法(P<0.05)。
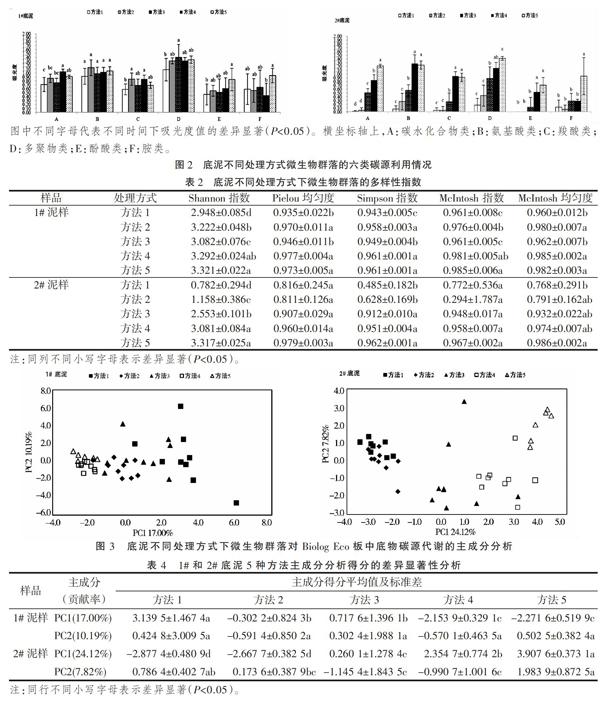
2.2 六類碳源利用情況
以240 h的數據對比5種方法的碳源利用,結果如圖2所示。除對碳水化合物、胺類碳源的利用以外,方法2、3、4、5處理的1#泥樣微生物群落對各類碳源的利用沒有顯著差異(P>0.05);2#泥樣采用方法5處理的微生物群落對碳化合物類和胺類碳源的利用顯著高于方法4(P<0.05),而其它類碳源的利用二者沒有顯著差異(P>0.05),但各類碳源的利用都高于方法1、2、3。
2.3 多樣性指數的變化
由表2可知,1#、2#泥樣方法4和方法5處理下微生物群落的各項多樣性指數均沒有顯著差異(P>0.05),但都高于其他3種方法。1#泥樣方法2的Pielou均勻度、Simpson指數和McIntosh均勻度與方法4和方法5差異不顯著(P>0.05)。2#泥樣的Pielou均勻度和McIntosh指數在各處理方法下沒有顯著差異(P>0.05),Simpson指數在方法3、4和方法5之間沒有顯著差異(P>0.05),除方法1外McIntosh 均勻度在各方法之間沒有顯著差異(P>0.05)。
2.4 主成分分析
選用240 h吸光值數據對1#和2#底泥不同處理方式進行主成分分析,結果如圖3和表4所示。1#底泥第一主成分的貢獻率為17.00%,第二主成分的貢獻率為10.19%,方法1、2、3各平行點分散分布,方法4和方法5平行點聚集緊密。對主成分分析所得的第一主成分得分和第二主成分得分進行方差分析,結果發現:1#樣第一主成分得分在方法2和方法3沒有顯著差異(P>0.05),方法4和方法5沒有顯著差異(P>0.05);2#樣第一主成分的貢獻率為24.12%,第二主成分的貢獻率為7.82%,方法1和方法2聚集分布在第一主成分負向,方法4和方法5分布在第一主成分正向;方法3各平行點分布較分散,說明方法3數據平行性較差。對主成分分析所得的第一主成分得分和第二主成分得分進行方差分析,結果發現:第一主成分得分方法3、4和5之間存在顯著差異(P<0.05),而方法1和方法2沒有顯著差異(P>0.05)。
3 結論與討論
在開展土壤微生物群落研究時,一般需要通過震蕩、離心或超聲處理等方式破壞土壤顆粒和微生物之間的氫鍵、范德華力及靜電作用制成菌懸液,在最大程度釋放微生物的同時保證微生物的活性[13]。本研究以魚蝦混養池塘底泥為研究對象,探討了底泥預處理方式對Biolog Eco板分析結果的影響。1#底泥5種方法處理底泥微生物群落達到的最大AWCD值分別為0.752 4,0.931 6,0.847 1,0.973 6和
0.954 8,其中方法1、3與方法2、4、5之間存在顯著差異(P<0.05)。2#底泥5種方法底泥微生物群落達到的最大AWCD值分別為0.056 1,0.135 3,0.488 9,
0.926 4和1.146 9,方法5的AWCD值顯著高于其它方法(P<0.05)。AWCD作為平均顏色變化率反映的是Biolog Eco板的平均活性,其值不同說明不同處理方法底泥微生物群落的平均活性差別較大,因此選擇適宜的底泥預處理方法對結果分析相當重要。
本研究發現除對胺類碳源的利用外,1#底泥微生物群落的AWCD值、六類碳源的利用、多樣性指數及主成分分析在方法4和方法5之間沒有顯著差異,但多項指標都顯著高于方法1、2和方法3(P<0.05)。2#底泥除方法4和方法5之間的多樣性指數沒有顯著差異外,方法5處理的微生物群落多項指標都顯著高于其他4種方法(P<0.05)。分析1#和2#底泥不同預處理方法后微生物群落存在顯著差異的原因與底泥性質差異有關。1#底泥取自池塘四周,土壤中的粘土含量較高[14],振蕩后不容易沉降,因此除對碳水化合物類碳源的利用及主成分分析外,1#底泥微生物群落的AWCD值、多樣性指數在方法4(不靜置)和方法2(靜置)之間沒有顯著差異(P>0.05)。2#底泥為池塘中部深水區底泥,由大量投餌的殘料、生物排泄物和尸體等長期積累及泥沙沉積形成[23]。2#底泥特別易于沉降,而且底泥因含有腐殖質具有一定的吸附作用[23],底泥懸浮液靜置后懸浮液特別通透,因此采用振蕩后靜置的方法1和方法2 處理的底泥微生物群落AWCD值未出現指數增長。
雖然1#底泥和2#底泥不同預處理方法下計算的微生物群落的AWCD值、碳源利用模式及多樣性指數存在較大差異,但是采用方法5處理的兩個底泥微生物群落的各項指標均優于其他方法。方法5對底泥懸浮進行600 r·min-1離心,離心后的上清液直接接入Biolog Eco微平板,推測低速離心通過不同的沉降速度將菌體和底泥分開[13],避免了底泥顆粒對Biolog Eco微平板顯色的影響,同時最大程度地將菌體保存在上清液中,因此建議采用方法5進行池塘底泥的預處理。
參考文獻:
[1]田雅楠,王紅旗. Biolog法在環境微生物功能多樣性研究中的應用[J].環境科學與技術,2011,34(3):50-57.
[2]IBEKWE A M, KENNEDY A C. Phospholipid fatty acid profiles and carbon utilization patterns for analysis of microbial community structure under field and greenhouse conditions[J]. FEMS microbiology ecology, 1998, 26(2): 151-163.
[3]SCHULTZ G E J, DUCKLOW H. Changes in bacterioplankton metabolic capabilities along a salinity gradient in the York River estuary, Virginia, USA[J]. Aquatic microbial ecology, 2000, 22: 163-174.
[4]李志斐,王廣軍,謝駿,等.草魚養殖池塘生物膜固著微生物群落碳代謝Biolog分析[J].水產學報,2014,38(12):1985-1995.
[5]OEST A, ALSAFFAR A, FENNER M, et al. Patterns of change in metabolic capabilities of sediment communities in river and lake ecosystems[J]. International journal of microbiology, 2018:1-15.
[6]宋收,陳曉明,肖偉,等.基于BIOLOG指紋解析土壤可培微生物對鈾污染的響應[J].核農學報,2016,30(6):1169-1177.
[7]王廣春,席勁瑛,胡洪營.不同填料甲苯生物濾塔中微生物群落結構與代謝功能解析[J].環境科學學報,2017,37(10):3936-3942.
[8]云媛,程曉鈺,王緯琦,等.喀斯特洞穴滴水細菌群落組成及其代謝功能的季節性變化[J].科學通報,2018(63): 3932-3944.
[9]金笑,寇文伯,于昊天,等.鄱陽湖不同區域沉積物細菌群落結構、功能變化及其與環境因子的關系[J].環境科學研究,2017,30(4):529-536.
[10]黨雯,郜春花,張強,等.Biolog法測定土壤微生物群落功能多樣性預處理方法的篩選[J].中國農學通報,2015,31(2):153-158.
[11]SILES J A, HLINGER B, CAJTHAML T, et al. Characterization of soil bacterial, archaeal and fungal communities inhabiting archaeological human-impacted layers at Monte lato settlement(Sicily, Italy)[J]. Scientific reports, 2018, 8 (1):1903.
[12]W?譈NSCHE L, BR?譈GGEMANN L, BABEL W. Determination of substrate utilization patterns of soil microbial communities: an approach to assess population changes after hydrocarbon pollution[J]. FEMS microbiology ecology, 1995, 17: 295-305.
[13]MAYR C, WINDING A, HENDRIKSEN N B. Community level physiological profile of soil bacteria unaffected by extraction method[J]. Journal of microbiological methods, 1999, 36:29-33.
[14]BOYD C E. Bottom soils, sediment, and pond aquaculture[M].London: Chapman and Hall, 1995:1-9.
[15]林文輝,黃志斌,林明輝,等.飼料、底泥、水質與水產病害防控關系研究[J].廣東飼料,2104,23(8):48-52.
[16]賈夏,董歲明,周春娟.微生物生態研究中Biolog Eco微平板培養時間對分析結果的影響[J].應用基礎與工程科學學報,2013,21(1): 10-19.
[17]楊鶯鶯,李卓佳,梁曉華,等.芽孢桿菌對魚池微生物群落代謝功能的影響[J].微生物學雜志,2009,29(3):11-17.
[18]劉瑞娟,田相利,董雙林,等.蝦蟹貝混養池塘生態系統微生物群落功能多樣性研究[J].水產科學,2014,33(9):535-544.
[19]CLASSEN A T, BOYLE S I, HASKINS K E, et al. Community-level physiological profiles of bacteria and fungi: plate type and incubation temperature influences on contrasting soils[J]. FEMS microbiology ecology, 2003, 44: 319-328.
[20]楊永華,姚健,華曉梅.農藥污染對土壤微生物群落功能多樣性的影響[J].微生物學雜志,2000,20(2):23-25.
[21]ANNE E M.生物多樣性測度[M].張峰,譯.北京:科學出版社,2011:75-76.
[22]GARLAND J L. Analytical approaches to the characterization of samples of microbial communities using patterns of potential c source utilization[J].Soil biology and biochemistry, 1996, 28(2):213-221.
[23]葉振國.淺談底泥對池塘養殖影響[J].水產養殖,2010(3):31-32.

